生防菌组合防控精品西瓜枯萎病的效果初探
蓝建荣,黄杰豪,黄石连,李锦旋,田 凯,刘 青,吴健雄,郑 丽
(1.仲恺农业工程学院植物健康创新研究院/仲恺农业工程学院农业与生物学院/广东省普通高校果蔬病虫害绿色防控重点实验室,广东 广州 510225;2.广东省农业科学院果树研究所/农业农村部南亚热带果树生物学与遗传资源利用重点实验室/广东省热带亚热带果树研究重点实验室,广东 广州 510640;3.中国热带农业科学院广州实验站,广东 广州 510140)
【研究意义】西瓜是世界十大水果之一,我国是世界上最大的西瓜生产国[1]。然而,为了保持我国西瓜产业的经济效益,长期连续单作使种植西瓜的土壤肥力下降,微生物群落结构发生改变,并在全国范围内引起严重的土传病害[2]。由尖孢镰刀菌引起的西瓜枯萎病(Fusarium oxysporumf.sp.niveum,FON)是影响西瓜产量最具破坏性的土传病害[3],该病原体在土壤中的长期存在以及变异种的不断进化使枯萎病的防控变得十分困难[4]。与此同时,化肥的过度使用导致农药残留超标、病虫抗药性上升[5];土传病害发生严重导致植株早衰、产量降低[6-7];土壤微生态系统发生改变,微生物区系破坏异常,成为当前限制西瓜产业发展的最大瓶颈[8]。如何降低土传病害带来的经济损失,减少化肥在农业生产中的使用是目前亟需解决的重要难题之一。
【前人研究进展】植物病害生物防治是利用有益微生物及其代谢物,对农作物病害进行有效防控的方法与技术[9]。通过改变土壤中微生物的营养环境、优化微生物群落结构、提高土壤中微生物多样性而达到抑制枯萎病菌侵染植株,达到降低枯萎病发生的目的[10]。轮作和间套作、环境调控、物理、化学防治作为目前防治土传病害的主推方向[11-12],但随着社会对抗药性、环境安全等问题的重视,使得寻找对环境、生态和人类健康安全的西瓜枯萎病防治方法迫切需要,生物防治应运而生[13]。利用生防菌株的发酵液及其分泌抗菌物质、溶菌作用、诱导植物抗病性,如“多抗霉素”对大葱紫斑病的防治效果大于化学农药“百菌清”[14],生防芽孢杆菌类杀菌剂由于能够有效控制植物病害,同时具有对人畜安全、环境相容性好、植物病原菌不易产生抗性、生产成本相对低廉等优点,必将在现代农业中有广阔的应用前景,并产生巨大的经济、社会和生态效益[15]。
【本研究切入点】研究表明利用有益微生物进行复配,将不同生防菌作用机制间的差异实现优势互补,通过协同作用形成有益微生物菌群在土壤中的良性循环,可达到对作物连作障碍中土传病害的有效控制[16]。如放线菌混合菌剂[17],哈茨木霉Tr6 与假单孢杆菌Ps14 复配菌剂[18],哈茨木霉和罗氏链霉菌[19],复合菌剂PB12 与AR99[20],荧光假单胞菌和根瘤菌的复合菌剂[21]对不同农作物真菌性病害都有较好的防治效果。前期获得5 株有益微生物,进行两菌、三菌、四菌和五菌复配,共计获得31 个生防菌组合。分别分析31 个组合对西瓜枯萎病菌的平板颉颃效果、对西瓜种子萌发和苗床出苗以及盆栽枯萎病的防效,拟初步确定有效的生防菌组合。【拟解决的关键问题】明晰生防菌组合的室内和盆栽作用效果;找寻2~3 种有效的生防菌组合,为后续开展生防菌组合的防病机制研究奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株来源 生防菌株为分离自荔枝不同生境的Bacillus amyloliquefaciens23(PP19)、Exiguobacterium acetylicum25(SI17)、B.pumilus28(PI26),以及来自南京农业大学郭坚华教授课题组的菌株B.licheniformis37(分离自黄瓜生境,HS10)和B.cereus156(分离自南京某森林土壤,AR156);病原菌由南京农业大学生物源农药实验室蒋春浩副教授提供的西瓜枯萎病菌。
1.1.2 供试生防菌组合 在-80 ℃冰箱中取出实验用生防菌株23、25、28、37、156,置于LB 平板上活化,28 ℃培养24 h 转接到LB 培养液试管中,28 ℃、200 r/min 培养20 h 作为种子培养液,以1∶500 比例将种子菌液接到LB 培养液中培养24 h。随后用酶标仪检测OD600,用无菌水将菌液浓度稀释检测至统一值为OD600=1.0。将上述获得的单菌发酵液按照表1 方法,获得31 个生防菌组合。本方法主要参照文献[22]。
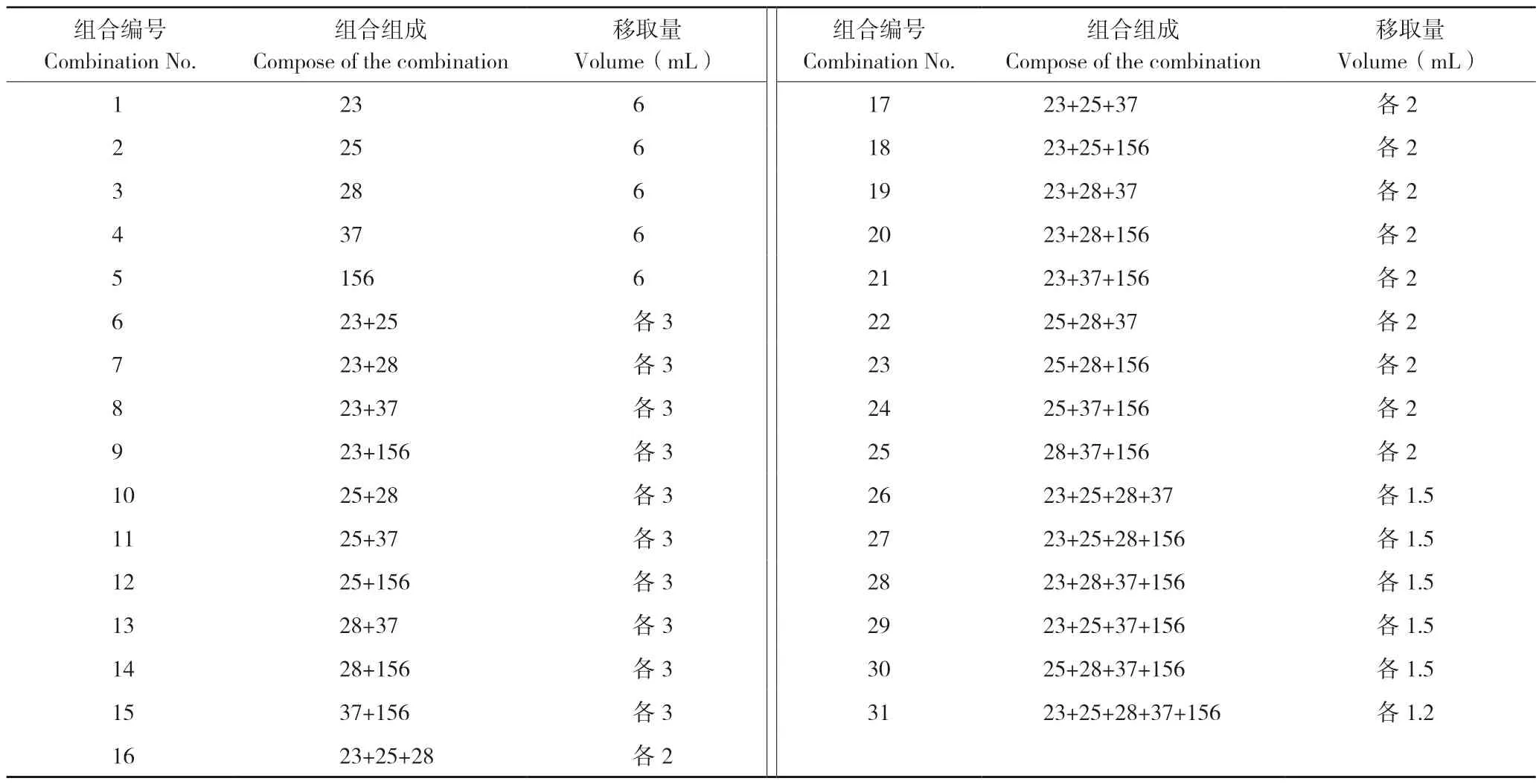
表1 复合菌剂配置方法Table 1 Configuration method of compound microbial agents
1.1.3 供试病原菌 病原菌使用PDA 平板、置于28 ℃恒温培养7~10 d。病原菌分生孢子悬浮液制备方法为:取250 mL 三角瓶,加入50 mL PDA液体,灭菌,向三角瓶中接种2~3 个直径为5 mm的FON 菌饼,28 ℃、180 r/min 振荡培养7~10 d,将灭菌茶叶漏筛置于150 mL 灭菌的三角瓶上,过滤菌丝,滤液在4 ℃、8 000 r/min 离心15 min,去掉滤液,将孢子用同体积无菌水重悬浮,取1 μL 于载玻片上显微镜观察计数100 个左右为佳,用无菌水调整分生孢子悬浮液浓度为1×106孢子/mL 备用。
1.1.4 供试植物 供试西瓜品种为玲珑(采购于湖南北盟种业有限责任公司),西瓜盆栽实验在广东省农业科学院果树研究所龙眼课题组的试验园某露天平台种植完成,西瓜种子于2021 年3 月20 日播种育苗,于4 月12 日移栽到塑料盆钵;按照常规方法进行管理,主要使用生升控缓释肥和生升有机水溶肥(广州生升农业股份有限公司)。
1.2 试验方法
1.2.1 生防菌组合的平板颉颃活性测定 采用平板对峙方法,将活化后的西瓜枯萎病菌FON 用灭菌后的打孔器从菌落的外边缘均匀打成直径为5 mm 的圆形菌块。将菌块接种在PDA 培养基中心,在培养基中心四个方位距离约27 mm 处接种10 μL 生防菌组合,28℃培养10 d,待对照菌长满整个平板后,十字交叉法记录病原菌直径大小。每个处理3 次重复。
1.2.2 生防菌组合的VOCs 平板颉颃活性测定采用分隔平板培养法,制备PDA 分隔平板(直径9 cm),每皿培养基用量为15 mL,每分隔7.5mL。分隔板一边均匀涂布各组合50 μL,另一边中心接种病原菌菌块,28 ℃培养10 d,待对照菌长满整个平板后,记录病原菌直径大小。每个处理3 次重复。
1.2.3 生防菌组合互作类型分析 取10 mL 离心管,加入PDA 培养液,如表2 所示。设置A、B 两种处理方式,分别将31 个组合生防菌剂按以下处理方式加入离心管中,处理A:0.4 mL 生防菌组合;处理B:0.4 mL 生防菌组合和0.4 mL病原菌分生孢子液悬浮液(终浓度1×105CFU/mL),对照则加入0.4 mL 病原菌分生孢子液悬浮液和PDA 培养液;置于28 ℃、180 r/min 振荡培养48 h,采用酶标仪测定其OD600并记录数据。每个处理6 个生物学重复,2 个技术重复。
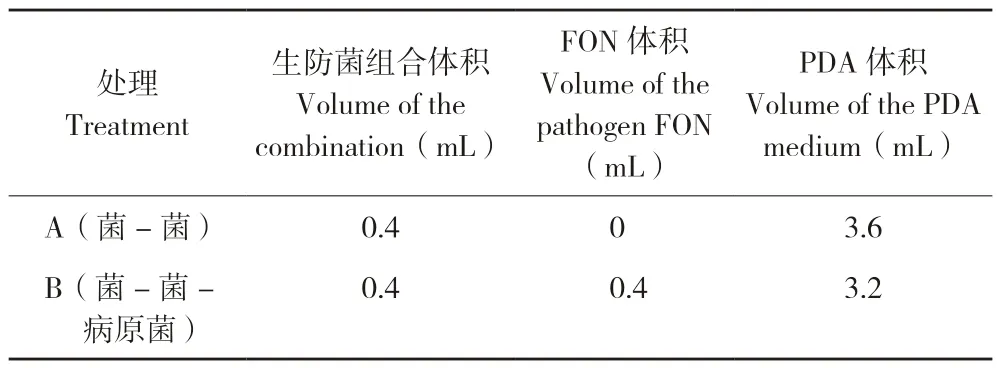
表2 菌-菌互作的培养方法Table 2 Culture method for the interaction of different bacteria
参照文献[22],设复合菌剂的平均促进作用强度MIF=lg(CPi/MPi),其中CPi为复合菌剂液体培养48 h 后的OD600,MPi为组成该复合菌剂的各菌剂单独培养48 h 后OD600的平均值。当MIF>0 时,表示该菌剂交互表现为便利型;当MIF=0 时,表示该菌剂交互表现为中立型;当MIF<0 时,表示该菌剂交互表现为颉颃型。
1.2.4 生防菌组合对西瓜种子萌发的影响测定西瓜玲珑种子40 ℃烘20 min,放入55 ℃温水,轻轻搅拌15 min,水温自然降至30 ℃,浸种3~4 h。捞出种子,用1%次氯酸钠浸泡10 min,无菌水冲洗3 次。随后31 个生防菌组合分别菌悬液浸泡30 min,放在9 cm 的无菌玻璃培养皿(底下垫上灭菌滤纸,加上15 mL 灭菌水湿润滤纸)催芽。每个处理3 次重复,每个重复10 粒种子。36~72 h 分别记录种子发芽率。试验设3 个处理:A 为31 个组合的菌悬液(OD600=0.1),B 为百菌清(1∶500),C 为无菌水。A 处理的方法为:将5 个单菌的发酵液在4 ℃、8 000 r/min 离心15 min,去掉上清液,灭菌水重悬浮菌体(灭菌水体积一般先加入发酵液体积的一半,保证菌体浓度),酶标仪检测菌悬液的OD600,用灭菌水调整到OD600=1.0,各个组合菌悬液制备方法同1.1.3,使用时将各个组合的菌悬液稀释10 倍(即OD600=0.1)。
1.2.5 生防菌组合对西瓜子叶出土的影响测定将1.2.4 中已催芽的西瓜种子播种到90 孔育苗穴盘,1 个组合1 个穴盘,3 个重复小区,每小区24~30 株苗(根据种子萌发决定)。将西瓜的胚根朝下播种在育苗盘中育苗盘打孔深度1.5 cm 左右,播种完成后用育苗基质覆盖,随后将各个处理进行喷雾处理。5 d 记录子叶出土率。设3 个处理:A 为31 个组合的菌悬液(OD600=0.1);B 为百菌清(1∶500);C 为无菌水。菌悬液制备方法同1.1.3。
1.2.6 生防菌组合对盆栽西瓜枯萎病的效果测定将1.2.5 培育的西瓜苗(30 d)进行移栽。将基质土(广州生升农业股份有限公司)浇水保持湿润,装入塑料种植袋,挑选健康壮苗进行移栽,露天条件下进行培育。每个处理3 次重复,每个重复4 株西瓜苗。移栽1 d 和10 d 后,分别将各个处理进行灌根25 mL。试验设3 个处理:A 为31 个组合的菌悬液(OD600=0.1),制备方法同1.1.3,使用时将各个组合的菌悬液稀释10 倍;B 为百菌清(1∶500);C 为无菌水。西瓜苗移栽20 d 和30 d 后,分别灌根接种西瓜枯萎病菌的分生孢子悬浮液(1×105CFU/mL)50 mL;接种病原菌后18 d 调查西瓜植株枯萎病的发病率。
抑菌率(%)=〔(对照病原菌直径-处理病原菌直径)/对照病原菌直径〕×100
发病率(%)=〔(病株数)/总株数〕×100
防治效果(%)=〔(对照发病率-处理发病率)/对照发病率〕×100
利用DPS 数据处理系统对抑菌率、种子萌发率、子叶出土率和病害防效等数据进行单因素方差分析(One-way ANOVA),并用LSD Text 比较不同处理间各项指标的差异,相关绘图采用GraphPad Prism 8.0 进行。
2 结果与分析
2.1 生防菌组合对西瓜枯萎病菌的颉颃效果分析
在平板对峙实验中,31 个组合的抑菌率范围为-1.04%~68.06%,其中30 个组合能显著抑制枯萎病菌的生长,抑菌效果较好的为组合28(23+28+37+156)、19(23+28+27)、26(23+25+28+37)、27(23+25+28+156)、31(23+25+28+37+156),对西瓜枯萎病菌的抑菌率分别为68.1%、65.3%、61.1%、61.1%;组合25(28+37+156)不影响西瓜枯萎病菌菌丝生长(图1A、C)。试验发现,单菌、双菌组合、三菌组合、四菌组合和五菌组合的抑菌率范围分别为10.88%~59.26%、3.70%~59.49%、-1.04%~65.05%、22.92%~68.06%、60.88%(图1B)。随着组合的单菌数量增多,呈现组合菌抑菌效果增强的趋势。
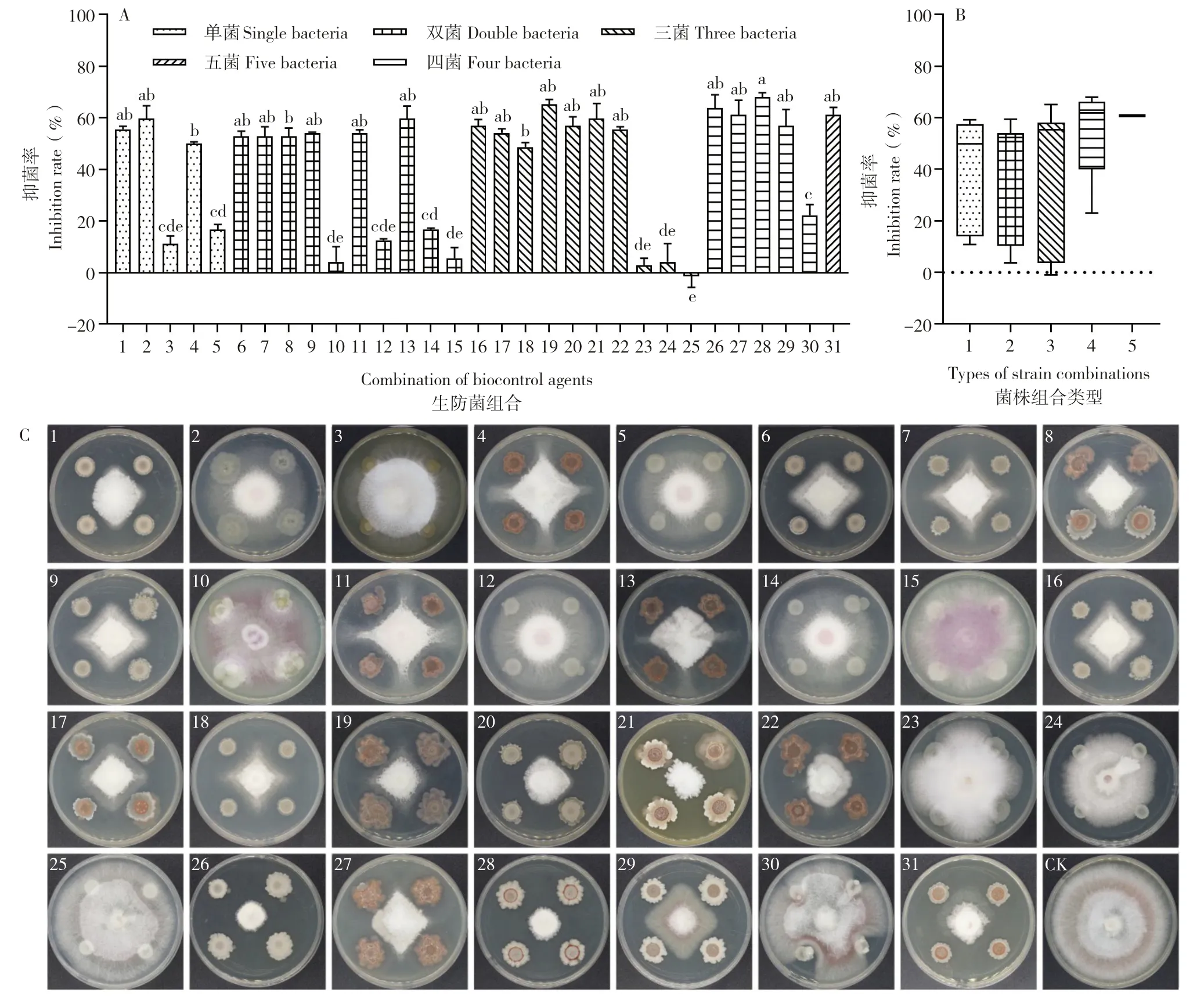
图1 31 个组合菌对西瓜枯萎病菌生长的颉颃作用(处理后10 d)Fig.1 Antagonistic effects of 31 combinations on the growth of the pathogen FON in vitro(10 d after treatment)
2.2 生防菌组合的菌源VOCs 对西瓜枯萎病菌的颉颃效果分析
分隔平板对峙实验显示,31 个组合的抑菌范围为-7.86%~41.6%,其中25 个组合均显著抑制病原菌生长。抑菌效果较好的为组合13(28+37)、8(23+37)、13(28+37)、19(23+28+37),抑菌率均大于10%;组合16(23+25+28)、18(23+25+156)、25(28+37+156)、26(23+25+28+37)、30(25+28+37+156)、31(23+25+28+37+156)不影响西瓜枯萎病菌的菌丝生长(图2A、C)。单菌、双菌组合、三菌组合、四菌组合和五菌组合的抑菌率范围分别为5.03%~7.86%、1.57%~41.6%、-5.66%~10.06%、-1.57%~6.09%、-7.86%。随着单菌数量的增多,组合的抑菌效果减弱。总体而言,菌源VOCs 的平板颉颃效果表现不显著(图2B)。

图2 31 个组合的菌源VOCs 对西瓜枯萎病菌菌素菌丝生长的效果(处理后10 d)Fig.2 Antagonistic effects of 31 combinations on the growth of FON by VOCs in vitro(10 d after treatment)
2.3 生防菌组合互作类型分析
在生防菌互作分析结果(图3A)中,26 个组合中有21 个组合交互类型表现为便利型,5 个组合交互类型表现为颉颃型。平均促进作用强度最强的5 个组合依次为组合22(25+28+37)、组合10(25+28)、组合8(23+37)、组合17(23+25+37)和组合31(23+25+28+37+156),对应的MIF 值分别为0.176、0.157、0.153、0.15和0.119。5 个颉颃型组合分别为组合9(23+156)、组合12(25+156)、组合13(28+37)、组 合14(28+156)和组合18(23+25+156),对应的MIF 值为-0.02、-0.006、-0.02、-0.081 和-0.029。
在生防菌组合与病原菌的互作分析结果(图3B)中,31 个组合中有21 个组合与病原菌的交互类型表现为颉颃型,10 个组合交互类型表现为便利型。其中,对病原菌平均拮抗强度最强的5 个组合依次为组合1(23)、组合6(23+25)、组合9(23+156)、组合18(23+25+156)和组合19(23+28+37),对应的MIF 值为-0.164、-0.137、-0.096、-0.054、-0.047;对病原菌平均促进强度最强的5 个组合依次为组合3(28)、组合12(25+156)、组合10(25+28)、组合20(23+28+156)和组合27(23+25+28+156),对应的MIF 值为0.029、0.018、0.018、0.014 和0.13。
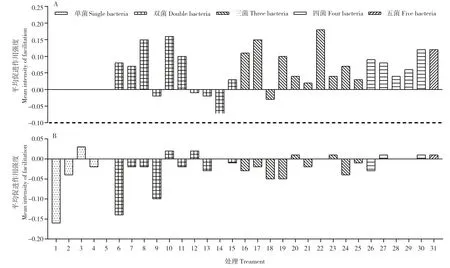
图3 生防菌-生防菌与生防菌组合-病原菌互作类型分析(处理后48 h)Fig.3 Analysis of interaction types between biocontrol agent-biocontrol agent and biocontrol agent combination-the pathogen(48 h after treatment)
综上可知,绝大部分生防菌之间互作类型多为便利型(如菌株25、28),它们的MIF 多为正值,且强度高于多数组合(如组合9、11、12)的拮抗作用。在复合菌剂与病原菌的互作类型分析中,绝大多数组合(如组合1、6、9)与病原菌的交互类型表现为颉颃型,且其拮抗作用强度高于多数便利型组合(如组合3、10、12)的促进作用。
2.4 生防菌组合对西瓜种子萌发的影响
31个组合预浸泡处理西瓜种子,影响种子萌发速率。处理后3 d,种子萌发率为80%~90%,萌发率达9 0%的有组合1 5(3 7+1 5 6)、2 3(25+28+156)、28(23+28+37+156)、29(23+25+37+156)、33(无菌水)。萌发率小于80%的有组合11(25+37)、19(23+28+37)、21(23+37+156)、25(28+37+156)。其中组合29(23+25+37+156)的萌发率最高,萌发率最低的为组合21(23+37+156)、25(28+37+156)。组合11(2 5+3 7)、1 9(23+28+37)、21(23+37+156)、25(28+37+156)种子萌发率显著低于对照,且组合11(25+37)发芽数最少;其余生防菌组合与对照差异不显著(图4A)。我们进一步发现,单菌、双菌组合、三菌组合、四菌组合和五菌组合的种子萌发率范围分别为80.0%~85.56%、77.78%~90.00%、76.67%~91.11%、86.67%~96.67%、84.44%(图4B)。可见随着单菌数量增加,种子萌发率无显著差异,单菌组合、四菌组合的萌发率相对比较集中,两菌组合分布比较分散,四菌组合催芽的情况比较好。
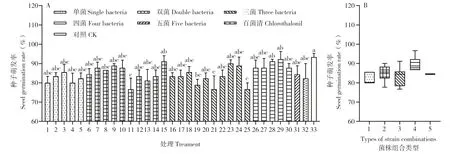
图4 生防菌组合预处理对西瓜种子萌发的影响(处理后3 d)Fig.4 Effects of 31 combinations on watermelon seed germination(3 d after treatment)
2.5 生防菌组合对西瓜子叶出土的影响
随着时间推移,子叶出土越来越多。处理后5 d 子叶出土率为:组合1(23)全部出土,且有17 个组合每处理平均出土在19 株以上、16 个处理的种子出土平均数量在19 株。其中组合26(23+25+28+37)较差,每处理仅10 株西瓜苗出土(图5A)。进一步发现,单菌、双菌组合、三菌组合、四菌组合和五菌组合的子叶出土率范围分别为87.50%~97.23%、66.67%~95.83%、45.80%~94.43%、44.43%~75.00%、72.20%(图5B)。随着单菌数量增加,子叶出土率有所下降。不同数量生防菌组合的子叶出土情况不同,单菌组合子叶出土率较高且集中,四菌组合子叶出土率最低,分散程度较大的为三菌组合。
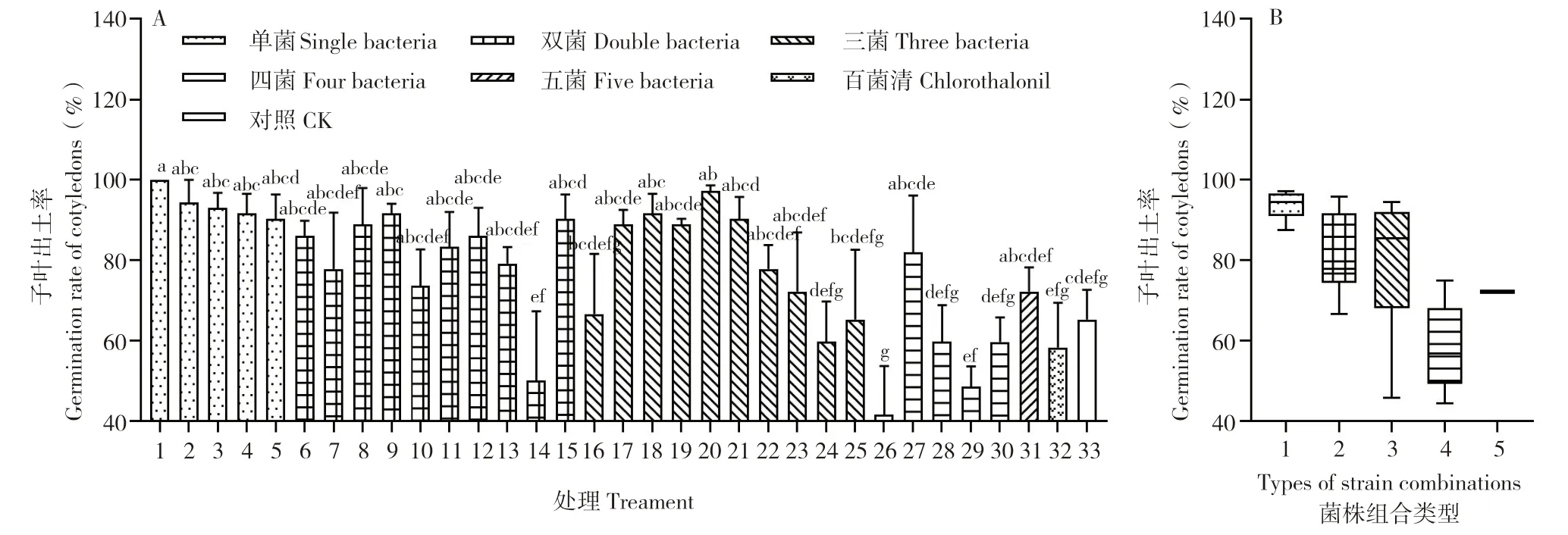
图5 生防菌组合对西瓜子叶出土率的影响(处理后5 d)Fig.5 Effects of 31 combinations on the germination rates of watermelon cotyledons(5 d after treatment)
2.6 复合生防菌剂对西瓜枯萎病的防效
盆栽试验结果显示,接种西瓜枯萎病菌18 d,各个生防菌组合处理的瓜苗发病率存在差异,组合22、13、26 的发病率最低,分别为25%、27.8%和27.8%(图6A);单菌组合平均发病率较高,以三菌组合的分布相对均匀(图6B)。与对照相比,发现31 个生防菌组合对盆栽西瓜枯萎病的防效范围为-25.0%~62.5%,化学药剂百菌清的防效为31.47%,14 个组合的防效均大于化学农药,但处理后23 d 发现百菌清和对照的瓜苗基本全部发病(数据未呈现)。生防效果最好的为组合22;防效大于50%的有组合22、13、26、17、19,分别为61.13%、61.10%、57.43%、57.40%、53.67%(图6C)。进一步分析31 个组合按单菌组合、双菌组合、三菌组合、四菌组合、五菌组合的数据分布,发现防效分别分布在0.0%~37.5%、18.75%~40.63%、29.17%~47.92%、25.0%~37.5%、12.5%,其中三菌组合复配的效果最好(图6D)。
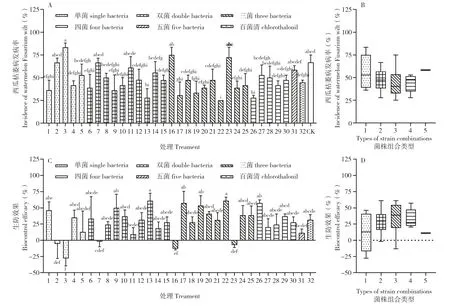
图6 复合生防菌处理对西瓜枯萎病的防治效果(处理后18 d)Fig.6 Control effects of compound biocontrol agents on watermelon Fusarium wilt(18 d after treatment)
3 讨论
西瓜的连年种植打破了根际微生物群落原有的平衡,使得细菌群落多样性下降而真菌群落多样性上升,病原真菌相对丰富度增加最终导致西瓜枯萎病暴发,产量降低[23]。故如何减少土壤中病原菌数量显得尤为重要。有报道放线菌[24]、芽孢杆菌[25]等生防菌对多种植物病害表现生防效果,但大多单一菌株的生防效果持效性差、作用谱窄,且对环境的依赖性较强[26],在防治植物病害上效果较不理想。本试验的组合2(Exiguobacterium acetylicum25)在平板颉颃中,其菌和菌源VOCs 对枯萎病菌的抑菌率分别为59.72%和4.72%,但在盆栽试验中无防效,推测单一菌株发挥的生防效果可能更易受到外界因素干扰,即当土壤温度、湿度和养分等环境因素不利于生防菌定殖扩增时,其对抗病原菌的能力也会大幅降低,这与上述报道[23]一致。
通常情况下,物种多样性高,微生物群落功能增强,抗病能力也增强。可以通过单菌进行复配增强生防特性,优势互补,抵御病原菌入侵。故通过合理设计可预测抗病能力的合成群落(Synthetic Community,SynComs)对于提高植物抗病能力非常关键[27]。在自然土壤中引入不同多样性的假单胞菌合成菌群,发现多样性高的假单胞菌群落通过加剧资源竞争和干扰性竞争来抑制病原青枯菌入侵[28]。BBS(B.cereusAR156,B.subtilisSM21,andSerratiasp.XY21)处理后甜椒疫病显著降低[29],Niu 等[30]采用两种策略获得7 株玉米栖居型的简化菌群,明显抑制病原菌Fusarium verticillioides在玉米根系的定殖。郑豆豆等[31]发现,复配菌株的各个单菌通过协同作用,扩大抑菌谱。本研究也发现类似结果,如三菌组合22(25+28+37)和组合13(28+37)对西瓜枯萎病的防治效果高达61.1%,其中前者表现正交互作用(便利型组合),后者则为负交互作用(颉颃型组合);还发现防效在30%的组合有16 个,其中11 个组合为颉颃型组合,该数据与文献[22]的研究较为一致,认为颉颃型组合更利于防病,可能是这些组合对病原菌具有较好的抑菌效果。但也存在一个问题,当单菌数量较多,生防效果呈现下降趋势,如组合30,推测菌株间可能存在营养、空间竞争导致防效下降,但具体机制有待进一步研究。因此,筛选防效西瓜枯萎病的最优组合,对于后续深入研究复配菌剂防控西瓜病害和连作障碍提供理论基础。
4 结论
31 个生防菌组合,四菌组合对FON 表现较好的平板抑菌率分布在22.92%~68.06%范围,其中组合28(23+28+37+156)的抑菌效果最佳,抑菌率达68.06%;生防菌组合的菌源VOCs 对FON的颉颃效果差异不显著,只有组合13(28+37)的菌源VOCs 抑菌效果明显,抑菌率达41.6%;多数生防菌在生长上存在协同作用,26 个组合中有21 个组合互作类型表现为便利型;生防菌组合与病原菌的生长上存在拮抗作用,31 个组合中有21 个组合与病原菌的交互类型表现为颉颃型;生防菌组合影响西瓜种子萌发和幼苗出土以及盆栽枯萎病发生,其中以三菌组合的防效较好,达到60%左右,并且颉颃型组合更利于发挥防病效果。选择合适的单菌数量组成合成菌群,对于植物病害的防控显得尤为重要。关于生防菌组合的防病机制有待进一步研究。

