基于Akt/mTOR及ERK/mTOR信号通路探究活心丸对心肌肥大大鼠自噬的影响
高展旺,张 昕,莫尊汇,廖弈秋,王羚郦*
基于Akt/mTOR及ERK/mTOR信号通路探究活心丸对心肌肥大大鼠自噬的影响
高展旺1,张 昕1,莫尊汇2, 3,廖弈秋2, 3,王羚郦1*
1.广州中医药大学中药学院,广东 广州 510006 2.广州白云山医药集团股份有限公司白云山制药总厂,广东 广州 510515 3.广东省化学药原料与制剂关键技术研究重点实验室,广东 广州 510515
基于蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)及细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)/mTOR信号通路探究活心丸对心肌肥大大鼠自噬的影响。SD大鼠ip盐酸异丙肾上腺素诱导心肌肥大,分别给予活心丸和盐酸普萘洛尔进行干预,检测大鼠超声心动图,采用ELISA法检测大鼠血清中心肌肥大指标心房钠尿肽(atrial natriuretic peptide,ANP)、脑钠肽(brain natriuretic peptide,BNP)及炎症因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)水平;采用苏木素-伊红(HE)和Masson染色观察大鼠心肌组织病理变化;采用免疫组化法检测大鼠心肌组织微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3,LC3)蛋白表达情况;采用Western blotting法检测大鼠心肌组织ERK、磷酸化ERK(phosphorylated ERK,p-ERK)、Akt、p-Akt、mTOR、p-mTOR和LC3蛋白表达情况。与模型组相比,各给药组大鼠心肌肥大缓解,心肌组织病理损伤减轻,血清中ANP、BNP、TNF-α和IL-6水平显著降低(<0.01、0.001);心肌组织中p-ERK/ERK、p-Akt/Akt和p-mTOR/mTOR蛋白表达水平显著升高(<0.05、0.01),LC3 Ⅱ/LC3 I蛋白表达水平显著降低(<0.001)。活心丸通过抑制自噬减轻大鼠心肌肥大,其机制可能与激活Akt/mTOR及ERK/mTOR通路相关。
活心丸;心肌肥大;自噬;蛋白激酶B/哺乳动物雷帕霉素靶蛋白通路;细胞外调节蛋白激酶/哺乳动物雷帕霉素靶蛋白通路
心力衰竭是一种使心脏无法维持向机体供应含氧血液的衰弱状况[1]。造成心力衰竭的原因可能为慢性心脏应激或损伤,包括压力或容量超负荷(如高血压、心脏瓣膜病)及心肌梗塞和遗传疾病[2]。心脏最初为了恢复正常心血管功能,通过增加大小和质量的方式来对超负荷或心脏损伤进行代偿性反应,这种心脏扩大的现象通常被称为病理性心肌肥大。心肌肥大虽可以有效维持心脏的正常功能,但持续病理性心肌肥大会导致心肌结构和功能异常,发生心脏重构,最终导致心力衰竭[3-4]。因此改善心肌肥大对预防心力衰竭至关重要。
近年来,随着中医药事业的发展,中医药在防治心血管疾病的治未病和防病变方面发挥着独特优势[5]。活心丸为国家中药保护品种、常用中医药方剂,人参、附子为君药,发挥补气、温阳之功效;臣药由灵芝、蟾酥、红花组成,3味药共行通经活血之效;同时配以4味动物药,达到解毒、醒神、镇心、定志、安魂的作用;冰片作为佐使药,发挥通窍开经络、引药透达的作用,在临床上已广泛用于治疗心力衰竭及冠心病[6-8]。但其治疗心肌肥大的机制未见明确报道。
自噬是维持心脏内稳态的重要生理活动,主要利用溶酶体消化损伤、衰老或过量的细胞质物质如细胞器和长寿蛋白[9]。基础自噬对于维持细胞稳态至关重要,而过度的自噬活动会加剧心脏肥大,并可能导致心力衰竭的发生[1]。抑制过度的自噬活动已成为一种新颖且有前景的治疗心肌肥大策略[10-11]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路与自噬密切相关。因此,本研究旨在探究活心丸是否通过作用于MAPK和PI3K/Akt信号通路调节自噬,进而抑制心肌肥大,为活心丸治疗心肌肥大及相关心血管疾病提供依据。
1 材料和方法
1.1 网络药理学分析
使用TCMSP数据库(http://lsp.nwu.edu.cn/ tcmspsearch.php)和BATMAN数据库(http://bionet.ncpsb.org.cn/batman)收集活心丸的主要活性成分和靶点。以口服生物利用度≥30%和类药性≥0.18为条件,筛选TCMSP数据库中活心丸的活性成分;以Score cutoff≥39为条件,筛选BATMAN数据库中活心丸动物药的活性成分。
从GeneCards数据库(https://www.genecards.org/)和OMIM数据库(https://www.ncbi.nlm.nih.gov/omim)中筛选心肌肥大相关的靶点。使用Venn图获得活心丸活性成分和心肌肥大的交集靶点,利用R语言进行京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,对KEGG通路富集分析前30个条目进行可视化分析。
1.2 体内验证实验
1.2.1 动物 SPF级雄性SD大鼠60只,6~8周龄,体质量180~220 g,购自广东省医学实验动物中心,动物合格证号SCXK(粤)2018-0002。动物饲养于广州中医药大学中药学院动物实验室,温度(25±2)℃,湿度60%~70%,人工12 h光/暗循环(8: 00~20: 00),动物喂食标准为大鼠标准饲料和无菌水。动物实验经广州中医药大学伦理委员会批准(批准号ZYD-2021-074)。
1.2.2 药品与试剂 盐酸异丙肾上腺素(质量分数99.0%,批号C10935510)购自上海麦克林生化科技有限公司;普萘洛尔(批号2020117)购自天津力生制药股份有限公司;活心丸(批号1190002)购自广州白云山制药总厂;细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)抗体、磷酸化ERK(phosphorylated ERK,p-ERK)抗体、Akt抗体、p-Akt抗体、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抗体、p-mTOR抗体、微管相关蛋白1轻链3B(microtubule associated protein 1 light chain 3B,LC3B)抗体、β-actin抗体和HPR标记的二抗购自美国Affinity公司;BCA蛋白定量测定试剂盒(批号BB20101)购自贝博公司;心房钠尿肽(atrial natriuretic peptide,ANP)、脑钠肽(brain natriuretic peptide,BNP)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒购自江苏酶免实业有限公司,批号分别为MM-21097R2、MM-0060M1、MM-0180R1、MM-0190R1。
1.2.3 仪器 Vevo 2100型超高分辨率小动物超声实时影像系统(加拿大Visual Sonics公司);D3024R型高速冷冻离心机(美国Scilogex公司);Eclipse Ci-L型正置白光拍照显微镜(日本Nikon公司);JJ-12J型脱水机、RM2016型切片机、JB-L5型冻台(武汉俊杰电子有限公司);JB-P5型包埋机(上海徕卡仪器有限公司)。
1.2.4 动物分组和造模 60只SD大鼠适应性饲养3 d,随机分为对照组、模型组、普萘洛尔(40 mg/kg)组和活心丸低、中、高剂量(12、24、48 mg/kg,分别相当于1、2、4倍临床等效剂量)组,每组10只。模型组及各给药组ip盐酸异丙肾上腺素(15 mg/kg),对照组ip等体积0.9%氯化钠溶液,1次/d,连续7 d,导致大鼠心肌肥大。造模成功后,各给药组ig相应药物(10 mL/kg),对照组和模型组ig等体积0.9%氯化钠溶液,1次/d,连续14 d。
1.2.5 超声心动图检测 末次给药前禁食24 h,末次给药后,大鼠吸入4.5%异氟烷气体进行麻醉,前胸部剃毛备皮,酒精棉球消毒。取胸骨旁左室短轴切面,由二维超声引导M型曲线并进行测量。测量指标包括超声心动图图像、左心室前壁厚度和左心室后壁厚度。
1.2.6 血清中心肌肥大标志物(ANP、BNP)及炎症因子(TNF-α、IL-6)水平的检测 大鼠ip戊巴比妥钠麻醉,腹主动脉采血,按照试剂盒说明书测定血清中ANP、BNP、TNF-α和IL-6水平。
1.2.7 脏器系数的测定 采血结束后,迅速将大鼠心脏组织及胫骨取出,以预冷的PBS溶液洗净,吸水纸吸干后,称定心脏质量,测量胫骨长度,计算心脏系数,即心脏质量/体质量、左心室质量/体质量和心脏质量/胫骨长度。
1.2.8 心肌组织病理变化检测 心脏于4%多聚甲醛中固定,留取左室心肌组织,滤纸拭干,快速剪取左室心尖部心肌组织,于4%多聚甲醛中固定,经梯度乙醇脱水、二甲苯透明、石蜡包埋后切片(厚4 μm),分别进行苏木素-伊红(HE)和Masson染色,于显微镜下观察心脏病理变化。
1.2.9 免疫组化法检测心肌组织LC3蛋白表达情况 取心脏组织切片,装片至载玻片,于40 ℃温水中放置,捞出后于37 ℃烘箱中晾干。载玻片依次浸入二甲苯、梯度乙醇中脱蜡10 min,水洗后,加入3% H2O2封闭10 min,水洗2次,柠檬酸缓冲液煮3 min,冷却至室温,水洗2次,PBS溶液浸泡2次,每次5 min。加入正常山羊血清,于37 ℃烘箱中封闭30 min,加入LC3抗体(1∶100),4 ℃孵育过夜;用PBS溶液洗涤3次,每次5 min,加入二抗,37 ℃孵育1 h;用PBS溶液洗涤后,加入链霉亲和素-生物素复合物(1∶100),37 ℃孵育30 min,加入DAB显色,并用苏木精复染。于光学显微镜下观察并拍照,采用Image-Pro plus软件分析。
1.2.10 Western blotting法检测心肌组织ERK、p-ERK、Akt、p-Akt、mTOR、p-mTOR、LC3B蛋白表达情况 取大鼠左心室心脏组织,加入含1% PMSF的裂解液后,4 ℃、14 000 r/min离心15 min,取上清液。采用BCA蛋白定量试剂盒进行定量,加入5×蛋白上样缓冲液,煮沸使蛋白变性,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入无蛋白快速封闭液溶液封闭,TBST洗脱5次,每次5 min,分别加入ERK、p-ERK、Akt、p-Akt、mTOR、p-mTOR、LC3B和β-actin抗体,4 ℃孵育过夜;TBST洗涤3次,每次5 min,加入二抗,室温孵育1 h,加入ECL显色剂显影,采用Image软件对蛋白条带进行灰度分析。
1.2.11 统计学分析 采用SPSS 24.0.0软件对实验数据进行统计学分析处理,数据以表示。组间比较采用单因素方差(One way ANOVA)分析,满足方差齐性则用LSD分析,若不满足方差齐性则用Dunnett3分析。
2 结果
2.1 网络药理学分析
活心丸活性成分和心肌肥大共有161个交集靶点,选择前30条显著富集的KEGG通路,如图1所示,富集的通路包括糖尿病并发症中的晚期糖基化终末产物(advanced glycation end products,AGE)- AGE受体(receptor of AGEs,RAGE)信号通路、流体剪切应力和动脉粥样硬化、脂质与动脉粥样硬化、乙型肝炎、MAPK信号通路和PI3K/Akt信号通路。MAPK信号通路和PI3K/Akt信号通路作为自噬的上游信号通路,可以通过磷酸化多种底物,调控自噬。

图1 活心丸活性成分-心肌肥大交集靶点的KEGG通路富集分析(前30)
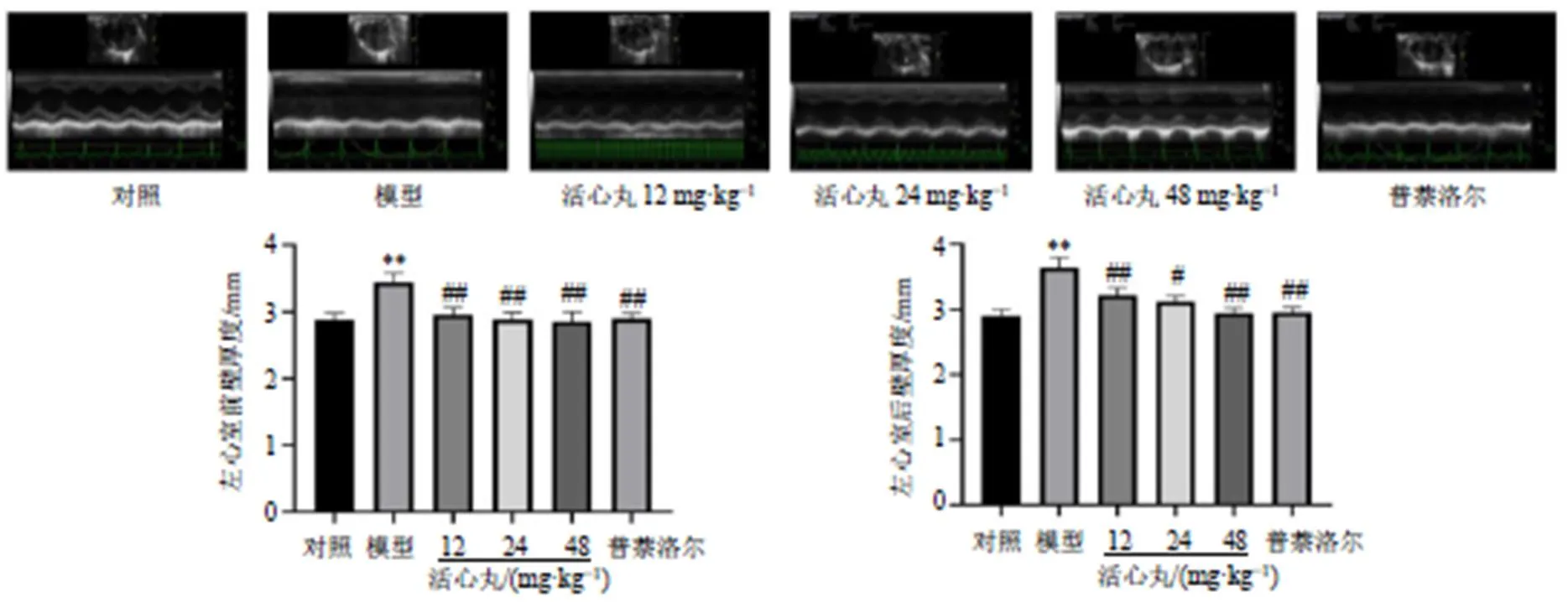
2.2 活心丸对心肌肥大大鼠超声心动图及心脏系数的影响
如图2、3所示,与对照组比较,模型组大鼠左心室前壁厚度、左心室后壁厚度、心脏质量/体质量、左心室质量/体质量和心脏质量/胫骨长度显著升高(<0.01);与模型组相比,各给药组大鼠左心室前壁、左心室后壁、心脏质量/体质量、左心室质量/体质量和心脏质量/胫骨长度显著降低(<0.05、0.01)。
2.3 活心丸对心肌肥大大鼠血清中ANP、BNP、TNF-α和IL-6水平的影响
如图4所示,与对照组比较,模型组大鼠血清中ANP、BNP、TNF-α和IL-6水平显著升高(<0.01、0.001);与模型组相比,各给药组大鼠血清中ANP、BNP、TNF-α和IL-6水平显著降低(<0.01、0.001)。表明活心丸具有减轻心肌肥大的作用。
与对照组比较:*P<0.05 **P<0.01 ***P<0.001;与模型组比较:#P<0.05 ##P<0.01 ###P<0.001,下同

图3 活心丸对心肌肥大大鼠心脏系数的影响(, n = 10)
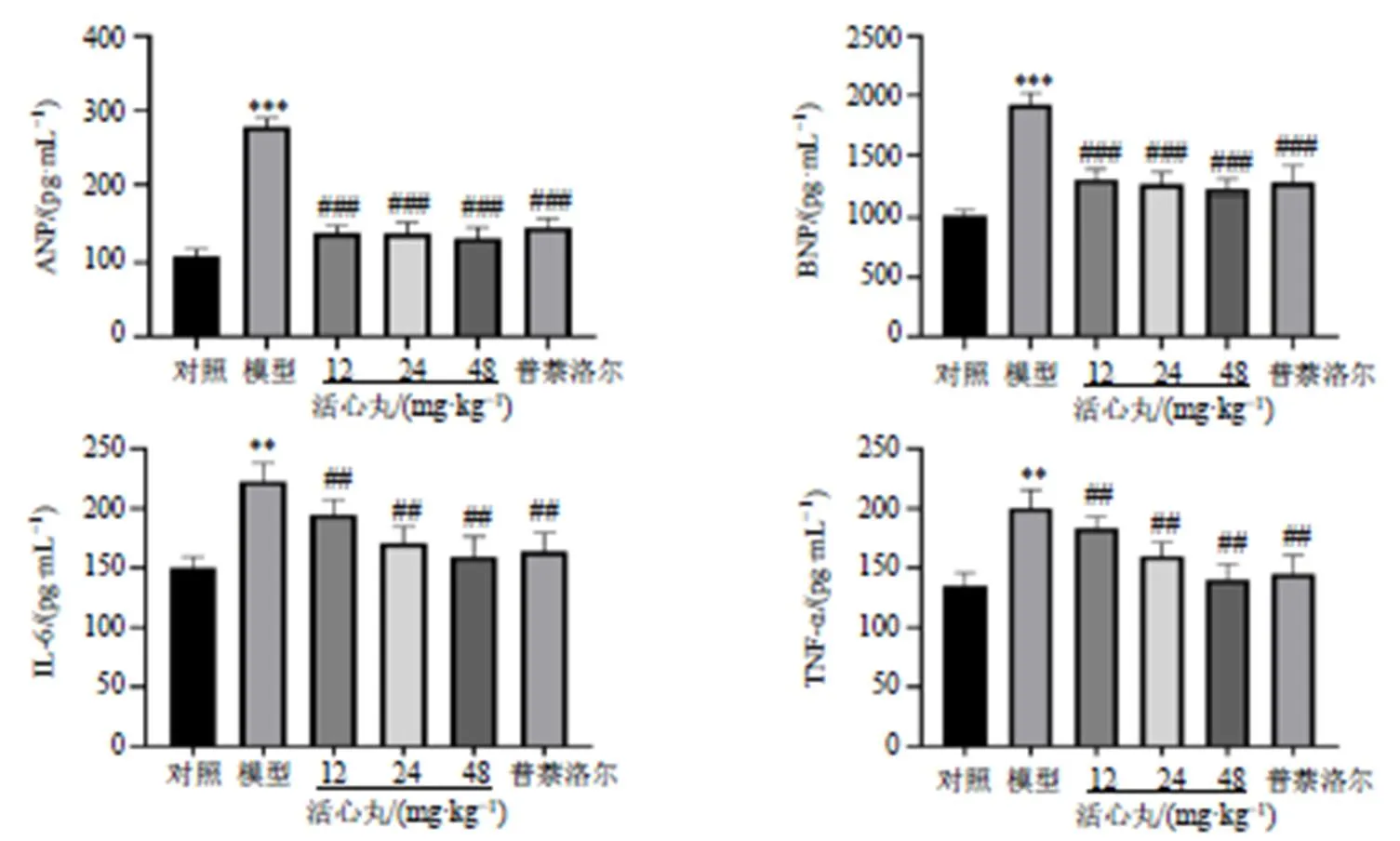
图4 活心丸对心肌肥大大鼠血清中ANP、BNP、IL-6和TNF-α水平的影响(, n = 10)
2.4 活心丸对心肌肥大大鼠心肌组织病理变化的影响
HE染色(图5)结果显示,对照组大鼠心肌细胞排列有序,细胞核在中心。模型组心肌细胞肥大,呈方形,细胞核被溶解,细胞边界不清晰,大量心肌细胞出现死亡。各给药组心肌细胞损伤减轻,细胞核位置清晰,坏死细胞较少。Masson染色结果显示,模型组心肌纤维化面积较对照组大,各给药组心肌纤维化面积明显减少。以上结果表明活心丸可以改善盐酸异丙肾上腺素诱导的心肌肥大大鼠的心肌组织结构并减少心肌纤维化。
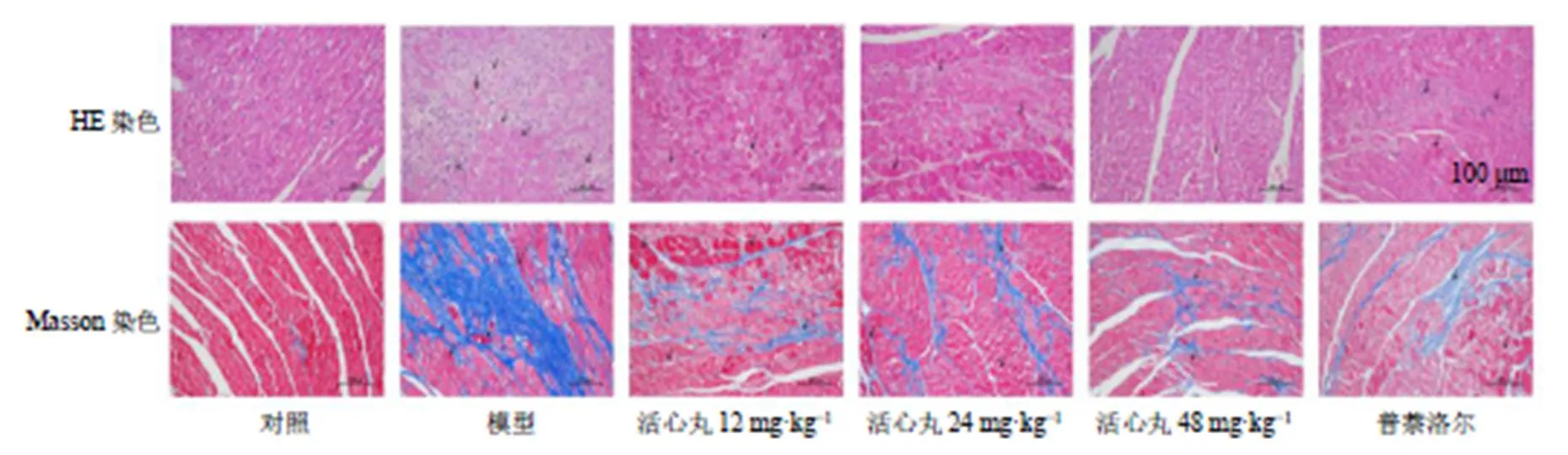
箭头表示心肌细胞损伤(肥大、炎症浸润、心肌纤维化)
2.5 活心丸对心肌肥大大鼠心肌组织LC3蛋白表达的影响
如图6所示,与对照组比较,模型组大鼠心肌组织LC3阳性表达增多(<0.01);与模型组相比,各给药组大鼠心肌组织LC3阳性表达减少(<0.01、0.001),表明活心丸能够抑制心肌肥大大鼠心肌细胞自噬。
2.6 活心丸对心肌肥大大鼠心肌组织ERK、p-ERK、Akt、p-Akt、mTOR、p-mTOR和LC3蛋白表达的影响
如图7所示,与对照组比较,模型组大鼠心肌组织中p-ERK/ERK、p-Akt/Akt和p-mTOR/mTOR蛋白表达水平显著降低(<0.01),LC3 Ⅱ/LC3 I蛋白表达水平显著升高(<0.001);与模型组相比,各给药组大鼠心肌组织中p-ERK/ERK、p-Akt/Akt和p-mTOR/mTOR蛋白表达水平显著升高(<0.05、0.01),LC3 Ⅱ/LC3 I蛋白表达水平显著降低(<0.001)。表明活心丸对异丙肾上腺素诱导的心肌细胞过度自噬的抑制作用,可能与激活Akt/mTOR和ERK/mTOR通路有关。
3 讨论
病理性心肌肥大是心血管发病率和死亡率增加的一种独立危险因素,最终会发展成心力衰竭[11-12]。心肌肥大的发病机制十分复杂,越来越多的证据表明,平衡自噬活动可以预防心脏肥大[13]。自噬从低等真核生物到哺乳动物都是保守的,是一种正常的生理降解机制。它是一种重要的分解代谢降解过程,可消除多余蛋白质与细胞器,基础自噬在维持细胞稳态方面发挥重要作用[9,14]。在横向主动脉缩窄诱导的心肌肥厚和心力衰竭小鼠模型中,心肌细胞中的自噬标志物显著减少,但在接下来的几周内随着心脏肥大的形成而增加[15]。多种心肌肥厚动物模型中均出现自噬激活[16-18]。调节自噬水平涉及AMP 激活蛋白激酶(AMP-activated protein kinase,AMPK)通路、B淋巴细胞瘤2(B-cell lymphoma 2,Bcl-2)蛋白家族和mTOR通路等多种信号通路[14]。其中,mTOR作为自噬的主要调节剂,对自噬的调节本质上也是生长与代谢之间的调节[19]。因此,本研究主要基于MAPK和PI3K/Akt信号通路,探究活心丸调节自噬进而抑制心肌肥大的作用机制。

图6 活心丸对心肌肥大大鼠心肌组织LC3蛋白表达的影响(, n = 3)
Akt是将生长因子信号连接到下游通路的中心节点,与自噬诱导有关。在生长因子存在的情况下,Akt磷酸化结节性硬化复合体1/2(tuberous sclerosis complex 1/2,TSC1/2)、富含脯氨酸Akt1底物蛋白(proline-rich Akt1 substrate of 40 kDa,PRAS40)、糖原合成酶激酶(glycose sythase kinase3,GSK3)、FoxO等多种底物,导致这些蛋白质失活。相反,生长因子限制可能导致这些底物的激活,发生随后的自噬启动[1,9]。ERK会转移到细胞核并磷酸化多种底物包括环磷腺苷反应元件结合蛋白(cyclic adenosine monophosphate response element binding protein,CREB)和Ets样蛋白1(Ets-like protein 1,Elk1)等转录因子,核靶标的激活或抑制均会导致细胞的生长、增殖以及死亡[21]。本研究利用异丙肾上腺素造成大鼠心肌肥大,然后给予活心丸进行早期心肌肥大病症治疗。研究结果表明,活心丸可以显著降低大鼠心肌肥大程度和心肌纤维化,对心肌细胞有明显的保护作用,进一步防止由病理性心肌肥大发展为心力衰竭。网络药理学结果表明,活心丸可以通过作用于MAPK和PI3K/Akt信号通路发挥抗心肌肥大作用。PI3K/Akt和MAPK通路均为mTOR的上游调节因子,能够通过激活mTOR信号通路抑制细胞自噬活动[20]。本研究结果表明,活心丸可以上调心肌肥大大鼠心肌组织p-ERK、p-Akt蛋白表达水平,进而调控底物p-mTOR蛋白表达水平,下调心肌组织中LC3 II蛋白表达水平,从而抑制自噬,减轻心肌肥大。
综上所述,活心丸可以通过激活Akt/mTOR和MAPK/ERK/mTOR信号通路抑制自噬,从而调节病理性心脏肥大。同时,活心丸与自噬之间的相互作用为减轻心肌肥大提供了新的策略,也证实了活心丸具有多靶点的作用。
利益冲突 所有作者均声明不存在利益冲突
[1] Tham Y K, Bernardo B C, Ooi J Y,.Pathophysiology of cardiac hypertrophy and heart failure: Signaling pathways and novel therapeutic targets [J]., 2015, 89(9): 1401-1438.
[2] Heinzel F R, Hohendanner F, Jin G,.Myocardial hypertrophy and its role in heart failure with preserved ejection fraction [J]., 2015, 119(10): 1233-1242.
[3] Mervaala E, Biala A, Merasto S,.Metabolomics in angiotensin II-induced cardiac hypertrophy [J]., 2010, 55(2): 508-515.
[4] Frey N, Olson E N.Cardiac hypertrophy: The good, the bad, and the ugly [J]., 2003, 65: 45-79.
[5] Wang Y, Wang Q Y, Li C,.A review of Chinese herbal medicine for the treatment of chronic heart failure [J]., 2017, 23(34): 5115-5124.
[6] 阳成俊, 杨欢.活心丸联合西药治疗对急性心肌梗死患者心功能的影响 [J].实用医技杂志, 2020, 27(10): 1360-1362.
[7] Peng M Z, Yang M L, Shen A L,.Huoxin pill attenuates cardiac fibrosis by suppressing TGF-β1/ Smad2/3 pathway in isoproterenol-induced heart failure rats [J]., 2021, 27(6): 424-431.
[8] 闫思雨, 梁晓鹏, 陆培培, 等.活心丸治疗冠心病临床应用特点探讨 [J].中国循环杂志, 2018, 33(S1): 96-97.
[9] Wu X Q, Liu Z M, Yu X Y,.Autophagy and cardiac diseases: Therapeutic potential of natural products [J]., 2021, 41(1): 314-341.
[10] Guan P, Sun Z M, Wang N,.Resveratrol prevents chronic intermittent hypoxia-induced cardiac hypertrophy by targeting the PI3K/AKT/mTOR pathway [J]., 2019, 233: 116748.
[11] Fan C L, Tang X Y, Ye M N,.Qi-Li-Qiang-Xin alleviates isoproterenol-induced myocardial injury by inhibiting excessive autophagyactivating AKT/ mTOR pathway [J]., 2019, 10: 1329.
[12] Ambrosy A P, Fonarow G C, Butler J,.The global health and economic burden of hospitalizations for heart failure: Lessons learned from hospitalized heart failure registries [J]., 2014, 63(12): 1123-1133.
[13] Wang X J, Cui T X.Autophagy modulation: A potential therapeutic approach in cardiac hypertrophy [J]., 2017, 313(2): H304-H319.
[14] Li L F, Xu J, He L,.The role of autophagy in cardiac hypertrophy [J]., 2016, 48(6): 491-500.
[15] Mariño G, Pietrocola F, Kong Y L,.Dimethyl α-ketoglutarate inhibits maladaptive autophagy in pressure overload-induced cardiomyopathy [J]., 2014, 10(5): 930-932.
[16] Yang T R, Miao Y B, Zhang T,.Ginsenoside Rb1 inhibits autophagy through regulation of Rho/ROCK and PI3K/mTOR pathways in a pressure-overload heart failure rat model [J]., 2018, 70(6): 830-838.
[17] 陈广琴, 白法文, 洪钰杰.黄芪多糖对腹主动脉缩窄大鼠心肌肥厚及自噬的影响 [J].广西医科大学学报, 2021, 38(7): 1369-1373.
[18] Ucar A, Gupta S K, Fiedler J,.The miRNA-212/132 family regulates both cardiac hypertrophy and cardiomyocyte autophagy [J]., 2012, 3: 1078.
[19] Kim Y C, Guan K L.mTOR: a pharmacologic target for autophagy regulation [J]., 2015, 125(1): 25-32.
[20] Ba L N, Gao J Q, Chen Y P,.Allicin attenuates pathological cardiac hypertrophy by inhibiting autophagy via activation of PI3K/Akt/mTOR and MAPK/ERK/ mTOR signaling pathways [J]., 2019, 58: 152765.
[21] Gallo S, Vitacolonna A, Bonzano A,.ERK: A key player in the pathophysiology of cardiac hypertrophy [J]., 2019, 20(9): 2164.
Effect of Huoxin Pills on autophagy of cardiac hypertrophy rats based on Akt/mTOR and ERK/mTOR signaling pathways
GAO Zhan-wang1, ZHANG Xin1, MO Zun-hui2, 3, LIAO Yi-qiu2, 3, WANG Ling-li1
1.School of Pharmaceutical Sciences, Guangzhou University of Chinese Medicine, Guangzhou 510006, China 2.Baiyunshan Pharmaceutical General Factory, Guangzhou Baiyunshan Pharmaceutical Holdings Co., Ltd., Guangzhou 510515, China 3.Key Laboratory of Key Technology Research on Chemical Raw Materials and Preparations of Guangdong Province, Guangzhou 510515, China
To explore the effect of Huoxin Pills (活心丸) on autophagy in rats with cardiac hypertrophy based on protein kinase B (Akt)/mammalian target of rapamycin (mTOR) and extracellular regulated protein kinases (ERK)/mTOR signaling pathways.SD rats were ip isoproterenol to induce cardiac hypertrophy, Huoxin Pills and propranolol hydrochloride were given for intervention, echocardiography of rats was detected, ELISA method was used to detect levels of cardiac hypertrophy indicators atrial natriuretic peptide (ANP), brain natriuretic peptide (BNP) and inflammatory factors TNF-α and IL-6 in serum of rats; HE and Masson staining were used to observe the pathological changes of myocardial tissue in rats; Immunohistochemistry was used to detect microtubule associated protein 1 light chain 3 (LC3) protein expression in myocardial tissue of rats; Western blotting was used to detect the protein expressions of ERK, phosphorylated ERK (p-ERK), Akt, p-Akt, mTOR, p-mTOR and LC3 in myocardial tissue of rats.Compared with model group, myocardial hypertrophy of rats in each administration group was relieved, pathological damage of myocardial tissue was alleviated, and levels of ANP, BNP, TNF-α and IL-6 in serum were significantly decreased (< 0.01, 0.001); Protein expression levels of p-ERK/ERK, p-Akt/Akt and p-mTOR/mTOR were significantly increased (< 0.05, 0.01), and LC3 II/LC3 I protein expression level was significantly decreased (< 0.001).Huoxin Pills can reduce cardiac hypertrophy in rats by inhibiting autophagy, and its mechanism may be related to the activation of Akt/mTOR and ERK/mTOR pathways.
Huoxin Pills; cardiac hypertrophy; autophagy; protein kinase B/mTOR pathway; extracellular regulated protein kinases/mTOR pathway
R285.5
A
0253 - 2670(2022)05 - 1442 - 08
10.7501/j.issn.0253-2670.2022.05.019
2021-11-03
广州市科技计划项目(202103000049)
高展旺(1998—),男,硕士,研究方向为中药学。Tel: 16624670427 E-mail: 20201110890@stu.gzucm.edu.cn
通信作者:王羚郦,女,硕士生导师,副研究员,主要从事中药学及其药理学研究。E-mail: wlingli@gzucm.edu.cn
[责任编辑 李亚楠]