甲型流感病毒对巨噬细胞的侵染及对干扰素表达的影响
徐琦 杨新燕 杨灿 沃恩康 郭潮潭
杭州医学院检验医学院与生物工程学院,杭州 310013
每年全球有超过20万的流感死亡病例,流感病毒感染至下呼吸道引起肺炎和组织损伤是患者出现重症及死亡的重要原因。肺泡巨噬细胞是肺部抵御病原体入侵的第一道屏障,广泛分布在肺泡腔内,介导并调控肺部抗病毒免疫应答,但不同于肺上皮细胞,肺泡巨噬细胞表面缺少可被甲型流感病毒识别结合的唾液酸(SA)残基,但目前针对流感病毒是否可以感染肺泡巨噬细胞,或其感染途径尚未得到证实。本研究选取3株代表性甲型流感病毒株,用RT-PCR及荧光定量PCR的方法检测巨噬细胞胞内外病毒载量、胞内病毒相关模式识别受体及对抗病毒细胞因子表达的影响,为进一步明确甲型流感病毒与巨噬细胞之间的生物学关系奠定基础。
材料与方法
一、材料
1.仪器
仪器包括PCR仪(Applied Biosystem)、核酸电泳仪(JUNYI)、高速离心机(Eppendorf)、凝胶成像分析系统(上海培清科技有限公司)、Olympus倒置显微镜、7500荧光定量PCR仪(ABI)、激光共聚焦显微镜(ZEISS)、Nanodrop2000超微量分光光度计(赛默飞)、超净工作台 (苏净安泰)、生物安全柜(ESCO)。
2.试剂
试剂包括:DMEM培养液 (BI)、胎牛血清(Gibco)、Trizol(北京康为试剂有限公司)、逆转录及嵌合荧光检测试剂盒(TAKARA),DNA聚合酶预混液 (赛默飞)、DNA Marker(DL2000)、 琼 脂糖(Biowest)。引物合成委托上海捷瑞生物技术有限公司。甲型流感病毒qPCR引物序列见表1。
表1 甲型流感病毒qPCR引物序列
注:TLR3:Toll样受体3
?
3.实验用毒株及细胞系
A/Aichi/1968(H3N2)毒株、A/Memphis/1/1971(H3N2)毒株、A/Puerto Rico/8/1934(H1N1)毒株(以下简称Aichi、Memphis和PR8)均为本实验室保存毒株。MDCK狗肾上皮细胞系购自中国科学院上海生命科学研究院细胞资源中心。MHS小鼠肺泡巨噬细胞购自武汉普诺赛生命科技有限公司。
二、研究方法
1.细胞表面SA鉴定
MDCK细胞和MHS细胞4%多聚甲醛固定5 min,0.1%吐温20的5%牛血清白蛋白封闭。FITC-接骨木凝集素(美国加利福尼亚州矢量实验室)与细胞表面SA孵育2 h。4,6-二脒基-2-苯基吲哚(DAPI)对细胞进行DNA染色,共聚焦显微镜观察细胞表面SA表达水平。使用Image J软件对荧光水平进行量化处理。
2.病毒接种巨噬细胞
Aichi、Memphis和PR8分别接种于MDCK细胞,TCID确定病毒感染滴度。MHS肺泡巨噬细胞以10密度种植6孔板,每孔对应加入10TCID病毒稀释液,对照组(NC)加入100μL的PBS,每组样本设置3个平行复孔。吸附细胞1 h后PBS洗去多余病毒颗粒,用不含FBS的DMEM培养液37℃继续培养。
3.样本采集
利用倒置显微镜拍照观察接种病毒24 h后的巨噬细胞形态及病变情况。每孔收集上清以1 500转/min离心3 min(离心半径为13.5 cm),去除细胞碎片,吸取100μL加入1 mL Trizol裂解-80℃冻存备用。贴壁细胞则经PBS清洗3遍,每孔1 mL Trizol裂解-80℃冻存备用。
4.RT-qPCR法检测上清及细胞样本病毒拷贝数
将-80℃冻存的样本充分平衡至室温,氯仿抽提RNA后,异丙醇-20℃沉淀RNA,75%乙醇清洗,上清样本用10μL RNase Free水溶解RNA,细胞样本用20μL RNase Free水溶解RNA,Nanodrop测定RNA浓度及纯度。以1μg RNA为模板量,详细操作步骤参照TAKARA试剂盒说明书。
5.病毒相关模式识别受体及抗病毒IFN检测
采用实时荧光定量PCR的方法对感染病毒24 h后4组巨噬细胞胞内Toll样受体3(TLR-3)、IFN-β和IFN-γ的转录水平进行检测。以反转录所得的cDNA 2μL为模板量,详细操作步骤参照TAKARA试剂盒说明书。各因子Ct值以GAPDH为内参归一化为ΔCt,2计算与对照组的相对表达量。
三、统计学分析
GrapadPrism软件对相对荧光定量的数据做统计学分析,多组间比较采用单因素方差分析,组间两两比较采用双侧t
检验,P
<0.05为差异有统计学意义。结 果
一、甲型流感病毒在低SA丰度肺泡巨噬细胞中的复制
图1可见,SA在MHS肺泡巨噬细胞表面呈弱阳性表达,表达水平明显低于MDCK上皮细胞。Aichi、Memphis及PR8感染的巨噬细胞胞内及上清中流感病毒基因扩增结果均为阳性,但三者之间的拷贝数存在显著的差异(详见图2),Aichi胞内Ct=14.93,上清Ct=19.05;Memphis胞内Ct=17.15,上清Ct=21.39;PR8胞内Ct=26.86,上清Ct=29.31。

图1 MDCK和MHS细胞表面唾液酸表达情况(×400)
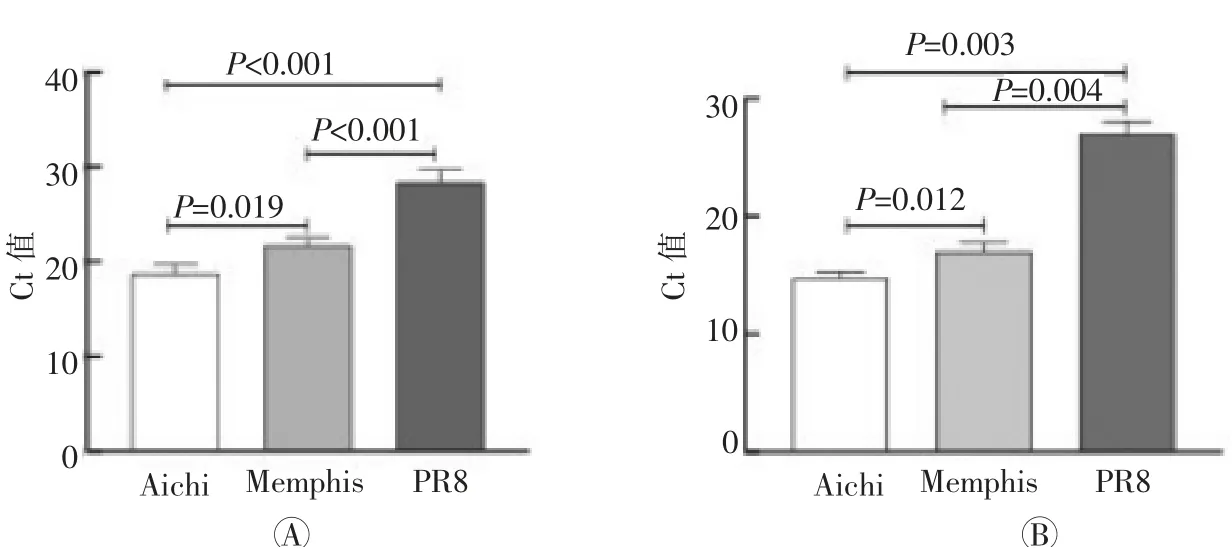
图2 巨噬细胞胞内(A)及上清(B)Aichi、Memphis及PR8流感病毒检测结果
二、甲型流感病毒对巨噬细胞的侵染
图3显示,与NC相比,PR8侵染的巨噬细胞在24 h内虽未出现明显的浊斑,但细胞间隙略有增大;Memphis侵染的巨噬细胞则可在视野中见到数个大小不等的浊斑,且部分细胞已死亡脱落导致视野中贴壁数量略有减少;Aichi侵染的巨噬细胞可见大部分细胞已脱落,少许贴壁细胞中也有明显浊斑。宿主细胞形态学的结果显示,受Aichi感染的巨噬细胞在三者之中的病变反应最严重也最迅速,PR8感染则最弱,这种形态学上的差异趋势与图2侵染病毒数量一致。
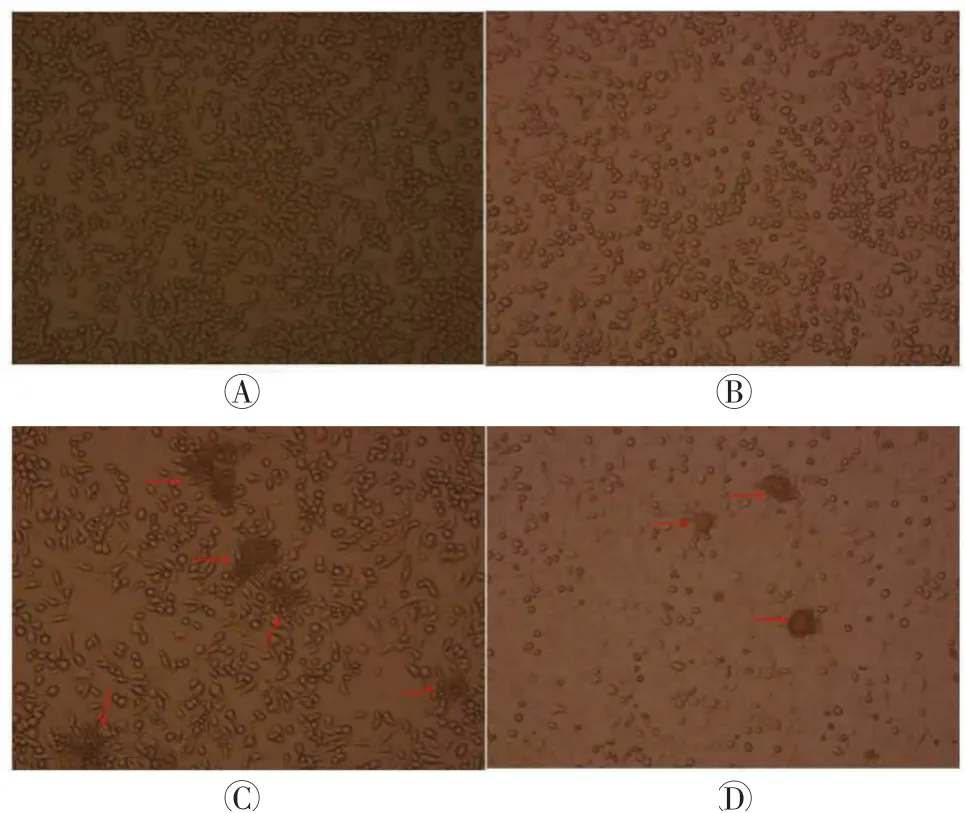
图3 Aichi、Memphis及PR8流感病毒侵染致巨噬细胞病变(倒置显微镜×100)
三、甲型流感病毒侵染对巨噬细胞IFN及相关模式识别受体表达的影响
图4可见,4组间巨噬细胞TLR3表达量差异均有统计学意义(F
=28.51,P
<0.001),与NC相比,Aichi侵染的巨噬细胞24 h后TLR3表达量升高5倍左右,差异具有统计学意义(t
=6.40,P
=0.031);而PR8和Memphis侵染组与NC相比,差异无统计学意义(t
=1.88,P
=0.134;t
=1.96,P
=0.122)。3株病毒均诱导了IFN-β的高表达,且差异有统计学意义(F
=224.00,P
<0.001),不同病毒的升高倍数呈现阶梯状(Aichi/NC=210、Memphis/NC=93、PR8/NC=33),差异均 具 有 统 计 学 意 义 (t
=23.63,P
=0.002;t
=7.20,P
=0.012;t
=6.48,P
=0.030)。Ⅱ型IFN-γ的表达则均被抑制,4组间差异具有统计学意义(F
=2 637.00,P
<0.001),经两两比较,Aichi、Memphis和PR8与NC间的差异均有统计学意义(t
=140.00、79.00和59.60,P
均<0.001)。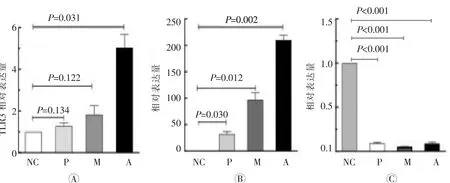
图4 Aichi、Memphis及PR8对巨噬细胞TLR3受体(A)及IFN-β(B)、IFN-γ(C)表达的影响
讨 论
肺泡巨噬细胞虽然在抵御外来病原微生物侵袭中具有重要作用,但由于它表面缺乏甲型流感病毒可结合的SA残基,因此能否被甲型流感病毒侵染尚存争议。本实验选取H1N1的实验室代表毒株——PR8和H3N2两株代表毒株——Memphis和Aichi分别侵染巨噬细胞,其中Memphis和Aichi毒株都在巨噬细胞及上清中检测到了高拷贝数,显示2株毒株可侵染巨噬细胞并在其中复制,释放子代病毒至上清中,而相同条件下PR8的拷贝数明显低于前两者。3株毒株感染巨噬细胞的能力有较大差异,提示其途径和机制可能与肺上皮细胞存在不同,它们并非通过SA受体,可能通过跨膜的其他模式识别受体,但仍需要进一步研究加以证实。
流感病毒侵染可引起宿主细胞形态学上一系列的改变。细胞病变的特征是细胞肿胀圆化,细胞间隙增大,细胞核固缩或破裂,严重时细胞融合形成浊斑,甚至部分或全部死亡脱落。本实验结果表明,Memphis和Aichi侵染可引起小鼠巨噬细胞病毒或死亡,这种巨噬细胞死亡、大量释放炎症因子的现象可大大提高机体对病毒的免疫应答效率。另外,与毒株之间感染能力有差异类似,不同毒株之间诱导细胞病变及死亡的能力也有差异。本研究发现,感染能力弱的病毒株导致的巨噬细胞病变较轻,感染能力强的病毒株导致巨噬细胞病变较重甚至引起细胞破裂死亡。另有研究表明,灭活的流感病毒可通过凋亡途径引起淋巴结内巨噬细胞大量死亡,因此本实验中3株甲型流感病毒毒株导致的巨噬细胞死亡原因,除病毒出芽被动破裂死亡外,是否还存在自身诱导机制,也需进一步探讨。
巨噬细胞TLR3位于巨噬细胞溶酶体膜上,是识别胞内流感病毒RNA的重要受体之一,结合了RNA的TLR3可激活IFN-βTIR结构域衔接蛋白诱导NF-κB抑制蛋白激酶ε/TANK结合激酶1的募集,干扰素调节因子3磷酸化入核诱导IFN-β高表达,以发挥抗病毒功能。本文结果显示,甲型流感病毒侵染可导致巨噬细胞TLR3和IFN-β高表达,但IFN-γ则明显受抑制,表明在感染甲型流感病毒24 h内可激活巨噬细胞TLR3抗病毒促炎通路,抑制免疫修复通路,与现有研究结果相类似。不同毒株诱导TLR3及相关炎症因子表达水平上也有较为明显的差异,这与病毒对巨噬细胞侵染能力呈正相关。值得注意的是,本文中的Aichi诱导TLR3表达较对照组升高5倍,Memphis和PR8则无组间差异,而3株病毒诱导的IFN-β水平却有组间差异,说明除了TLR3通路以外还存在其它炎症因子激活相关通路。
综上所述,甲型流感病毒可通过非SA受体依赖途径感染肺泡巨噬细胞,且影响巨噬细胞的一些生物学功能,不同毒株之间的侵染能力存在较大差异,因此进一步探讨甲型流感与肺泡巨噬细胞之间的作用机制对于甲型流感病毒感染及防治具有重要的理论意义。
利益冲突
所有作者均声明不存在利益冲突作者贡献声明
徐琦:论文撰写及修改;杨新燕、杨灿、沃恩康:论文修改;郭潮潭:论文指导和工作支持
