原核表达新型冠状病毒受体结合蛋白的制备及免疫原性研究
沈钱通 安彤 李思奇 张柯欣 杨宏宏 朱赟 陈刚 庄昉成 高孟
杭州医学院基础医学与法医学院,杭州 310053
新型冠状病毒可引起急性感染性肺炎,严重时可导致急性呼吸窘迫综合征或脓毒性休克,甚至死亡。疫苗是控制新型冠状病毒肺炎疫情最经济、有效的手段。虽然目前国内外已有多个疫苗被批准上市使用,但受产能和成本的限制,这些疫苗的可及性和可负担性仍亟待解决,因此开发更低成本、更高产能的新型冠状病毒疫苗有十分重要的意义。大肠埃希菌原核表达系统作为一种成熟的生物表达技术,因具备清晰遗传背景、高表达量、低成本等优势,是解决上述问题的理想选择。本研究拟采用新型冠状病毒的受体结合蛋白(RBD)为靶抗原,开展大肠埃希菌表达重组RBD的制备及免疫原性研究,从而为该类疫苗的研发奠定基础。
材料与方法
一、试剂及仪器
表 达 新 型 冠 状 病 毒 RBD(genebank:NC_045512.2,331-583aa)的大肠埃希菌重组表达菌(将密码子优化后的RBD基因载体通过XhoⅠ和NcoⅠ酶切位点插入pET-28a)由杭州医学院基础医学与法医学院实验室保存。双色预染蛋白marker购自上海雅酶生物科技有限公司。抗RBD鼠单抗购自北京义翘神州公司。羊抗鼠lgG抗体购自北京康为世纪生物科技有限公司。ACE-2蛋白、5%~20%SDSPAGE预制胶和竞争性ELISA中和抗体检测试剂盒购自金斯瑞公司,RBD混合肽库由金斯瑞公司合成,小鼠酶联斑点免疫IFN-γ检测试剂盒购自达科为公司,纯化填料CaptoS和Superdex200购自丹纳赫公司,Vero细胞和SARS-CoV-2毒种由中国CDC病毒病研究所P3实验室保存和实验,SPF级Balb/c小鼠(合格证编号:20170005044109)在浙江中医药大学实验动物中心饲养和实验[SYXK(浙)2018-0012]。
仪器包括凝胶成像系统ChemiDoc XRS(Bio-Rad)、Innova 40摇 床 (Eppendorf)、AKTA Purifier 100蛋白层析系统(Amersham Biosciences)、高速冷冻离心机 (赛默飞)、超声波破碎仪(Sonics),Zetasizer pro激光粒度仪(Malvern)和SpectraMax iD3多功能酶标仪(Molecular Devices)。
二、新型冠状病毒重组RBD的制备
取表达新型冠状病毒RBD的重组菌株活化过夜,于第2天按1∶100接种至LB液体培养基中,37℃培养OD到0.6,加入IPTG诱导蛋白表达4 h,离心收集菌液沉淀,菌液沉淀用Tris缓冲液[20 mmol/L Tris,500 mmol/L NaCl,pH:7.8]重悬,超声破菌,离心收集沉淀获得包涵体蛋白。所得包涵体用溶解液[10 mmol/L PB,8 mol/L尿素,pH:7.0]溶解2 h后离心,所得上清液用CaptoS阳离子交换层析柱纯化,洗脱得到所需的纯化蛋白用相对分子质量为10 000的密理博mini Pellicon进行切向流超滤透析复性,透析置换液配方为10 mmol/L NaHPO,1 mmol/L EDTA,0.05%吐温-80,pH:9.5,分别对复性前、后进行取样用于检测分析。复性后蛋白经Superdex200分子筛层析柱纯化得到所需的重组RBD。
三、复性前、后重组RBD的结构分析
1.SDS-PAGE
蛋白样品经非还原电泳缓冲液处理后,用5%~20%预制胶行SDS-PAGE电泳,所得凝胶在考马斯亮蓝染色脱色后,用凝胶成像系统分析蛋白条带的分子量。
2.蛋白粒径和荧光光谱测定
蛋白样本室温静置平衡10 min后,取1 mL用Zetasizer pro激光粒度仪在动态光散射(DLS)下测量蛋白粒径大小,每个样品进行3次重复检测。同时,取蛋白样本按200μL/孔加至96孔黑色平底微孔板中,每个样本设置3个平行复孔,用SpectraMaxiD3多功能酶标仪,在280 nm激发光下扫描320~400 nm范围内的最大发射波长。
3.透射电镜观察
取100μL蛋白样品滴加在铜网载膜上,滴上1%浓度的磷钨酸负染液,染色1~2 min后用滤纸吸去负染液,再用去离子水清洗铜网1~2次,用滤纸吸去水,待干燥后置于80 kV电镜下观察。
四、重组新型冠状病毒RBD的抗原活性测定
ACE-2蛋白是新型冠状病毒感染吸附的受体蛋白,通过新型冠状病毒RBD与ACE-2蛋白的亲和力来评估复性后RBD的抗原活性。取蛋白样品用稀释液按1∶1~1∶2048进行倍比稀释,所得系列稀释样品按每孔100μL加至预包被ACE-2蛋白的96孔酶标板中,同时以稀释液作为阴性对照。经37℃孵育60 min后洗板4次,加入抗新型冠状病毒RBD鼠单抗(1∶10 000)37℃孵育60 min后洗板4次,最后加入HRP标记的羊抗鼠IgG(1∶25 000),37℃孵育30 min后洗板4次,加TMB显色液终止后用酶标仪检测OD读数。蛋白抗原活性以大于阴性对照平均OD值2.1倍的最大稀释倍数作为抗原效价(EU)。
五、重组新型冠状病毒RBD在小鼠体内免疫原性检测
1.动物免疫
所得重组蛋白纯化液经0.22μm滤膜过滤除菌,加铝佐剂至终浓度为0.5 mg/mL配伍得到疫苗样品。取4~6周龄Babl/c小鼠分成试验组和空白组,每组6只,雌雄各3只。试验组免疫50μg重组RBD,空白组以含有0.5 mg/mL的铝佐剂作为免疫对照,在初次免疫后间隔7 d加强免疫2次,末次免疫后第7天眼眶采血检测,末次免疫后第14天处死采样。
2.结合抗体检测
取小鼠血清按1∶10~1∶327 680进行倍比稀释,所得系列稀释血样按100μL/孔加至预包被重组RBD的96孔酶标板中,同时以血清稀释液作为阴性对照。37℃孵育60 min后,洗板4次,加入HRP标记的羊抗鼠lgG抗体(1:20 000),37℃孵育30 min后洗板4次,加TMB显色液终止后用酶标仪在450 nm吸光度下读板。以大于阴性对照孔平均吸光度值2.1倍的最大稀释倍数为血清EU。
3.竞争ELISA法中和抗体活性检测
小鼠血清用稀释液稀释150倍后,参照试剂盒说明加入等体积的1∶1 000稀释的RBD-HRP混合后37℃孵育30 min,所得孵育混合液加至包被ACE-2蛋白的96孔板中,37℃孵育15 min后,洗板显色终止后用酶标仪检测OD读数,同时以稀释液作为阴性对照。以血清抗体竞争性抑制RBDHRP与ACE-2蛋白的亲和力作为抗体活性,计算公式如下:抑制率=(1-血清样品OD÷阴性对照OD)×100%
4.活病毒中和实验
取小鼠血清按1∶8~1∶512进行2倍倍比稀释,所得稀释液分别与2×10CCID的病毒混合后37℃孵育2 h,所得孵育混合液接种于长满单层Vero细胞的96孔板中,置37℃培养箱中培养用显微镜累积观察细胞病变7 d,以能完全抑制细胞病变的血清最高稀释倍数作为中和EU。
5.小鼠酶联斑点免疫检测
取三针免疫后第14天小鼠的脾脏在过滤网中碾磨,用红细胞裂解液红细胞,制备小鼠脾淋巴细胞悬液,经细胞计数后稀释至5×10个/mL,按100μL/孔加至细胞培养板中,用RBD混合肽库作为刺激物,每只小鼠细胞作复孔,用ELISPOT法按照试剂盒说明书检测每只小鼠脾淋巴细胞中特异性分泌IFN-γ的效应T细胞数。
六、统计学方法
采用GraphPad Prism 5.01软件进行统计分析,符合正态分布的计量资料采用x
±s
表示,组间比较采用t
检验。P
<0.05表示差异有统计学意义。结 果
一、重组新型冠状病毒RBD的制备
SDS-PAGE电泳结果显示:与诱导前菌液相比,诱导后菌液在相对分子质量为28 300处有一明显的特异性条带(如图1条带2所示)。将诱导后的菌液进行超声破菌后,离心上清中未见明显的特异性条带(如图1条带4所示),所得目的蛋白主要以包涵体形式存在(如图1条带5所示)。所得包涵体蛋白用尿素溶解后,经CaptoS柱纯化后得到纯化后目的蛋白(如图1条带6所示)。所得纯化蛋白经切向流超滤透析复性后,再经superdex200分子筛去除高聚蛋白后,即为所需的重组蛋白(如图1条带7、8所示)。
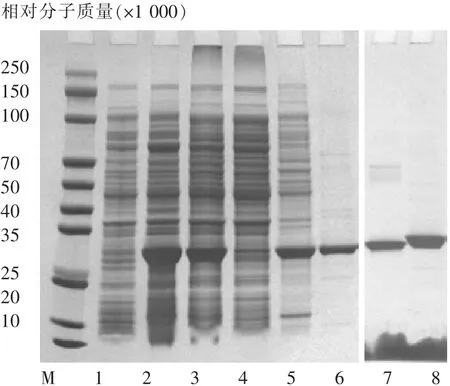
图1 重组新型冠状病毒受体结合蛋白的制备
二、重组新型冠状病毒RBD复性前后相对分子质量、荧光光谱和蛋白颗粒的比较分析
对复性前后的重组新型冠状病毒RBD进行比较分析,结果表明:重组蛋白在非还原SDS-PAGE电泳下单体蛋白的表观相对分子质量从复性前的34 500变为复性后的32 100(如图2所示);重组RBD在280 nm激发波长下自发荧光光谱发生蓝移现象,最大发射波长从复性前的(363.33±0.47)nm蓝移至复性后的(333.00±0.82)nm,表明在复性过程中,蛋白的构像发生变化,复性后重组蛋白中芳香类氨基酸残基的侧链内埋于蛋白内部。通过透射电镜观察,重组RBD从复性前杂乱无序状态(如图3 A所示),变为10 nm左右的蛋白颗粒(如图3 B所示),动态光散射粒径分析结果与电镜结果相符,重组蛋白颗粒平均直径从复性前的(0.78±0.03)nm变为复性后的(9.55±0.39)nm。进一步用ELISA检测蛋白的抗原性,结果显示复性前RBD的抗原活性为2 EU/0.1 mL,复性后RBD的抗原活性为256 EU/0.1 mL,是复性前的128倍。
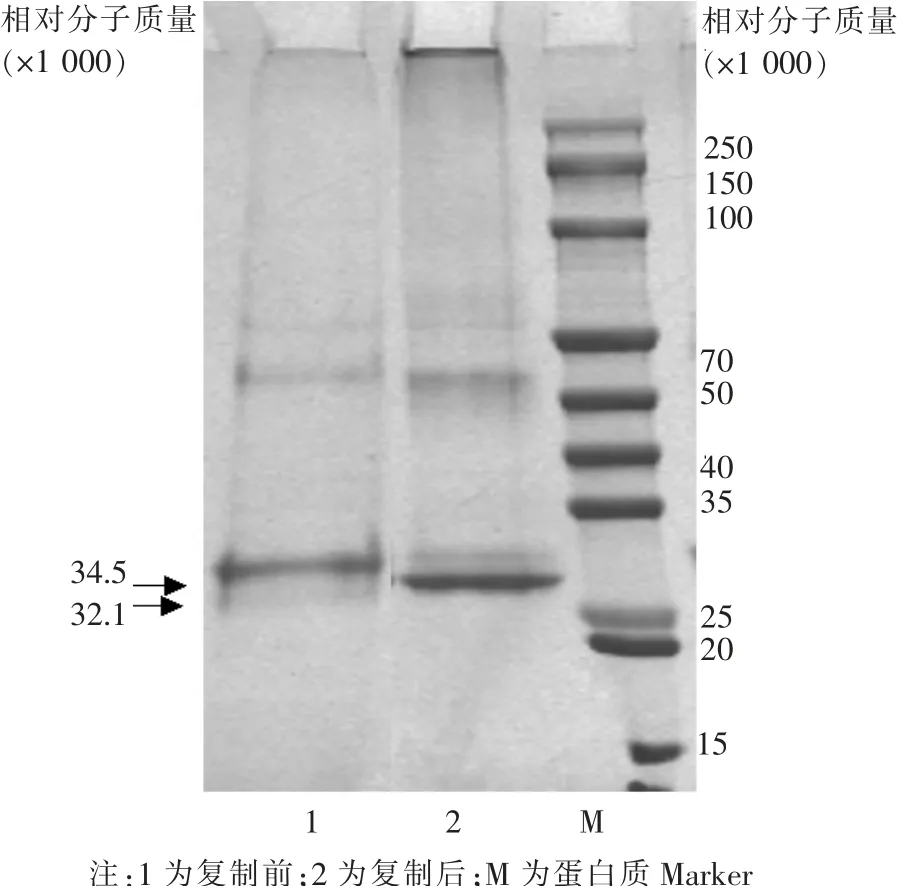
图2 新型冠状病毒受体结合蛋白复性前后非还原SDS-PAGE电泳结果

注:A为复性前电镜结果;B为复性后电镜结果
三、重组RBD在小鼠体内诱导的体液免疫
试验组的抗体几何平均数为103 212.70,空白组几何平均数为2.15,两者之间差异有统计学意义(t
=6.32,P
<0.001,图4 A)。小鼠血清竞争性ELISA抑制率检测结果显示,小鼠血清稀释150倍后,实验组血清的平均抑制率为(86.02±4.59)%,空白组平均抑制率为(3.07±0.77)%,两者之间差异有统计学意义(t
=41.83,P
<0.001,图4 B)。活病毒中和抗体检测结果显示,血清对原型株的滴度几何平均数为136.70,对贝塔株的滴度几何平均数为101.59,两者差异无统计学意义(t
=0.41,P
=0.700);血清对原型株空白组的滴度几何平均数为2.83,其与原型株试验组之间差异有统计学意义(t
=5.65,P
<0.001),对贝塔株空白组的滴度几何平均数为2.24,其与贝塔株试验组之间差异有统计学意义(t
=3.21,P
=0.020,图4 C)。四、重组RBD在小鼠体内诱导的特异性细胞免疫
如图4 D所示:试验组小鼠脾淋巴细胞产生的分泌特异性IFN-γ的效应T细胞数为 (308.50±144.11)个斑点形成细胞(SFC)/5×10个细胞,对照组为(3.75±3.11)个SFC/5×10个细胞,两者之间差异有统计学意义(t
=4.72,P
=0.010)。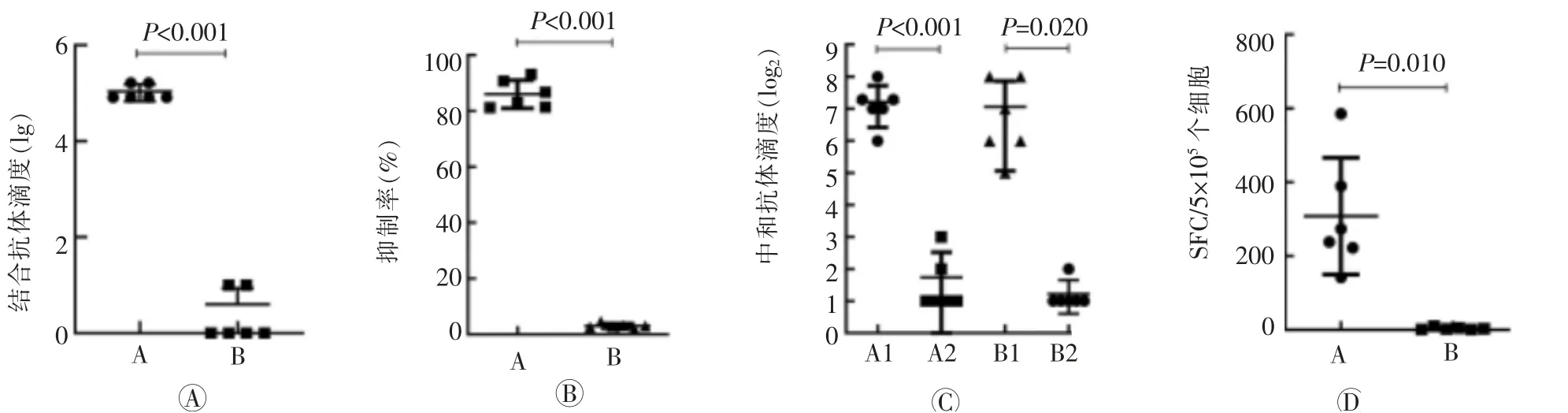
图4 重组新型冠状病毒受体结合蛋白的免疫原性结果(n=6)
讨 论
新型冠状病毒的RBD在病毒吸附感染宿主细胞的过程中起着十分关键的作用,以RBD作为靶抗原开展新型冠状病毒疫苗的研究已在临床上被证明切实可行。借助大肠埃希菌来制备新型冠状病毒RBD,可以实现新型冠状病毒疫苗更低的生产成本和更高的产能,但是大肠埃希菌在表达重组蛋白的过程中,往往以无序折叠的包涵体形式存在,这种包涵体蛋白没有生物活性,需要通过合适的方式来实现包涵体蛋白在体外的正确复性与折叠。借助这种技术开展疫苗研究已有先例,已上市的HEV 239(Hecolin)戊型肝炎疫苗就是通过这种方法制备而成。本研究发现,大肠埃希菌所表达的RBD也以包涵体的形式存在,通过切向流超滤膜包复性的方式,RBD包涵体蛋白在合适的缓冲体系中成功复性成为具有良好生物活性的蛋白抗原。在这个复性过程中,RBD在非还原SDS-PAGE中的表观相对分子质量、荧光光谱的蓝移、蛋白颗粒的大小等方面均发生了变化,蛋白从无序的状态变成有序的球状颗粒,从而使蛋白的生物活性得到提升,复性后新型冠状病毒RBD与ACE-2的亲和力较复性前有了明显加强。
本文进一步将重组新型冠状病毒RBD与铝佐剂配伍后,对小鼠体内的免疫原性进行了评估,结果显示,免疫后小鼠体内产生高水平的结合抗体和中和抗体,所产生的中和抗体能分别有效中和新型冠状病毒原型株和贝塔变异株,且两者之间的中和抗体效价差异不显著,说明所得RBD具有一定的应对病毒变异的能力。同时,酶联斑点免疫检测结果显示免疫后小鼠体内产生了较好的针对RBD的特异性细胞免疫应答,这种特异性细胞免疫对机体清除病毒感染的意义重大。
尽管新型冠状病毒的RBD是一种高度糖基化的蛋白,而原核表达系统由于缺乏翻译后修饰,使得其产生的RBD缺乏糖基化的修饰,但是本研究结果表明,不具有糖基化修饰的RBD通过体外的复性也能产生较好的中和抗体水平。Du等研究发现大肠埃希菌表达的SARS-CoV RBD能在小鼠体内诱导高水平的中和抗体,这预示着冠状病毒的RBD中可能存在着一些不需要糖基化修饰的中和位点,后续我们将对此开展进一步的研究。
综上所述,本研究制备的原核表达的新型冠状病毒重组RBD可以通过体外复性、折叠的方式获得良好的免疫原性,从而为开发一种低成本、高产能的全球性新型冠状病毒疫苗带来希望。
利益冲突
所有作者均声明不存在利益冲突作者贡献
沈钱通:实验研究、采集数据、分析数据、起草文章、统计分析;安彤:实验研究、采集数据、统计分析;李思奇:实验研究、采集数据;张柯欣:采集数据;杨宏宏:实验设计、实验研究;朱赟:论文审阅、经费支持;陈刚:实验设计、研究指导;庄昉成:经费支持、论文指导;高孟:经费支持、论文审阅
