猪圆环病毒2型和3型双重PCR方法的建立及在藏猪猪圆环病毒检测中的应用
朱家平, 肖 琦, 钱雯娴, 赵霞玲, 张冯禧, 尹力鸿, 温立斌, 索朗斯珠, 何孔旺
(1.西藏农牧学院动物科学学院,西藏林芝 860000;2.江苏省农业科学院兽医研究所/农业部兽用生物制品工程技术重点实验室,江苏南京 210014)
猪圆环病毒(PCV)为单链负股环状且无囊膜的DNA病毒,属于圆环病毒科圆环病毒属,结构为20面对称体,是现已知的最小的动物病毒。猪圆环病毒可分为4个型:1974年由Tischer等首次分离得到的无致病性的猪圆环病毒1型(PCV-1);Ellis等在加拿大西部猪群中分离得到的 PCV-2;2015年美国北卡罗来纳州学者在猪群中发现的PCV-3;2019年在湖南病猪中发现的新的圆环病毒,暂定为猪圆环病毒4型(PCV-4)。其中,PCV-2能够引起严重的猪圆环病毒病,损害机体免疫系统,增大混合感染的概率,且PCV-3与猪圆环病毒相关性疾病的发生联系紧密。在我国,于2000年郎洪武等首次分离得到PCV-2;PCV-3于2017年首次被发现,之后在辽宁省、江西省、江苏省均有报道。猪圆环病毒病在世界各个国家都有报道,我国也是感染较为严重的国家,且存在PCV-2与PCV-3混合感染的情况。但目前检测PCV-2和PCV-3的PCR方法局限于单一PCR,双重PCR同时检测PCV-2和PCV-3的报道还很少。藏猪是主要分布于我国青藏高原的小型猪种,具有适应性强、抗病耐粗的特点;目前很少有关于西藏地区藏猪圆环病毒的报道。因此,建立一种快捷、灵敏、可靠的双重PCR方法检测并区分PCV-2和PCV-3,对临床诊断和防控猪圆环病毒病具有深远意义。本试验旨在建立一种具有较高灵敏度的、能够同时检测PCV-2与PCV-3的双重PCR方法,并对西藏地区临床健康藏猪进行检测,从而为西藏地区PCV的流行病学调查提供依据。
1 材料与方法
1.1 病毒株、菌株与临床样品
大肠杆菌Trans5α、PCV-2和PCV-3阳性病料、PCV-1、猪瘟病毒(CSFV)、猪呼吸道疾病综合征(PRRSV)、伪狂犬病病毒(PRV)、猪细小病毒(PPV)、猪流行性腹泻病毒(PEDV)等常见猪源病原均由江苏省农业科学院兽医研究所保存。47份藏猪粪便样品于2020年6月采集于西藏林芝周边地区。
1.2 试验时间及地点
本试验于2020年7—10月在江苏省农业科学院兽医研究所、农业部兽用生物制品工程技术重点实验室完成。
1.3 主要试剂
Green Taq Mix购自南京诺唯赞生物科技股份有限公司;DL-2000 DNA marker、pClone007 Simple Vector Kit、琼脂糖购自北京擎科生物科技有限公司(南京);DNA提取试剂盒购自广州美基生物科技有限公司;胶回收试剂盒和质粒提取试剂盒均购自美国Omega公司;引物合成和测序均由北京擎科新业生物技术有限公司合成。
1.4 引物的设计与合成
用笔者所在实验室已有的引物序列检测 PCV-2 和PCV-3,PCV-2检测引物为PCV-2-SF(5′-G G T T A G A C G G A T A T T G T A G T C C-3′)和 PCV-2-SR(5′-C G T T T C C G C A G A A G A A G A C A C-3′),扩增长度为630 bp;PCV-3检测引物为PCV-3-A2-U(5′-C A G C T G T G G G C C T C C T A A T G A A T-3′)和 PCV-3-A2-L(5′-C C C C C G T G G C T T G A A A T A C A G-3′),扩增长度为932 bp。
1.5 临床样品处理与病毒DNA提取
取适量粪便装入干净的EP管中,向管中加入2倍体积的0.01 mol/L无菌PBS(pH值7.0),制成悬浮液,反复冻融3次;将冻融的样品于4 ℃下 10 000离心5 min,取上清于EP管中,用Magen生物公司的组织DNA抽提试剂盒,按说明书中的步骤提取样品核酸作为模板。
1.6 单一PCR扩增
以提取的DNA为模板,用PCV-2-SF、PCV-2-SR、和PCV-3-A2-U、PCV-3-A2-L引物进行PCR扩增。2型最适PCR体系为25 μL:2 μL模板,1 μL的上游引物,1 μL的下游引物,2×mix 12.5 μL,无菌水8.5 μL;最适反应条件:94 ℃预变性5 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸45 s,扩增35个循环;72 ℃延伸7 min。3型最适PCR体系为25 μL:1 μL模板,1 μL的上游引物,1 μL 的下游引物,2×mix 12.5 μL,无菌水9.5 μL;最适反应条件:94 ℃预变性5 min;95 ℃变性30 s,53.6 ℃退火30 s,72 ℃延伸65 s,扩增35个循环;72 ℃延伸7 min。PCR产物用1%琼脂糖凝胶电泳检测并观察扩增结果。
1.7 PCV-2和PCV-3阳性质粒的制备
用引物PCV-2-SF、PCV-2-SR、和PCV-3-A2-U、PCV-3-A2-L阳性样品进行PCR扩增,得到相应的特异性条带,将目的条带进行切胶回收,用pClone007 Simple Vector Kit 进行TA克隆,将克隆送至北京擎科新业生物技术有限公司进行测序,并将含有目的片段的质粒作为阳性质粒。
1.8 双重PCR扩增条件筛选
在单重PCR的基础上,筛选双重PCR的最适退火温度、循环数、引物浓度,确定双重PCR的最适反应条件,并验证其特异性和敏感性。
1.9 双重PCR的敏感性试验
计算PCV-2、PCV-3的初始质粒浓度,并将其进行倍比稀释,用已建立好的最适单重PCR条件和双重PCR条件对不同浓度的阳性标准物进行检测,来确定双重PCR的敏感性。
1.10 双重PCR的特异性试验
用建立的方法对PCV-2、PCV-3和PCV-2与PCV-3混合物以及实验室保存的其他常见病原进行检测,验证此方法的特异性。
1.11 双重PCR重复性试验
在摸索双重PCR最适条件时,不同条件均做3组重复,降低试验结果出现偶然性,并用建立的方法对3份PCV-2阳性样品DNA、3份PCV-2阴性样品DNA、3份PCV-3阳性样品DNA、3份PCV-3阴性样品DNA等一些其他病原检测1次/周,重复检测3次,验证双重PCR的重复性。
1.12 临床检测与统计分析
收集2020年6月西藏林芝市周边地区藏猪粪便47份,用Magen生物公司的DNA抽提试剂盒按照说明书对其进行DNA提取,用单重PCR和建立的双重PCR的方法对样品中PCV-2和PCV-3进行检测,并用Rstudio 1.2.5033软件对检测结果进行统计分析。
2 结果与分析
2.1 PCV-2和PCV-3阳性质粒的制备
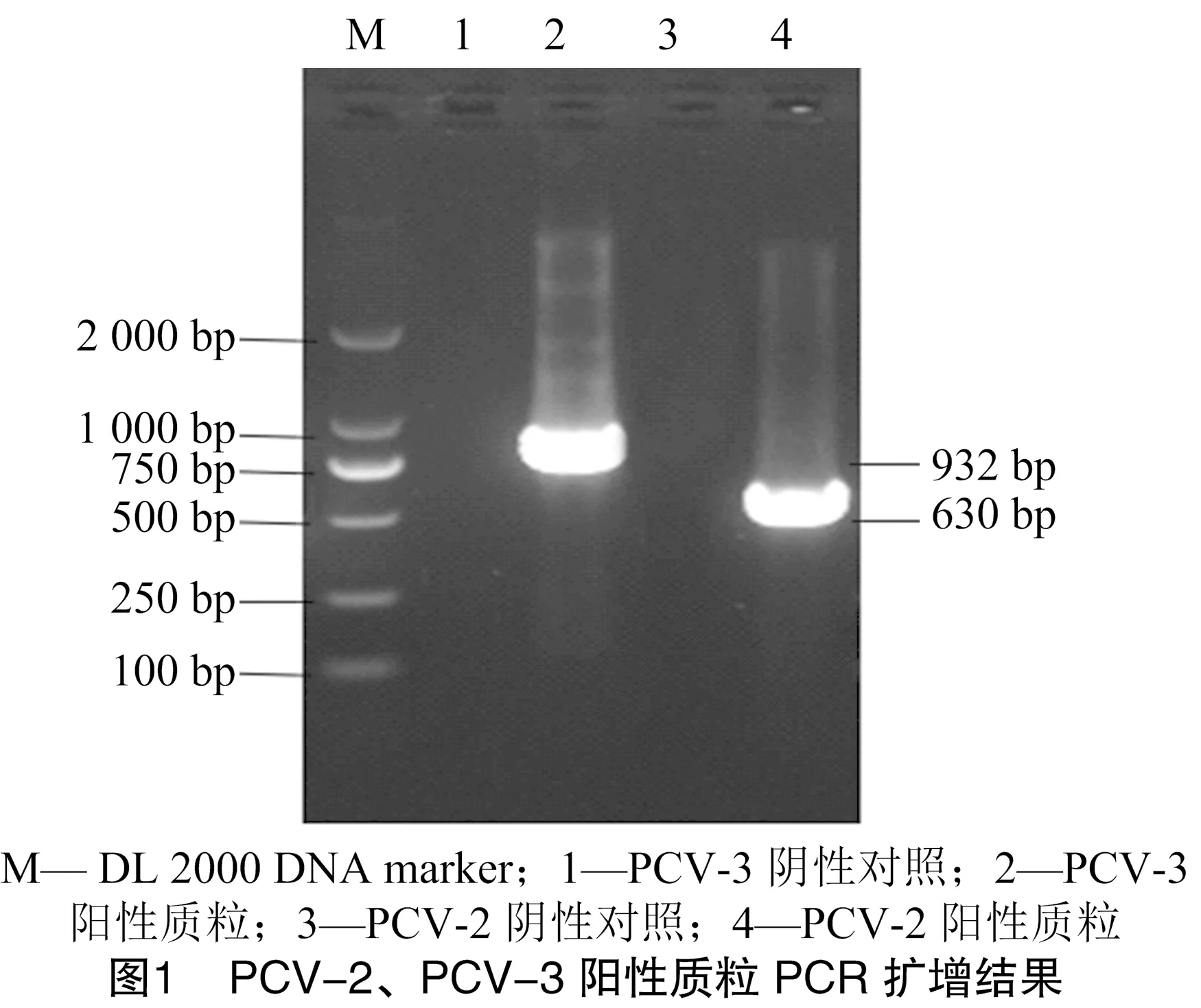
用PCV-2和PCV-3的引物对病料核酸进行PCR扩增,分别得到630、932 bp特异性条带,与预期相符。切胶回收后进行TA克隆、质粒提取,再次PCR验证均可获得特异性条带,表明成功构建 PCV-2 和PCV-3阳性质粒(图1)。
2.2 双重PCR扩增条件优化
2.2.1 双重PCR退火温度的优化 以PCV-2和PCV-3单重PCR检测方法为基础,选取合适的模板浓度,设置4个温度(53、54、55、56 ℃)作为退火温度进行双重PCR的扩增,用1%琼脂糖凝胶电泳观察扩增,结果发现双重PCR在54 ℃时PCV-2和PCV3的扩增效果最好,故确定最适退火温度为 54 ℃(图2)。

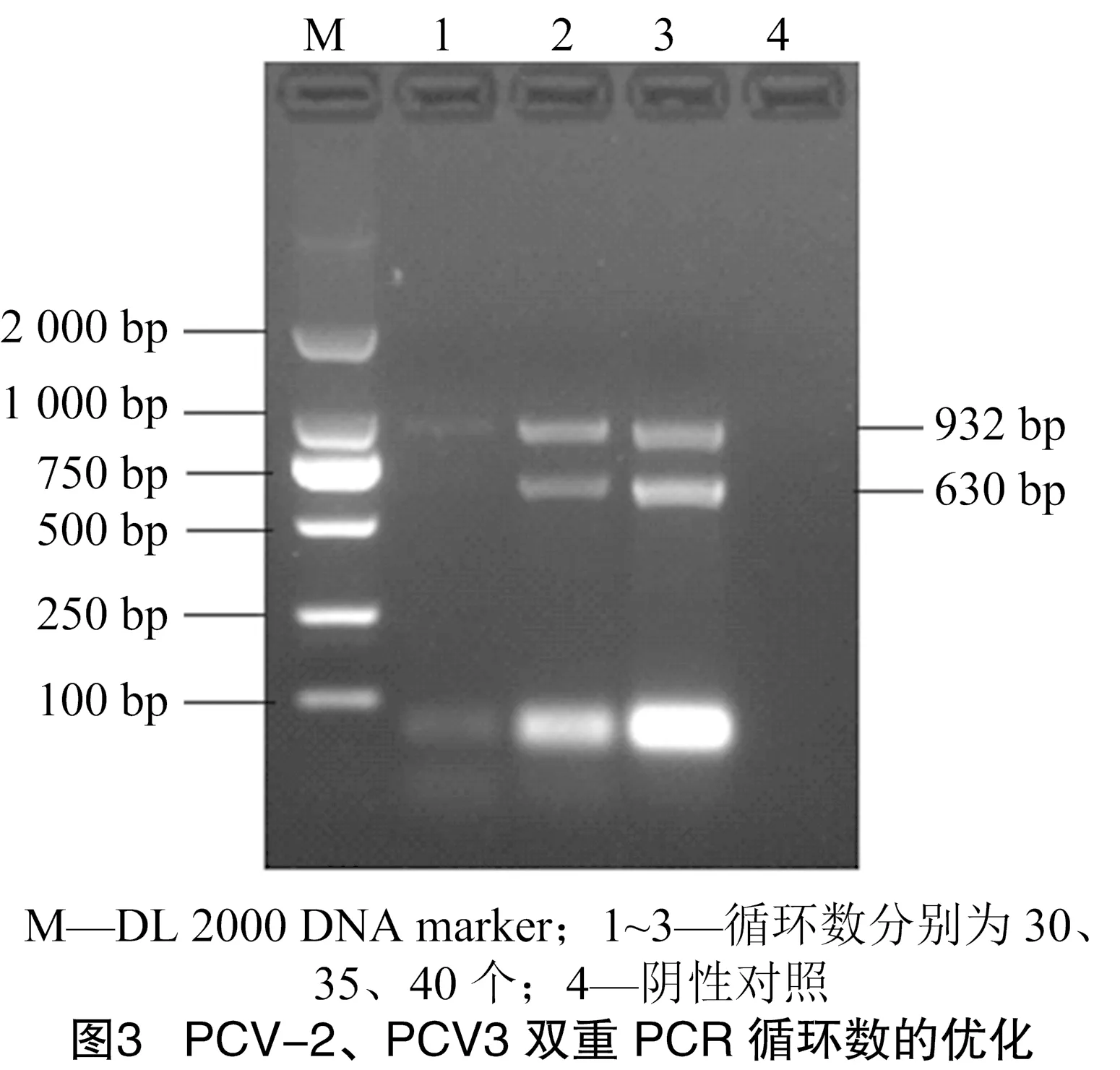
2.2.2 双重PCR循环数的优化 以54 ℃为双重PCR的退火温度,选取合适的模板浓度,设置3个不同循环(30、35、40)对双重PCR最适循环数进行验证,结果发现在循环数为40时条带亮度较为合适,因此选用40个循环为PCR的最适循环数(图3)。
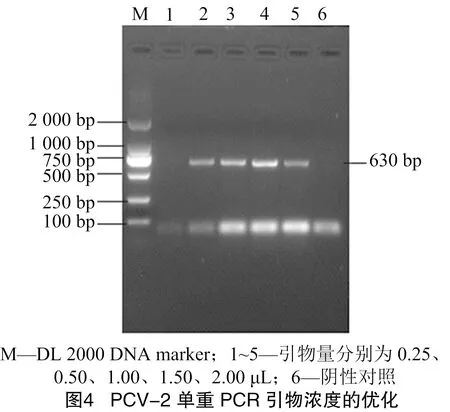
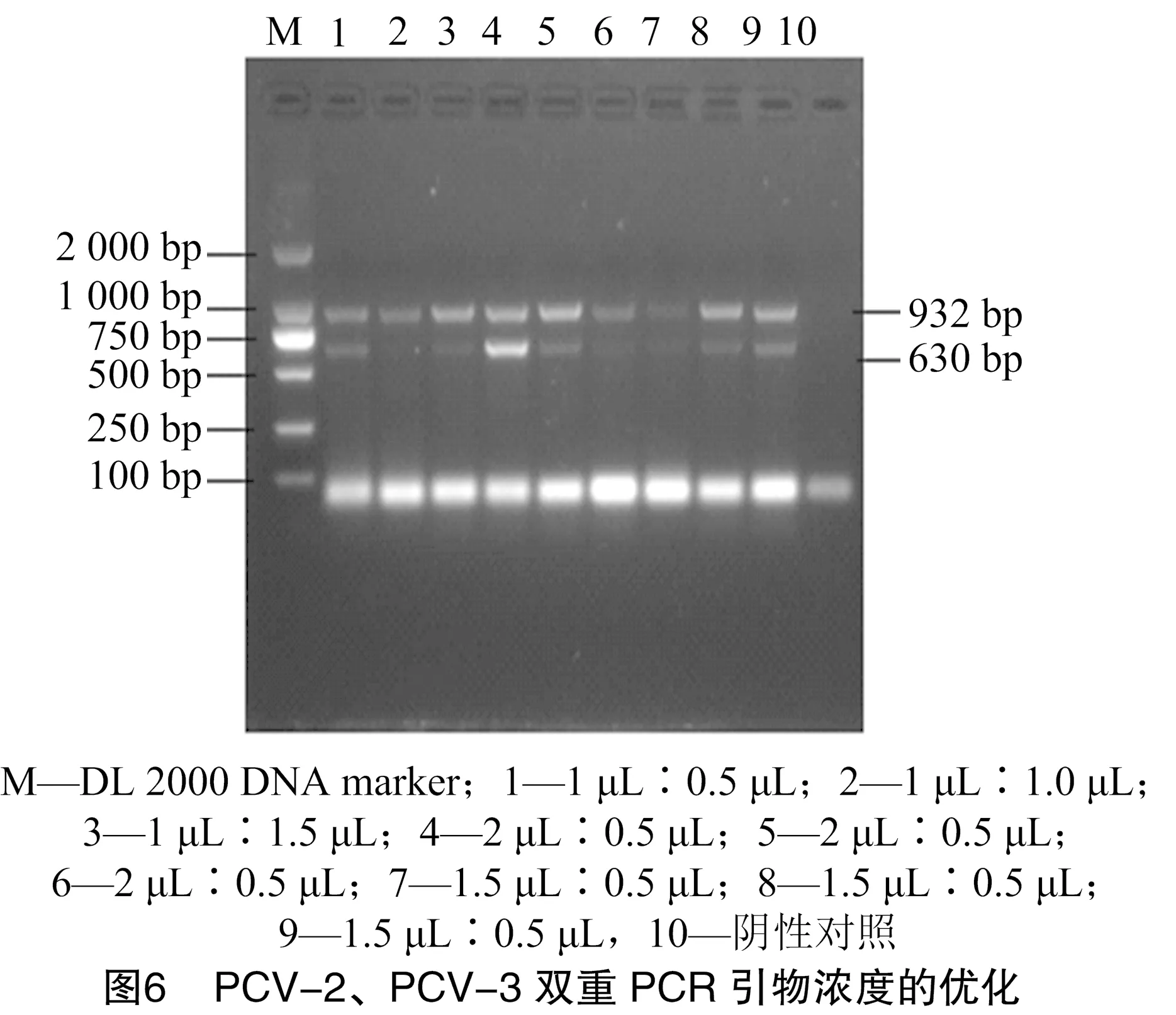
2.2.3 双重PCR引物浓度的优化 设置0.25、0.50、1.00、1.50、2.00 μL等5个引物量(上下游引物浓度均为1×10pmol/μL)对PCV-2/3单重PCR的最适引物量进行摸索。结果发现,PCV-2和 PCV-3 均在引物量为0.5、1.0、1.5 μL时条带已足够亮(图4、图5)。以0.5、1.0、1.5 μL为双重PCR的引物量,以棋盘滴定法找到双重PCR中 PCV-2 与PCV-3初始最适引物体积比例为2.0、0.5 μL(图6)。并按照该引物体积比例设置3组引物量(1.2 μL ∶0.3 μL;1.6 μL ∶0.4 μL;2.0 μL ∶0.5 μL)确定双重PCR中PCV-2与PCV-3的最终最适引物体积比例为1.6 μL ∶0.4 μL(图7)。


2.3 双重PCR敏感性试验结果
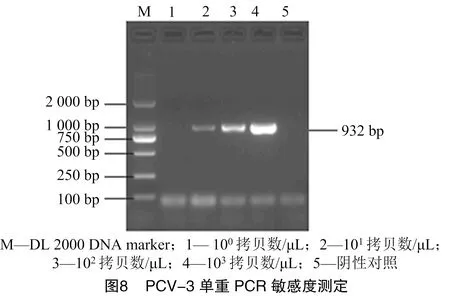
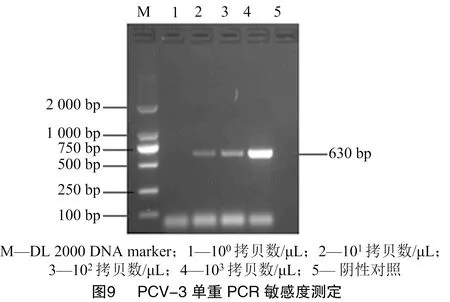
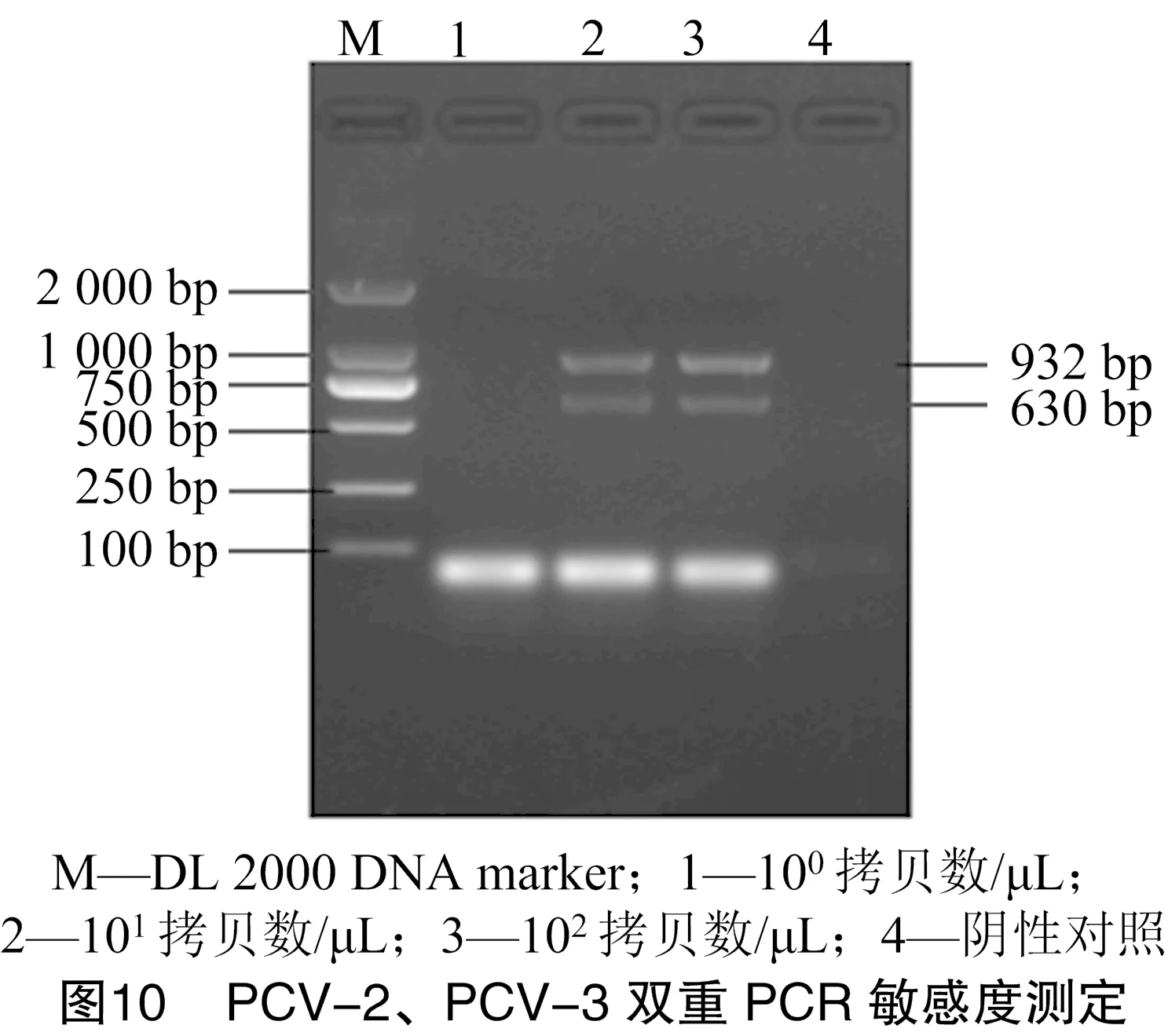
将70.7 ng/μL PCV-2、62.5 ng/μL PCV-3的阳性质粒均稀释成10拷贝数/μL,按比例混合稀释为10拷贝数/μL,之后进行倍比稀释来进行PCR的敏感性试验。经敏感度测定发现,优化后的双重PCR敏感度和其单一PCR的敏感度相同,均为10拷贝数/μL,说明建立的双重PCR检测方法具有很高的敏感度(图8、图9、图10)。
2.4 双重PCR特异性试验
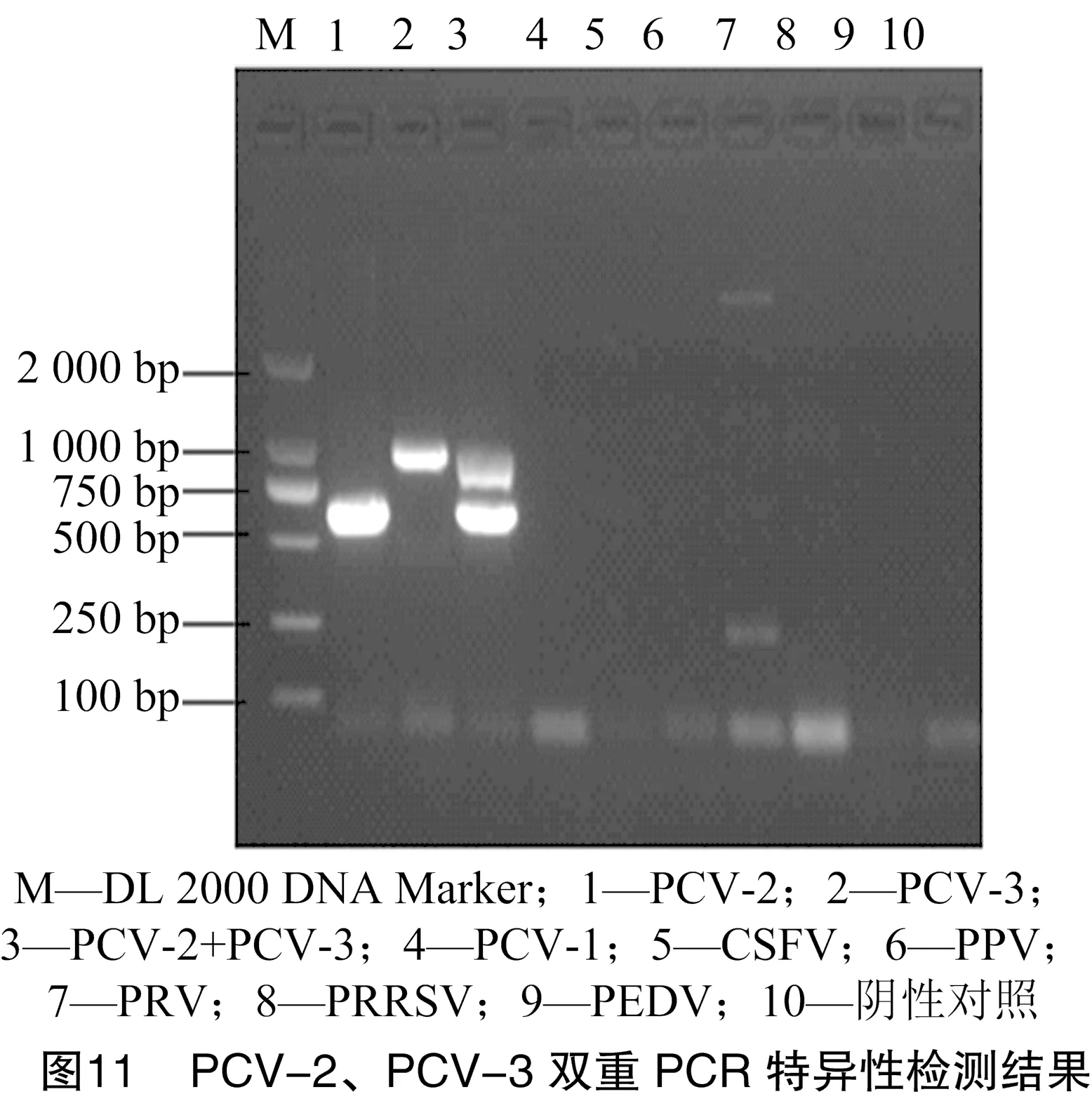
以优化后的双重PCR对PCV-2、PCV-3、PCV-2+ PCV-3以及PCV-1、CSFV、PPV、PRV、PRRSV、PEDV进行检测。结果显示,本试验建立的方法对PCV-2、PCV-3、PCV-2+PCV-3均能扩增出目的条带,对其余病原均无特异性目的条带,虽PRV出现较弱非特异性条带,但与目的条带距离较大,并不影响对PCV-2与PCV-3的判定结果。表明建立的双重PCR的方法具有较好的特异性(图11)。
2.5 双重PCR重复性试验
在摸索双重PCR最适条件时,3组重复均大致相同,且利用建立的双重PCR方法分别对PCV-2阳性样品DNA、PCV-2阴性样品DNA、PCV-3阳性样品DNA、PCV-3阴性样品DNA以及其他病原进行检测,3次重复结果一致,说明建立的PCV-2、PCV3双重PCR方法具有很好的重复性。
2.6 临床检测与统计分析
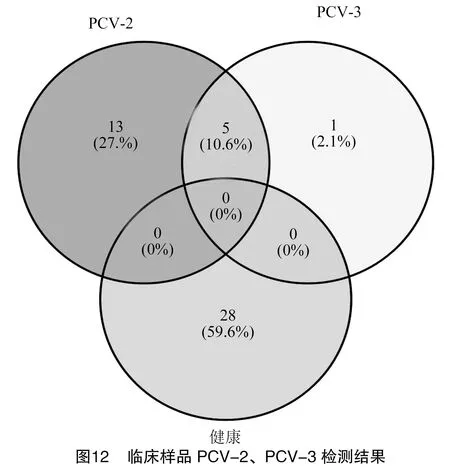
以单重PCR和建立的双重PCR分别对采集的47份临床样品进行PCR扩增,发现双重PCR与单重PCR结果一致。利用RStudio对结果进行分析并做可视化处理,PCV-2、PCV-3的阳性率分别为38.30%(18/47)、12.77%(6/47),混合感染率为10.64%(5/47),单患PCV-2率为27.7%(13/47),单患PCV-3率为2.1%(1/47),PCV-2和PCV3双阴性率为59.6%(28/47)(图12)。
3 讨论与结论
自PCV-2和PCV-3报道以来,国内外均有猪群感染的情况,且感染率居高不下,存在混合感染现象。PCV-2和PCV-3在临床上均表现为繁殖障碍、猪呼吸道疾病综合征(PRDC)、猪皮炎肾病综合征(PNDS)、能够引起猪断奶后多系统衰竭综合征(PMWS)、仔猪先天性震颤、增生性坏死性肺炎(PNP)等,在临床上无法明确区分PCV-2和PCV-3。另有报道在无临床症状的猪和犬中检测到PCV-3,且PCV-3能跨种间传播,在牛、蜱、鼠中亦能检测到,但PCV-2和PCV-3无交叉免疫保护,PCV-2的疫苗无法防止PCV-3的感染,猪圆环病毒不仅给世界养猪业带来严重损失,也可为其他动物的健康带来严重威胁,增加防控难度。因此,建立敏感性高、特异性强、重复性好的诊断方法对PCV-2和PCV-3临床检测与防控具有重要意义。
PCR为实验室检测的常用技术,肖琦等分别建立了PCV-2和PCV-3 PCR检测技术,但单重PCR技术1次只能检测1种病原。多重PCR方法于1988年提出,该方法在疾病混合感染方面具有快速、省时、省力的优势,既具有单项PCR的敏感性和特异性,又可节省试剂,1次检测多个病原体或多个基因型,具有很高的实用性。季程远等建立的双重PCR方法中PCV-2和PCV-3检测敏感度分别为1×10、1×10拷贝数/μL,6.1×10、8.0×10拷贝数/μL。本研究通过对PCR不同条件的优化和反复试验,最终建立了简单快速、灵敏稳定、准确可靠的PCV-2和PCV-3双重PCR方法,其灵敏度和单重PCR相同均为1×10拷贝数/μL,且高于已报道的PCV-2、PCV-3双重方法的敏感度。
目前,我国PCV-2和PCV-3在很多省份均有报道。PCV-2感染率为23.53%~81.40%(青海省为23.53%、云南省为36.05%、江苏省为38.00%、吉林省为38.50%、京津冀为56.70%、广西壮族自治区为65.10%、新疆维吾尔自治区为70.71%、四川省为74.48%、河南省为81.40%);PCV-3感染率为11.10%~38.3%(广西壮族自治区为11.10%、四川省为11.19%、江苏省为12.67%、云南省为17.44%、青海省为18.38%、新疆维吾尔自治区为20.00%,河南省为30.23%,京津冀为38.30%),混合感染率为 6.64%~30.23%(广西壮族自治区为7.90%,京津冀为17.50%,青海省为7.35%,河南省为30.23%,四川省为6.64%,云南省为15.12%)。本研究建立的双重PCR方法对临床健康的藏猪粪便进行猪圆环病毒检测,结果PCV-2感染率为38.3%(18/47),PCV-3感染率为12.8%(6/47),混合感染率为10.6%(5/47)。从目前我国PCV-2和PCV-3的感染类型来看,PCV-2、PCV-3 阳性率大致为53%、20%,混合感染率为14.12%左右,可见PCV-2、PCV-3在我国已普遍流行,且PCV-3多与PCV-2以混合感染的形式存在。从PCV-2和PCV-3感染地区来看,中国北部地区PCV-2和PCV-3阳性率较高,这可能与南北方气候差异有关。本试验以西藏林芝周边临床健康猪为检测对象,对其粪便进行检测。整体来看,西藏林芝地区PCV-2和PCV-3感染率相对较低,这可能与藏猪的散养模式、耐受能力和高原气候有关,且PCV-3多与PCV-2混合感染,但也存在PCV-3单独感染的现象,存在隐性感染的可能,因此西藏养殖户应加强对猪圆环病毒的防控意识。

