基于临床—影像组学特征经皮肾镜取石术后全身炎症反应综合征预测模型的建立
王飞,曹海明,董壮,吴宇,谷明利
蚌埠医学院第二附属医院泌尿外科,安徽蚌埠233000
肾结石在成人中很常见,且多为复杂性结石[1],通常需要住院治疗。随着计算机领域的兴起,微创外科手术应运而生,并在治疗泌尿系结石疾患中扮演着重要角色。目前,治疗上尿路结石的主要方法包括:经皮肾镜取石术(PCNL)、输尿管镜碎石术(URSL)和体外冲击波碎石(ESWL)。其中,PCNL具有创伤小、清石效率高等优点,是结石直径较大、多发结石的一线治疗方式[2-3]。然而,PCNL后存在一些并发症,如出血、感染、周围脏器损伤等。感染是较为常见的并发症,根据严重程度可分为发热、全身炎症反应综合征(SIRS)和尿源性脓毒症[4]。其中,尿源性脓毒血症是PCNL后最严重的并发症,可造成多器官衰竭甚至危及生命[5]。据报道[6],SIRS的发生会大大增加尿源性脓毒血症的发生风险,曾被认为是尿源性脓毒血症的第一步。因此,探讨术后SIRS发生的危险因素显得尤为重要。近年来,针对这一问题已有一些临床预测模型的诞生,但目前大多数研究仅分析了患者的临床资料。随着医学影像技术和人工智能的不断发展,相关研究人员从图像中提取高通量定量特征,从而使图像转化为可供分析的数据,这导致了影像组学的诞生。最新研究表明,基于影像组学或机器学习的预测模型能够更好地预测外科手术的疗效[7-8]。因此,本研究旨在开发一种新的临床—影像组学预测模型,用于评估和预测PCNL术后SIRS的发生风险。
1 资料与方法
1.1 临床资料 收集2017年—2019年在我院行PCNL治疗的208例患者。纳入标准:①经PCNL治疗成功的上尿路结石患者;②单操作通道(F18~22)且一期PCNL者。排除标准:①不符合入组标准或资料不全者;②各种原因引起的免疫力低下者;③合并其他手术者。208例中,男123例,女85例;年龄22~78(52.12±13.51)岁;手术时间70~170(102.86±26.55)min;术前尿酸137~575(298.29±95.89)μmol/L;Guy′s分级(GSS):Ⅰ级38例、Ⅱ级83例、Ⅲ级64例、Ⅳ级23例;术前发热(体温≥38 ℃)18例;术前血白细胞升高(≥10 000/mL)10例;术前中段尿培养阳性70例;术前合并高血压62例,糖尿病21例。根据患者术后是否出现SIRS分为SIRS组和对照组。满足以下2项或2项以上指标的患者,即可诊断为SIRS:①呼吸急促,呼吸频率>20次/分,或过度通气PaCO2<32 mmHg;②体温>38 ℃或<36 ℃;③心率>90次/分;④白细胞计数>12×109/L或<4×109/L或未成熟粒细胞>10%[9]。GSS根据患者CT结果将PCNL复杂性分为四个等级,Ⅰ级:单发结石位于肾脏中下极或肾盂,肾脏解剖学结构正常;Ⅱ级:单发结石位于肾上极或多发结石位于解剖学正常的肾脏;Ⅲ级:多发结石位于解剖学异常的肾脏或肾盏憩室,或部分鹿角形结石;Ⅳ级:完全性鹿角形结石和伴有脊柱畸形和脊髓损伤的结石[10]。
1.2 影像组学资料搜集 本研究涉及的影像组学特征均基于CT(64层MDCT扫描仪)图像资料分析,流程如下。①影像数据获取:收集患者术前CT资料,以Dicom文件格式导入3D Slicer(version 4.11.0)图像分析软件,构建Radiomics数据库。②图像分割:勾画感兴趣区域(ROI),所有影像组学特征均基于此提取。为了提高准确性,由2名泌尿科医师与1名影像专业医师共同完成,并确定整个结石被包含在ROI中。③特征提取:利用计算机程序设计语言工具Python(version 3.8),使用PyRadiomics语言分析包进行特征值提取计算,共提取出105个影像组学特征,包括一阶统计量、基于形状和大小的特征、纹理特征和小波特征。④数据挖掘分析:对提取的影像组学特征进行数据标化,通过lasso回归降维以便选取稳健和非冗余的特征,再由所选特征的线性组合按其各自的系数进行加权,并为每个患者计算相应的影像组学评分。
1.3 手术方法 麻醉成功后,患者取截石位,常规消毒、铺巾。经尿道外口插入F9.8wolf输尿管硬镜至膀胱,寻找输尿管开口并置入斑马导丝,在导丝引导下插入输尿管导管,在导管外端连接输液器后将患者改为俯卧位。遂将患者腰部垫高后消毒、铺巾。人工肾积水建立后,根据结石位置及肾积水情况选择合适穿刺点。在超声辅助下穿刺并置入金属导丝,在导丝引导下筋膜扩张器可视逐层扩张至肾盏内,保留F18~22外鞘,置入钬激光后,精准定位结石位置进行碎石并将细碎石渣冲出。探查视野内有无结石残留及出血,留置双J管后撤镜。放置肾造瘘管一根外接引流袋,伤口清洁包扎固定。
1.4 临床—影像组学列线图模型构建及验证 对比两组患者临床资料:包括年龄,性别,术前是否发热,术前是否合并高血压病、糖尿病,术前尿酸、血白细胞水平,术前中段尿培养阳性及阴性例数,Guy′s分级,手术时间。同时对105个影像组学特征先进行lasso回归降维,采用最小标准和10倍交叉验证法,通过引入惩罚调整参数(λ)对模型系数进行压缩,使无关系数趋向于零,从而实现变量的自动筛选,再与有差异的临床指标共同纳入多因素分析,将独立危险因素(P<0.05)选入预测模型中。为了在临床使用模型时更加简单、方便,应用R软件进一步将影像组学的非零系数进行提取并赋予评分,正值代表与SIRS发生风险具有正相关性,负值代表负相关,最终以影像组学评分的方式展示在模型中。模型以列线图方式进行可视化呈现,根据患者资料及检查结果可以在评分标尺上量出每项危险因素的得分,然后进行相加计算出总分,再根据总分找到所对应的风险指数最终得出患者术后SIRS的发生概率。模型区分度通过计算ROC曲线下面积(AUC)评估,准确性采用GiViTI校准曲线带考察,临床决策曲线(DCA)评估临床收益情况。

2 结果
2.1 两组临床资料比较 见表1。

表1 两组临床资料比较
2.2 两组影像组学评分比较 见图1。

图1 lasso回归筛选影像组学特征及交叉验证结果
2.3 PCNL术后发生SIRS的临床—影像组学预测模型 为了避免模型出现共线性问题,将单因素有差异的临床指标与影像组学评分共同纳入多因素分析,以P<0.05为筛选条件,共选出了GSS、性别、术前发热、术前中段尿培养、手术时间和影像组学评分6个变量,如表2所示。将其视为独立危险因素,并选入列线图模型,模型的可视化以列线图方式呈现(图2)。区分度评价如图3所示:AUC为0.915(95%CI:0.869~0.961)。校准度评价如图4所示:GiViTI校准曲线带的80%及95%CI区域均未穿过45°对角线,P=0.397,表明模型的预测概率与实际观测概率无明显差异。临床效能评价如DCA(图5)所示:蓝色线代表所有患者均接受治疗的净获益,黑色线代表所有患者均不接受治疗即净获益为0,红色线代表模型的净获益。红色线表明阈值概率在10%~90%的区间时,使用预测模型预测SIRS发生风险并根据结果决定是否治疗,比所有患者都接受治疗或不治疗有着较高的净获益。
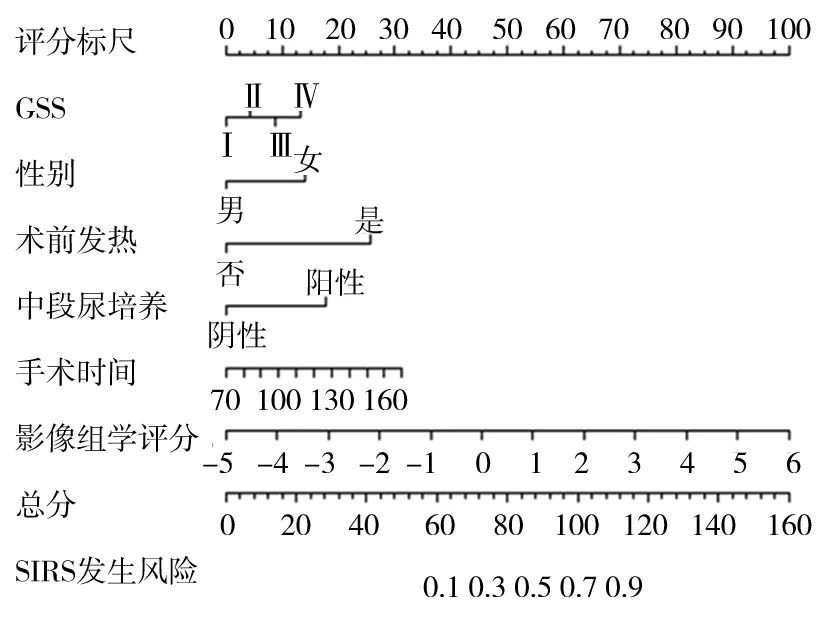
图2 临床—影像组学预测模型列线图
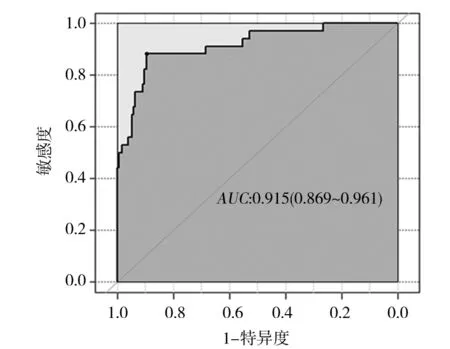
图3 预测模型ROC曲线

图4 预测模型GiViTI校准曲线带
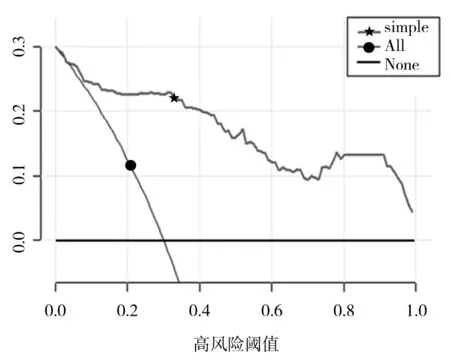
图5 临床决策曲线
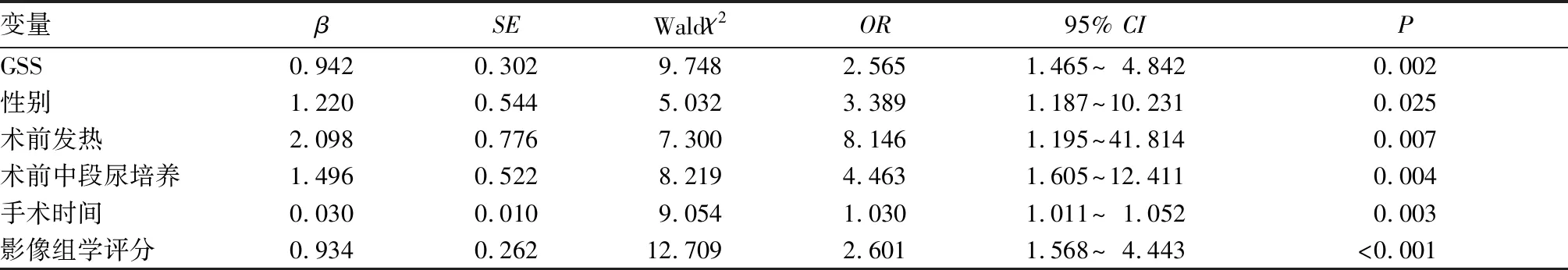
表2 208例PCNL患者术后发生SIRS的多因素Logistic回归分析结果
3 讨论
肾结石是泌尿外科的常见病、多发病,常表现为剧烈腰痛、恶心、呕吐、神志淡漠等[11],给患者带来了沉重的负担。在过去的几十年里,治疗肾结石的手术方法有了很大的进展。对于处理肾积水较重或需要开放手术干预的肾结石,PCNL仍被认为是首选治疗方式[2]。但这种一线治疗方式会引起许多并发症,其中以SIRS最为常见[4]。本研究中,SIRS的发生率约为16%,与之前的研究[12]基本一致。SIRS的发生会延长住院时间、增加住院费用,甚至会加大尿源性脓毒血症和感染性休克的发生风险[6]。
螺旋CT通常作为泌尿系结石的重要影像学检查方式,但它仅能够从结石部位、数量、大小等宏观层面上去评估,尚不能完成如结石成分等微观层面的分析。双能CT虽然在一定程度上能够实现体内预测结石成分,但仅能够区分出尿酸结石和非尿酸结石,未能对草酸钙结石、胱氨酸结石或感染性结石等非尿酸结石作出进一步鉴别。众所周知,不同的结石成分会影响患者治疗方式的选择及预后情况。而影像组学的诞生,使得解决这一难题成为可能。通过影像组学分析可以获取更详细的泌尿系结石信息,以便为患者提供个体化治疗方案。因此,为了更加准确地预测PCNL术后SIRS的发生风险,本研究开发了一种临床—影像组学预测模型。该模型是临床因素和影像组学特征的结合,通过验证结果证明了这种较为新型的预测模型有着优越的预测能力。
根据多因素分析结果显示,GSS在两组患者中存在显著差异。且从表1中可以清晰地看出,SIRS组GSS为Ⅲ级(47.1%)、Ⅳ级(29.4%)的构成比远高于对照组。研究结果表明,GSS级别越高术后越容易发生SIRS。GSS常被用来评估肾脏解剖结构、结石负荷、结石位置等因素对PCNL术后结局所造成的影响,这也间接反映了结石本身的复杂程度。一方面,结石直径越大且数量越多,往往复杂程度越高,复杂性结石通常会导致手术时间的延长。另一方面,较大的结石可能还会引起肾脏和肾盂黏膜损害,进而导致血管破裂和灌注液吸收增加[13],增加术后感染的风险。安宇等[14]的研究亦得到类似结论,复杂性结石术后往往更容易出现感染、结石残余等术后并发症。此外,结石位置的不同会导致术者选择不同的穿刺点,这会影响手术的安全性及疗效。目前这一问题尚存在一定争议,AMARESH等[15]做了一项前瞻性研究,通过对比上盏入路和下盏入路两组患者在清石率、手术时间、术中和术后并发症等方面的差异,得出上盏入路是一种安全有效的方法,可减少手术时间、术中出血,拥有更高的清石率。也有一些研究[16-17]认为后下盏入路相较于上盏入路安全,靠近输尿管上段在一定程度上能够降低肾盂内压力同时减少胸部并发症的发生。在临床实践中,术者可结合患者情况以及个人喜好,合理选择穿刺入路,尽可能地通过单通道取净不同肾盏中的结石。
另外,术前合并感染(术前发热、术前白细胞升高、术前中段尿培养阳性)是术后发生SIRS的关键因素[18-19]。对于尿培养阳性的患者,在手术过程中如果发生血管损伤和高肾内压,易使局部病原体和毒素侵入血液循环,从而发生败血症。尤其是那些感染性结石的患者,由于细菌生长过程缓慢并形成具有保护性的生物膜,即使使用了抗生素也难以彻底杀死它们[20],这些感染物质会在碎石过程中被吸收入血,诱发感染。最近一些研究[21-22]指出,女性患者更容易出现术后感染,这或许与女性尿道短、粗、直等特殊的解剖结构有关。以上几种因素在本研究中也再次得到了证实,并纳入预测模型列线图中。
近年来,人工智能结合影像学已广泛应用于泌尿系疾病的诊断、治疗、预测预后中,并在泌尿系结石领域取得了引人注目的进展。GROE HOKAMP等[23]收集了200例已使用红外光谱分析仪确定其成分的结石标本,通过双能CT结合机器学习算法构建的人工智能预测模型对这些结石进行重新分析,预测总体准确率为91.1%。据报道,放射组学区分感染性结石和非感染性结石的准确率为90.7%。上述已提及,感染性结石会大大增加术后感染并发症的发生风险[24]。此外,对于不同成分的结石需要消耗的碎石时间及结石粉碎程度亦不相同。碎石时间越长,在操作过程中重新定位的可能性越大,进而增加感染、出血等相关并发症的发生风险[25]。因此,如果能在术前预测结石成分,就可以优化泌尿系结石的治疗,这将会改善患者的预后。ZHENG等[26]通过多中心泌尿系结石放射组学研究,实现了放射组学在取石前识别结石成分,证明了放射组学可作为无创性工具,可以在术前进行结石成分分析。本研究的模型中同样结合了影像组学特征,且大大提高了预测模型的准确性(AUC=0.915),与先前的研究[27]相近。
影像组学预测模型是螺旋CT与人工智能相结合的产物,可实现活体软组织结石的术前预测,具有较高的敏感度、特异度和准确性。对人工智能模型的进一步研究及其在多中心前瞻性临床试验中的应用可以帮助外科医生制定适当的治疗和预防计划[28]。尽管影像组学在评估结石方面已经取得了一定的认可,但目前仍未普及。本研究除了追求模型的准确性外,也同样重视模型的普适性,故仍然保留了一些临床因素的分析。然而,本研究也存在一些不足之处,PCNL术后结局受术前、术中、术后等多方因素的影响。其中,术中因素如通道数量、孔径大小,术中出血量等;术后因素如结石残余情况都可作为危险因素进行探讨。因本研究病例数相对较小,为了尽量控制混杂变量,故重点讨论了术前因素。未来仍需扩大样本量,进行多中心、更加全面地研究。此外,在勾画ROI时,即使本研究安排2名泌尿科医师与1名影像专业医师共同完成,但仍不可避免地存在一定误差,这些或多或少会影响预测结果。
综上所述,本研究开发的临床—影像组学模型对于PCNL术后SIRS的发生具有较好的预测能力,一定程度上可以帮助外科医师评估手术风险,并根据预测结果决定是否进行药物干预,从而降低SIRS甚至尿源性脓毒血症等严重并发症的发生率。

