DNA去甲基化酶TET在神经母细胞瘤患者中表达及意义
杨 洋,杨风雨,张晓燕,黄玠烨,周 倜,齐炜炜,邹 焱,杨 霞,3
(1.中山大学中山医学院生物化学与分子生物学教研室,广东广州 510080;2.广州市妇女儿童医疗中心,广东广州 510623;3.广东省基因操作和生物大分子产物工程技术研究中心,广东广州 510080)
神经母细胞瘤(neuroblastoma,NB)是儿童最常见的颅外实体瘤,临床表现具有很高的异质性,从低风险NB的自发消退到侵袭性进展到高风险临床阶段。影响NB患者预后的主要因素包括患者的年龄、临床分期和原癌基因MYCN 的扩增状态。一般患者的年龄大于1 岁、确诊时的临床分期较高并伴有原癌基因MYCN 的大量扩增时,通常提示预后不良,高危NB 患者的5 年生存率不到50%[1-3]。DNA 甲基化和去甲基化主要由DNA 甲基转移酶(DNA methyltransferase,DNMT)和DNA 去甲基化酶十一易位(ten eleven translocation,TET)蛋白介导。在实体肿瘤中,已有研究报道DNA 去甲基化酶TET 家族成员TET1、TET2、TET3 在肝癌、胆管癌、结直肠癌、乳腺癌、神经胶质瘤等多种肿瘤中的表达及作用[4-8]。关于TET 家族在神经母细胞瘤患者组织中的表达及临床意义目前尚无报道。β-肾上腺素受体(β-adrenergic receptor,β-AR)属于G蛋白偶联受体的一种,β-AR 包括3 种亚型:β1-AR、β2-AR、β3-AR,β-AR 信号通路在肿瘤发生发展中起到一定作用[9-11]。我们实验室前期研究工作表明β2-AR 信号通路在NB 中处于过度激活的状态,靶向阻断β2-AR 能够抑制NB 细胞的增殖[12],提示β2-AR 可以作为肿瘤治疗的一个潜在干预靶点。本研究通过检测神经母细胞瘤患者组织中TET 的表达,探讨TET 家族与β2-AR 的关系,为揭示β2-AR在NB中过度激活的原因提供新的思考。
1 材料与方法
1.1 病例资料
研究所用到的所有临床肿瘤组织样本均来自于广州市妇女儿童医疗中心。神经母细胞瘤(NB)的标本例数为46例。样本采集日期范围为2003年1 月至2015 年9 月。所有患者均签署知情同意书,并经中山医学院附属广州市妇女儿童医学中心人类伦理委员会批准。这些临床肿瘤组织标本交由上海芯超生物科技有限公司制作成组织芯片(tissue microarray,TMA)用于后续的免疫组化检测。
1.2 标本检测
1.2.1 免疫组织化学法检测神经母细胞瘤组织中TET1、TET2、TET3 的表达兔抗人多克隆抗TET1、TET2、TET3 抗体购自Abcam 公司,免疫组化鼠兔通用型检测(二抗)ENVISION试剂盒购自基因科技上海有限公司。实验步骤严格按照烤片、二甲苯脱蜡、水化、PBST 洗、组织抗原修复、PBST 洗、内源性过氧化物酶的阻断、PBST 洗、封闭、孵育一抗、PBST 洗、孵育二抗、PBST 洗、DAB 显色、苏木素复染、脱水、二甲苯脱水透明、中性树胶封片的步骤进行。使用全自动数字玻片扫描系统(AxioScan.Z1)对组织芯片进行扫描。
1.2.2 免疫组化结果判断 TET 主要表达于细胞核,部分可见细胞浆同时着色。以细胞核的表达为阳性判断依据,所有免疫组化片于高倍镜下取5 个不同视野观察,通过平均染色指数(SI)评判表达结果。染色指数是染色强度和染色范围的乘积。高倍镜下观察玻片并进行染色强度评分,以着色呈黄色为阳性判断标准,无着色(阴性)为0 分,淡黄色(弱阳性)为1分,棕黄色(中等阳性)为2分,棕褐色(强阳性)为3 分;低倍镜下观察染色范围的百分比并进行评分:<5%为0 分,5%~25%为1 分,26%~50%为2 分,51%~75%为3 分,>75%为4 分。总评分为染色强度与染色范围评分二者的乘积,总分范围为0-12 分:0-7 分为低表达,8-12 分为高表达。
1.3 生物信息学分析
数据获取和分析:TCGA 数据库描绘了33 种癌症类型10 000余例患者的肿瘤分子特征,并定义了很多肿瘤分子亚型。本研究从TCGA 中的TARGET-NBL 数据矩阵(https://ocg.cancer.gov/programs/target/data-matrix)下载基因表达谱和临床数据。TARGET 数据库主要针对儿童肿瘤,通过测序和芯片技术,检测特定儿童癌症的基因组、转录组以及表观遗传,利用多组学的方法为每种癌症类型生成全面的分子改变图谱。研究共纳入153 名神经母细胞瘤患者,通过SangerBox 工具盒进行基因表达谱标准化(TPM 转换)以及基因名转换(ID 转换),将153 例神经母细胞瘤患者依据TET1、TET2、TET3 表达值的中位数划分为76 例TET 高表达和77 例TET 低表达的神经母细胞瘤患者。利用tidyr(R package)和dplyr(R package)运行for 循环以计算TET3与其他基因之间的相关性,提取与TET3显著相关(P<0.05)的基因绘制成表格。
1.4 统计学分析
应用SPSS 25.0 统计学软件进行分析。对所有连续性变量首先进行正态性检验,对于服从正态分布的变量采用均数±标准差(±s)进行描述,不服从正态分布的变量应用中位数和四分位间距M(P25~P75)进行描述,计数资料采用例进行描述;若TET 组化评分和β2-AR 组化评分总体服从正态分布,则采用Pearson 相关进行分析,否则采用Spearman 秩相关进行相关性分析。免疫组化高表达率在不同组别间的差异比较按以下情况采用相应的检验方法进行分析:当样本量(n≥40)且所有期望频数T ≥5 时四格表资料用Pearsonχ2检验;当n≥40 但有1≤T<5 时,四格表资料用连续性校正χ2检验;当n<40 或 有T<1 用Fisher’s 精 确检验。Kaplan-Meier 生存曲线及Log-rank 统计分析均使用GraphPad Prism 8 完成。所有分析均为双侧检验,P<0.05认为差异具有统计学意义。
2 结果
2.1 免疫组化结果
TET 表达与神经母细胞瘤患者临床病理结果显示,TET1 表达在NB 患者年龄(P=1.000)、性别(P=0.964)、肿瘤细胞分化程度(P=1.000)、有丝分裂-核碎裂指数(mitosis karyorrhexis index,MKI)(P=1.000)、INSS 分期(International Neuroblastoma Staging System,INSS)(P=0.190)、MYCN 状 态(P=0.145)中、患者总生存期之间(P=0.088;图1)的差异无统计学意义;TET2 表达在不同年龄(P=0.870)、性别(P=0.757)、肿瘤细胞分化程度(P=1.000)、MKI(P=1.000)、INSS 分 期(P=0.603)、MYCN 状态(P=0.370)、患者总生存期之间(P=0.476;图2)之间的差异无统计学意义;TET3 表达在不同等级MKI 的患者组织中的差异具有统计学意义(表1,P=0.037),在24 例低MKI 患者中,18 例患者高表达TET3,在14 例中/高MKI 患者中有5 例患者高表达TET3。肿瘤细胞分化程度高的9例NB患者均高表达TET3,分化程度差或未分化的32 例患者中TET3 高表达的患者有18 例,两组间比较差异有统计学意义(表1,P=0.041)。TET3 表达与NB患者总生存期(overall survival,OS)呈正相关(χ2=5.437,P=0.020;图3),但TET3 表达在NB 患者的年龄(P=0.543)、性 别(P=0.828)、INSS 分 期(P=1.000)、MYCN 状态(P=1.000)之间的差异无统计学意义。统计NB 患者组织中肾上腺素能受体2(β2-AR)免疫组化评分和TET1、TET2、TET3 免疫组化评分发现,TET1 表达与β2-AR 表达呈正相关(r=0.347,P=0.023),TET2和TET3表达与β2-AR 表达之间的差异无统计学意义(P=0.094,P=0.158;图4)。
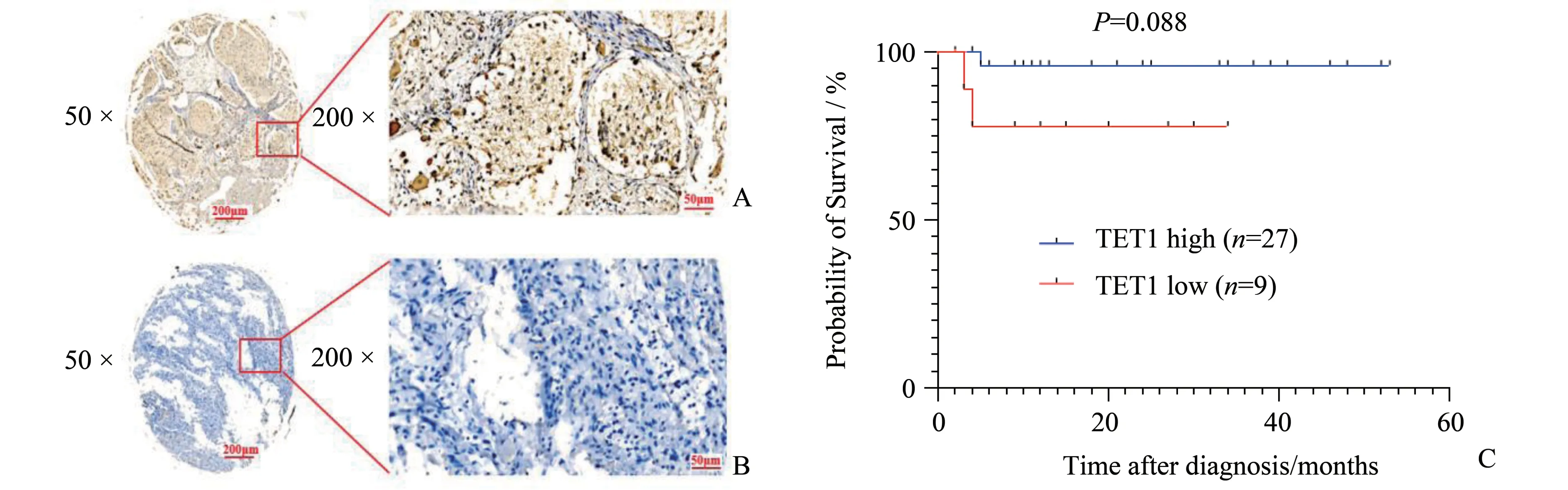
图1 免疫组化染色显示TET1在NB患者组织中表达差异及与NB患者预后的关系Fig.1 The different expression of TET1 detected by immunohistochemical staining in neuroblastoma tissues and the relationship with the prognosis of NB patients

图2 免疫组化染色显示TET2在NB患者组织中表达差异及与NB患者预后的关系Fig.2 The different expression of TET2 detected by immunohistochemical staining in neuroblastoma tissues and the relationship with the prognosis of NB patients

图3 免疫组化染色显示TET3在NB患者组织中表达差异及与NB患者预后的关系Fig.3 The different expression of TET3 detected by immunohistochemical staining in neuroblastoma tissues and the relationship with the prognosis of NB patients

图4 NB患者组织中TET1、TET2、TET3表达与β2-AR表达的相关性Fig.4 Correlation between the expression of TET1,TET2,TET3 and β2-AR in NB patients

表1 TET3表达与NB各临床病理参数的关系Table 1 Relationship between expression of TET3 and pathological parameters of NB
2.2 生物信息学分析结果
在TARGET 数据库中,不同TET1 mRNA 水平的NB患者总生存期和无事件生存期的差异无统计学意义(P=0.061,P=0.128);不同TET2 mRNA 水平的NB 患者的OS 和EFS 存在差异且具有统计学意义(χ2=11.160,P=0.001;χ2=7.925,P=0.005),TET2 mRNA 水平高的NB 患者的总生存期和无事件生存期更长;TET3 mRNA 高表达与神经母细胞瘤患者总生存期和无事件生存期呈正相关(χ2=5.096,P=0.024;χ2=6.026,P=0.014;图5);进一步的批量相关性分析统计出与TET3 mRNA 水平呈正相关和负相关的前十个基因(表2-3),其中与TET3 mRNA 水平呈正相关的前十个的基因是活动依赖性神经保护蛋白(activity-dependent neuroprotective protein,ADNP)、锌指蛋白736(zinc finger protein 736,ZNF736)、杆状病毒IAP 重复序列包含6(baculoviral IAP repeat-containing 6,BIRC6)、染色质重塑因子(AT-rich interactive domain 2,ARID2)、MAX 二聚化蛋白MGA(MGA)、poly(A)聚合酶(PAPOLG)、锌指蛋白91(zinc finger protein 91,ZNF91)、锌指和SCAN 域包含29(ZSCAN29)、锌指蛋白507(zinc finger protein 507,ZNF507),所有的P值均<0.05;与TET3 mRNA 水平呈负相关的前十个基因是液泡ATP 酶运输V0亚基E1(ATP6V0E1)、人内源性逆转录病毒-H 长末端重复序列相关蛋白3(human endogenous retrovirus-H long terminal repeat-associating protein 3,HHLA3)、宿主细胞因子C1 调节剂1(HCFC1R1)、线粒体接触位点和嵴组织系统亚基13(C19orf70)、富含半胱氨酸的跨膜模块包含1(CYSTM1)、线粒体编码的ATP 合酶膜亚基6(MTATP6)、线粒体编码的细胞色素C 氧化酶Ⅲ(MTCO3)、CD63(四跨膜蛋白家族的成员)、去泛素化酶(Josephin domain-containing protein 2,JOSD2)、硒蛋白M(SELM),所有的P值均<0.05。

表2 与TET3表达呈正相关的前十个基因Table 2 TOP 10 genes positively correlated with TET3 expression

图5 TARGET数据库中TET家族与NB患者总生存期及无事件生存期的关系Fig.5 Relationship between TET family and OS and EFS in NB patients in TARGET database
3 讨论
表观遗传机制严格控制基因表达、胚胎发生、遗传印记、染色体稳定性和肿瘤发生,其中包括DNA 去甲基化,由DNA 去甲基化酶十一易位蛋白TET 家族介导。TET 家族包括三个成员:TET1、TET2 和TET3,可以将5-甲基胞嘧啶(5-mC)转化为5-羟甲基胞嘧啶(5-hmC),进一步反复氧化5-hmC,形成5-甲酰胞嘧啶(5-fC)和5-羧基胞嘧啶(5-caC)。近年来已有大量研究致力于探讨TET家族与肿瘤的关系及TET 作为肿瘤生物标志物及治疗靶点的可能性。
3.1 TET1在神经母细胞瘤组织中的表达
有研究表明TET1能通过独立于其催化活性的方式调节突触细胞骨架调节蛋白(srGAP3)的表达,负调控小鼠神经母细胞瘤Neuro2a 细胞的神经元分化[13]。在我们的免疫组化结果中,不同TET1蛋白水平的神经母细胞瘤患者总生存期之间的差异无统计学意义(图1C,P=0.088),在TARGET 数据库中分析表明,高表达TET1 mRNA 和低表达TET1 mRNA 的神经母细胞瘤患者总生存期和无事件生存期之间的差异也无统计学意义(图5A、5B,P=0.061,P=0.128),我们的免疫组化结果与数据库结果一致。我们课题组前期研究表明在神经母细胞瘤中β-肾上腺素能受体2(β2-AR)高表达从而触发自噬促进神经母细胞瘤增殖[12]。有研究报道PM2.5 可引起心肌β2-AR 高甲基化,抑制β2-AR/PI3K/Akt 通路[14],表明β2-AR 可能受到表观遗传调控。我们的免疫组化结果表明,在NB 患者组织中,TET1 的表达与β2-AR 的表达呈正相关(图4A,r=0.347,P=0.023),提示TET1可能通过去甲基化调控β2-AR的表达。
3.2 TET2在神经母细胞瘤组织中的表达
目前尚未有TET2在神经母细胞瘤中的文献报道,TET2 基因突变多发生于造血系统恶性肿瘤中,很少发生在实体瘤中[15],但有研究表明TET2 功能的丧失促使黑色素瘤细胞能够逃避抗肿瘤免疫并抵抗抗PD-L1 治疗[16]。在乳腺癌中TET2 与FOXP1形成染色质复合物,介导负责乳腺管腔谱系发展的基因的去甲基化[17]。在我们的免疫组化结果中,TET2表达在NB 患者各个临床参数之间的差异并无统计学意义,不同TET2 蛋白水平的神经母细胞瘤患者总生存期之间的差异无统计学意义(图2C,P=0.476),而TARGET 数据库中的结果提示,TET2 mRNA 高表达与NB 患者OS 和EFS 呈正相关(图5C、5D,P=0.005,P=0.001)。免疫组化结果与数据库分析不一致的原因可能是免疫组化检测的是TET2 的蛋白表达水平而数据库中是mRNA 水平,也可能与研究规模有关,所以需要更大规模的研究进一步明确TET2与神经母细胞瘤的关系。
3.3 TET3在神经母细胞瘤组织中的表达
查阅资料发现,目前尚未有关于TET3 和神经母细胞瘤的文献报道,但是在急性髓系白血病(acute myelocytic leukemia,AML)中,有作者在公共数据库中发现TET3 表达与总生存期(OS)和无病生存期(DFS)呈正相关,进一步分析发现TET3表达与CDKN2B、ZIC2 等抑癌基因表达呈正相关,与PAX2、IL2RA 等癌基因表达呈负相关[18]。2020年的另外一篇文献指出,升高的TET3 mRNA 水平与胶质瘤样本更好的预后呈正相关[5],提示TET3可以作为肿瘤抑制因子发挥作用。我们的免疫组化结果也提示,TET3 高表达的NB 患者预后更好(图3C,P=0.020),TARGET 数据库也表明TET3 mRNA 水平与NB 患者的总生存期和无事件生存期呈正相关(图5E、5F,P=0.014,P=0.024)。此外,TET3 表达在不同MKI等级的患者之间的差异有统计学意义(表1,P=0.037),高MKI值是NB患者预后不良的指标,24 例低MKI 患者中有18 例患者高表达TET3,而在14 例中/高MKI 患者中仅有5 例患者高表达TET3,也提示TET3 高表达或许可以预测NB患者更好的预后。
肿瘤细胞的分化程度与肿瘤的恶性程度、肿瘤细胞对放疗或化疗的敏感性以及患者预后均有一定关系。我们的组化结果显示TET3表达水平在不同分化程度的各组间存在统计学差异(表1,P=0.041)。进一步的批量相关性分析表明TET3 mRNA 表达水平与ADNP(神经保护蛋白)、ARID2(染色质重塑因子)等抑癌基因的表达呈正相关(表2)。已有研究报道,ADNP 可以通过调节Wnt/βcatenin 信号促进神经分化[19]。诱导终末分化是神经母细胞瘤的一种治疗方法,以上结果提示TET3在NB 中或许可以通过调控ADNP 起到促进细胞分化从而改善患者预后的作用。另外,TET3 mRNA水平与CD63(四次跨膜蛋白)、JOSD2(去泛素化酶)等已经报道过发挥促癌功能的基因的表达呈负相关(表3),也提示TET3在神经母细胞瘤中可能作为肿瘤抑制因子发挥作用。
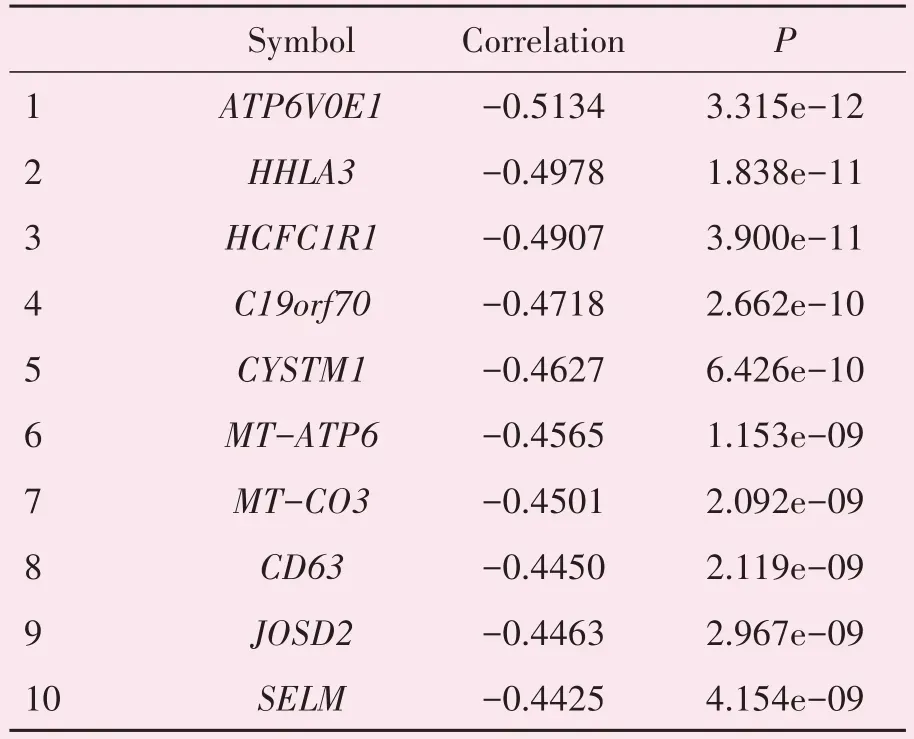
表3 与TET3表达呈负相关的前十个基因Table 3 TOP 10 genes negatively correlated with TET3 expression
迄今为止,已经有大量研究致力于确定神经母细胞瘤中受到表观基因组变化影响的生物标志物,然而,仍然没有通用有效的表观遗传生物标志物可以用于NB的诊断和预后[20]。本研究首次对神经母细胞瘤组织中DNA 去甲基化酶TET 家族的三个成员TET1、TET2、TET3 的表达进行了评估,并发现TET3 的表达水平与患者MKI以及肿瘤细胞分化程度相关,且与神经母细胞瘤患者的预后呈正相关,提示TET3 作为一个表观遗传分子或许可以成为NB 患者预后的生物标志物;而TET1在神经母细胞瘤中或许可能通过调控β2-AR 的表达从而促进肿瘤的进展,发挥促癌作用;我们的结果表明TET2在神经母细胞瘤组织中的表达似乎与肿瘤的发生发展没有关联。但本研究的组织标本例数偏小,因此本研究所得结论仍需要更多的临床组织标本进一步研究论证。

