错配修复蛋白表达缺失子宫内膜癌的临床病理特征分析
廖悦华,孙丽霞,赵 娜,杨文丽
(江门市中心医院病理科,广东 江门 529030)
子宫内膜癌(endometrial carcinoma,EC)是一种发生于女性生殖系统的常见恶性肿瘤[1]。据统计,EC 约占子宫恶性肿瘤的一半左右[2]。近年来,EC 的发病率逐年升高,且患者的发病年龄呈年轻化趋势,严重威胁女性的生命健康及生活质量。EC 的发生与家族史、子宫内膜疾病史、肥胖等有关[3]。近年来随着医学的不断发展,临床上对于EC 病因的探索日益深入,许多研究关注到错配修复(mismatch repair,MMR)缺陷与肿瘤发生的关系[4]。MMR 能够对DNA修复过程中的错误进行识别及修复,以保证染色体的稳定性。MMR 缺陷主要由MMR 基因突变引起,以致无法及时修正DNA 错误序列,继而导致基因组DNA微卫星区域发生错误复制,易引起EC、直肠癌、卵巢癌等恶性肿瘤[5]。对于存在MMR 缺陷的女性,其最为常见的肠外癌是EC。本研究旨在探讨MMR 蛋白表达缺失EC 的临床病理特征。
1 资料与方法
1.1 一般资料
选取2018 年1 月至2020 年6 月在我院治疗的105 例EC 患者为研究对象。纳入标准:1)所有受试者均进行手术,且经术后病理学检查明确诊断为EC ;2)临床病历资料完整者;3)进行免疫组化染色检查,且包括MMR 蛋白检测者;4)手术治疗前未接受放化疗或生物治疗者。排除标准:1)免疫组化染色检查不包括MMR 蛋白检测者;2)术前接受放化疗或生物治疗者。
1.2 方法
免疫组化染色检查应用Roche 公司生产的BenchMark-ULTRA VENTANA 检测平台,对MLH1、PMS2、MSH2、MSH6 进行检测。一抗采用安必平公司生产的MMR 抗体,包括鼠单克隆抗体MLHl(克隆号:LBP1-MLH1)、兔单克隆抗体MSH2(克隆 号:LBP2-MSH2)、 兔 单 克 隆 抗 体MSH6( 克隆号:LBP2-MSH6)、兔单克隆抗体PMS2(克隆号:LBP2-PMS2)。由两位具有丰富临床病理诊断经验的病理医生对所有病例的病理切片进行复核,复核内容包括病理组织学分型、肿瘤是否累及或发生于子宫体下段、肌层浸润深度、有无脉管浸润、有无淋巴结转移、肿瘤内部及周围淋巴细胞浸润情况及MMR免疫组化检查结果。MMR 免疫组化检查以扁桃体作为外对照,以待检组织内淋巴细胞、黏膜上皮、成纤维细胞为内对照,若MLH1、MSH2、MSH6、PMS2出现连续5 个以上细胞核呈棕褐色且比检测组织内淋巴细胞着色强,即为MMR 蛋白表达完整,判读为阳性;若全部肿瘤细胞核不着色或核着色细胞未连续出现5个、着色强度弱于组织内淋巴细胞、黏膜上皮、成纤维细胞,即为MMR 蛋白表达缺失,判读为阴性。
1.3 观察指标
根据纳入及排除标准收集整理受试者的全部临床病历资料,收集其年龄、体重、身高、病史、肿瘤个人史及家族史、肿瘤病理组织学分型、肿瘤累及或发生于子宫体下段情况、肌层浸润深度、有无脉管浸润、有无淋巴结转移、肿瘤内部及周围淋巴细胞浸润情况、免疫组化表达等资料,并根据MMR 蛋白的表达情况,结合临床资料分析MMR 蛋白表达缺失EC 患者的临床病理特征。
1.4 统计学处理
本研究整理的数据采用SPSS 22.0 软件进行分析,计量资料以均数± 标准差(±s)表示,采用t检验;计数资料以率(%)表示,采用卡方(χ²)检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 105 例EC 患者MMR 蛋白的表达情况
在105 例EC 患者中,MMR 蛋白表达完整的患者有78 例(占74.29%),MMR 蛋白表达缺失的患者有27 例(占25.71%)。在MMR 蛋白表达缺失的27例中,MLH1、MSH2、MSH6、PMS2 表达缺失的例数分别有15 例(占14.29%)、6 例(占5.71%)、10 例(占9.52%)、18 例(占17.14%);MLH1、PMS2 同时表达缺失的患者有14 例(占13.33%),MSH2、MSH6同时表达缺失的患者有6 例(占5.71%);MSH6 单独表达缺失的患者有3 例(占2.86%),PMS2 单独表达缺失的患者有3 例(占2.86%);MLH1、MSH6、PMS2 三者同时表达缺失的患者有1 例(占0.95%)。在MMR 蛋白表达缺失的患者中,以PMS2 表达缺失患者为最多。
2.2 MMR 蛋白表达缺失与EC 患者年龄的关系
本研究中患者的年龄介于31 ~79 岁之间,平均(56.78±6.14)岁。年龄≤50 岁的患者共有36例,其中MMR 蛋白表达缺失的患者有14 例(占38.89%);年龄>50 岁的患者共有69 例,其中MMR蛋白表达缺失的患者有13 例(占18.84%)。年龄>50岁患者的MMR 蛋白表达缺失率低于年龄≤50 岁患者(χ²=4.978,P=0.026)。详见表1。
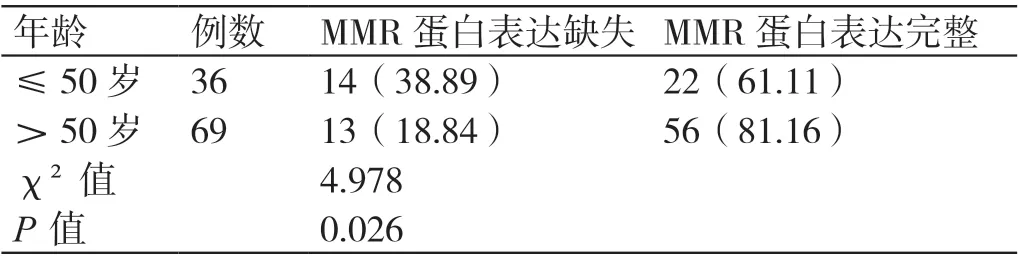
表1 不同年龄EC 患者MMR 蛋白表达缺失率的比较[例(%)]
2.3 MMR 蛋白表达缺失与EC 患者既往病史、BMI 的关系
本研究中患者的BMI 介于19.57 ~29.8 之间,平均(24.93±2.04)。其中合并糖尿病的患者有21 例,合并高血压的患者有34 例。BMI <25 患者的MMR蛋白表达缺失率高于BMI ≥25 患者(χ²=4.870,P=0.027);有无糖尿病史、有无高血压史患者的MMR 蛋白表达缺失率比较无统计学差异(P>0.05)。详见表2。
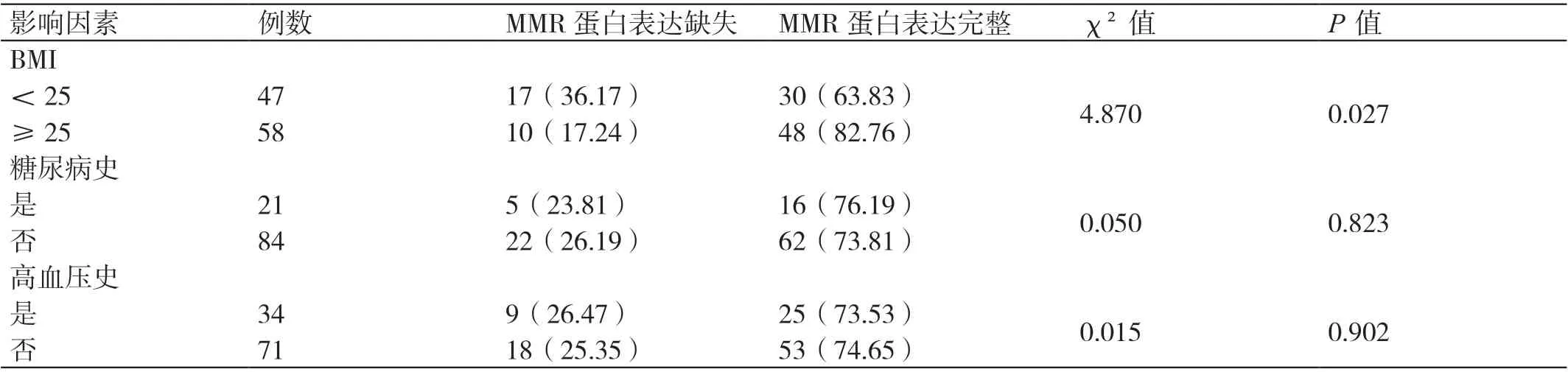
表2 不同BMI 及既往病史EC 患者MMR 蛋白表达缺失率的比较[例(%)]
2.4 MMR 蛋白表达缺失与EC 患者不同病理组织学分型、肿瘤累及或发生于子宫体下段情况、肌层浸润深度及淋巴细胞浸润情况的关系
105 例EC 患者中有97 例患者为子宫内膜样癌,8 例患者为其他类型的EC(其中3 例患者为浆液性癌,2 例患者为子宫内膜样癌伴去分化癌,1 例患者为子宫内膜样癌伴透明细胞癌,1 例患者为未分化癌,1 例患者为癌肉瘤)。不同病理组织学分型EC 患者的MMR 蛋白表达缺失率比较无统计学差异(P>0.05);肿瘤深肌层和浅肌层浸润EC 患者的MMR 蛋白表达缺失率比较无统计学差异(P>0.05);肿瘤累及或发生于子宫体下段患者的MMR 蛋白表达缺失率高于肿瘤未累及或发生于子宫体下段患者(P<0.05);肿瘤淋巴细胞浸润患者的MMR 蛋白表达缺失率高于无淋巴细胞浸润患者(P<0.05)。详见表3。

表3 不同病理组织学分型、肿瘤累及或发生于子宫体下段情况、肌层浸润深度及淋巴细胞浸润情况EC 患者MMR 蛋白表达缺失率的比较[例(%)]
2.5 MMR 蛋白表达缺失与EC 患者肿瘤家族史、肿瘤个人史的关系
有无肿瘤家族史、有无肿瘤个人史患者的MMR蛋白表达缺失率比较无统计学差异(P>0.05)。详见表4。
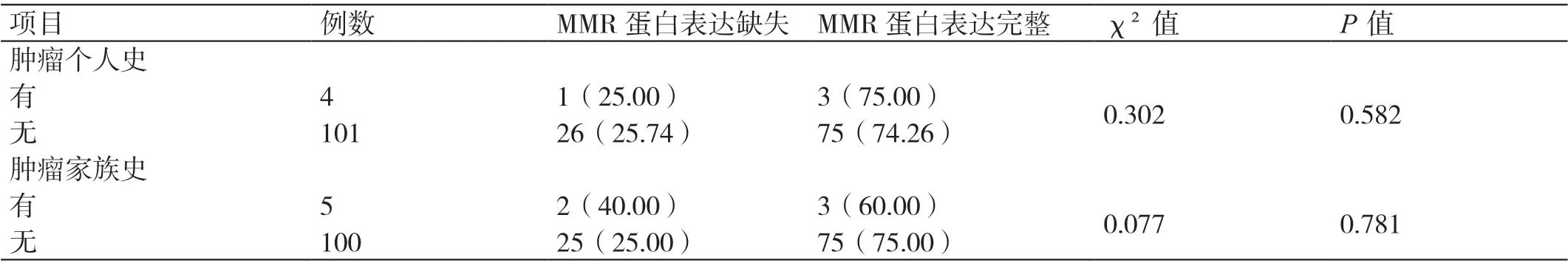
表4 不同肿瘤家族史、肿瘤个人史EC 患者MMR 蛋白表达缺失率的比较[ 例(%)]
3 讨论
肿瘤的临床治疗、病因探索等是现代医学亟待攻克的难题。肿瘤的发病机制复杂、病因繁琐。目前经过探索已经明确肿瘤的发生与抑癌基因失活、原癌基因激活、抑癌基因凋亡等因素有关[6]。近年来发现MMR 基因在肿瘤的发生发展中也起着一定作用。MMR 系统[7]是由一系列可特异性识别并能修复DNA 碱基错配的蛋白组成,在DNA 复制的过程中确保其复制的忠实性,对于维持遗传物质的完整性、稳定性有着十分重要的作用。近年来,受高脂高热饮食和低运动量生活方式的影响,EC 在我国的发病率呈上升趋势。EC 是第二常见的妇科恶性肿瘤[8],对女性的身心健康可造成严重的不良影响。目前临床上治疗EC 的方式包括放化疗、手术治疗等。进一步探索EC 的病因和发病机制,是探寻本病有效治疗措施的手段之一。研究指出,约5% 的EC 由遗传因素导致,而大多数遗传相关的EC 与林奇综合征(Lynch syndrome,LS)有关。LS 是一种常染色体显性遗传的家族性癌症综合征,由MMR 相关基因的胚系功能缺失、突变引起。LS 可通过基因或蛋白水平检测筛查,分子检测已有部分病理科开展,但相比较而言,MMR 蛋白的免疫组化检查更容易在日常工作中实施。MMR 蛋白表达的检测可作为LS 的临床筛查手段。既往的研究显示,已知的MMR 蛋白有MLH1、MSH2、MSH6、PMS2、PMS1、MSH3,在上述六种MMR 蛋白中MLH1、MSH2、MSH6、PMS2 发生胚系突变是MMR 缺陷的主要类型[9]。本研究中,对105 例EC患者以免疫组化方法检查MMR 蛋白表达的缺失情况,发现MMR 蛋白缺失表达率为25.71%,这与曾桢等[10]、晋薇等[11]的研究数据相差不大。本研究中在所有MMR 蛋白表达缺失的患者中,以PMS2 蛋白表达缺失患者为最多,其次为MLH1 蛋白表达缺失患者。但仅有小部分MLH1 表达缺失是由于胚系突变引起,大部分是由MLHl 启动子甲基化造成的。MLHl 的启动子甲基化可造成MLHl 表达缺失,因此,MLHl 表达缺失病例应首先检测启动子甲基化状态,只有MLHl非启动子甲基化病例才应进一步进行MLHl 基因突变检测。而筛查出MSH2、MSH6、PMS2 表达缺失的病例可直接进行基因突变检测。
本研究中,年龄>50 岁患者的MMR 蛋白表达缺失率低于年龄≤50 岁患者(χ²=4.978,P=0.026)。提示年轻EC 患者中更容易发现MMR 缺陷。由此说明,对于年轻的EC 患者需要格外注意筛查MMR 缺陷。然而,对于年龄较长的EC 患者,也需要根据实际情况注意对MMR 缺陷的检查,以免发生漏诊。本研究结果显示,BMI <25 患者的MMR 蛋白表达缺失率为36.17%,高于BMI ≥25 患者的17.24%(P<0.05)。究其原因可能是肥胖患者发生碱基MMR 的可能性较小。本研究结果显示,有无糖尿病史、有无高血压史患者的MMR 蛋白表达缺失率比较无统计学差异(P>0.05)。这可能与纳入的病例存在局限性、病例数量不足等因素有关,有待于今后的进一步研究来证实。本研究通过对不同病理组织学分型、肿瘤累及或发生于子宫体下段情况、肌层浸润情况、淋巴细胞浸润情况等进行分析,发现MMR 蛋白表达缺失的EC患者肿瘤更容易累及或发生于子宫体下段,且常伴有肿瘤内散在淋巴细胞浸润(>42 个/10HPF)及肿瘤周围带状片状淋巴细胞浸润(见图1-6)。统计分析显示,肿瘤累及或发生于子宫体下段患者的MMR 蛋白表达缺失率高于肿瘤未累及或发生于子宫体下段患者(P<0.05);肿瘤淋巴细胞浸润患者的MMR 蛋白表达缺失率高于无淋巴细胞浸润患者(P<0.05)。这与既往的研究结果[12]相似。MMR 蛋白表达缺失的恶性肿瘤患者,常表现为肿瘤周围出现以明显淋巴细胞为主的炎性细胞的浸润。但本研究未发现不同病理组织学分型及肌层浸润患者的MMR 蛋白表达缺失率存在统计学差异,这与既往报道的结果[13-15]有所不同。可能与本研究为回顾性分析,在病例选取上存在选择偏倚有关。本研究还对不同肿瘤家族史、肿瘤个人史对EC 患者MMR 蛋白表达缺失率的影响进行了分析,亦未见统计学差异(P>0.05)。究其原因可能是:1)病例数量较少;2)存在病例选择偏倚。
综上所述,对于EC 患者,可能需要密切关注相对年轻、不肥胖、肿瘤淋巴细胞浸润、肿瘤累及或发生于宫体下段的患者,加强筛查MMR 蛋白表达缺失的情况,必要时可根据MMR 蛋白的检测结果及临床情况进行MMR 基因检测。但本研究也存在一定的局限性,需要进一步通过扩大样本量、采用前瞻性研究等方式进行更为深入的探究。
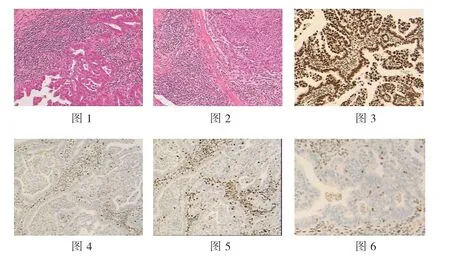
图1、图2 HE(20X)示肿瘤周边存在以带状及片状淋巴细胞为主的炎性细胞浸润,肿瘤内散在淋巴细胞浸润;图3 MLH1 免疫组化(20X)显示肿瘤细胞及肿瘤间淋巴细胞核弥漫;图4、图5 MHS2、MHS6(20X)免疫组化示肿瘤细胞核未见着色,肿瘤细胞间及肿瘤细胞内淋巴细胞核阳性;图6免疫组化示MHS2 肿瘤细胞内散在淋巴细胞阳性

