左氧氟沙星/壳聚糖/聚乙烯醇纳米纤维膜的制备与抑菌性能研究*
焦天宇,王宇宁,向巧灵,张 杰,张竞潇,张 威,张大伟
(东北林业大学 材料科学与工程学院,黑龙江 哈尔滨 150040)
引 言
随着社会不断进步以及日常生活节奏的不断加快,人们在学习、工作、饮食中产生了一些不良习惯,导致胃溃疡发病率大大提高。胃溃疡的治疗通常采用三联疗法,但由于致病菌的耐药问题而逐渐被新兴的四联疗法所取代[1],但四联疗法依然存在药物作用时间短、易被胃液稀释进而造成抑菌效果不佳等缺陷[2]。因此,如何实现药物的有效作用时间延长、对幽门螺旋杆菌的有效抑制成为治疗胃溃疡的关键问题[3]。
壳聚糖(CS)是甲壳素的脱乙酰化产物,具有良好的亲水性、生物相容性、生物可降解性,故被广泛应用于伤口敷料、生物医药、抑菌药物开发等领域[4~5]。但CS 的分子中存在大量OH- 与NH2-,分子内氢键作用大,造成其机械性能较差,故较少单独运用[6]。聚乙烯醇(PVA)是一种应用广泛的高分子聚合物,分子链中存在大量OH-,有着较强的亲水性、生物亲和性,被广泛应用于水溶性纤维、药物载体材料中[7]。相关学者发现PVA 长链分子中的OH-可以和CS 分子中的OH- 或NH2- 形成强的次价键作用,破坏CS 原有的结晶作用强的结构,进而提高其可纺性[8]。CS/PVA 纳米纤维膜的独特结构使得它可以作为药物递送系统,递送生物活性分子[9]。
左氧氟沙星(LEV)是第三代氟喹诺酮类抗生素,因在口服和静脉注射过程中组织渗透性强且对大多数肠杆菌科及部分链球菌具有高效的抗菌活性而被人们普遍使用,对于治疗由幽门螺旋杆菌引起的胃溃疡更是具有较好的疗效[10]。但在排除了耐药性影响之余,由于胃肠道独特的结构造成的药物作用时间短暂、药物有效浓度偏低等问题始终困扰着相关学者。近年来,基于高分子材料的特殊药物制剂引起学者的广泛关注。
静电纺丝技术是一种简单而通用的,可以利用从合成聚合物和天然大分子等多种材料制备纳米纤维的技术,利用静电纺丝技术可制备出孔结构高度互连、孔隙率高、功能可调、结构稳定性好的纳米纤维膜[11~12]。所制备的纳米纤维膜在超级电容器、污水处理、纺织工业、药物输送与制剂等方面有广泛应用[13~14]。
本实验采用静电纺丝技术制备出一种搭载LEV 的LEV/CS/PVA 纳米纤维膜。并利用SEM、FTIR、XRD、接触角测试、药物释放测试等方式对所制备的纳米纤维膜的结构与基本性能进行了表征。对大肠杆菌、金黄色葡萄球菌和幽门螺旋杆菌的抑菌活性进行了研究。采用3-(4,5- 二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)法测定纳米纤维膜的细胞毒性。
1 实验部分
1.1 材料与仪器
壳聚糖(CS)(脱乙酰度91%,黏度100mPa·s),浙江金壳生物制药股份有限公司;聚乙烯醇(PVA)(醇解度88%,聚合度1700),左氧氟沙星(LEV),二甲基亚砜(DMSO),上海阿拉丁生化科技股份有限公司;冰醋酸,天津致远试剂有限公司;蒸馏水,哈尔滨文景纯净水厂。大肠杆菌、金黄色葡萄球菌和幽门螺旋杆菌,广东省微生物菌种保存中心;营养琼脂,北京奥博星生物技术有限责任公司;改良Skirrow氏琼脂基础、P-76 抗生素溶液(每支含万古霉素1.0mg、三甲氧苄氨嘧啶乳酸盐0.5mg,多粘菌素B250 IU),中国检验检疫科学研究院北京陆桥技术有限责任公司;马血清(特级),北京元亨圣马生物技术研究所;微需氧产气袋、培养袋,三菱瓦斯化学株式会社;磷酸盐缓冲溶液(PBS)和MTT(YM-S1315),上海元牧生物科技有限公司;模拟胃液(SGF),飞净生物科技有限公司。
数显恒温磁力加热搅拌器(HJ-6A),金坛市百塔新宝仪器厂;高压电源(DW-P303-1ACDF0),东文高压电源厂;电子天平(CP512),奥豪斯仪器(上海)有限公司;扫描电子显微镜(JSM-7500F),日本电子株式会社;接触角测试仪(OCA 20),德国德菲仪器股份有限公司;紫外可见分光光度计(TU-1901),北京普析通用仪器有限责任公司。
1.2 纺丝液的配制
将PVA 加入蒸馏水中,在80℃搅拌,制备5%(wt)PVA 溶液。将CS 加入PVA 溶液中搅拌制备CS/PVA 悬浮液(CS 与PVA 的质量比固定在10∶90)。在悬浮液中加入与CS 质量相同的冰醋酸,使CS 溶解,形成CS/PVA 纺丝液。将LEV 加入到CS/PVA 溶液中搅拌60min,形成LEV/CS/PVA 纺丝液。最后,通过超声处理10min 使纺丝液均匀分散。
1.3 纳米纤维膜的制备
将配制好的纺丝液加入10mL 注射器中,注射器与内径为0.9mm 的金属平头针相连。施加电压为15kV,尖端到收集板的距离为15cm。针与水平线的夹角为15~20°。温度为25℃,相对湿度为45%,在重力作用下,在强电场中喷射CS/PVA、LEV/CS/PVA 纺丝液,在收集板上逐渐形成纳米纤维膜。静电纺丝过程持续36h。所制备的搭载LEV 的纳米纤维膜命名为LEVn/CS/PVA,其中n 代表LEV 的含量,例如,LEV2/CS/PVA 表示LEV∶CS∶PVA=2∶10∶90。
1.4 纳米纤维膜的结构和基本性能表征
采用SEM观察制备的纳米纤维膜的微观形貌。用图像分析软件(Digimizer)测量纳米纤维的平均直径和分布。
利用FT-IR 对制备的纳米纤维膜的化学结构进行表征。光谱范围为4000~400cm-1,分辨率为4cm-1。
采用XRD 对制备的纳米纤维膜的结晶度进行表征,扫描速度为5°·min-1,衍射角(2θ)范围为5~55°。
通过接触角测试仪对制备的纳米纤维膜的润湿性进行表征。将4.0μL 的水滴滴在纳米纤维膜表面,并通过视频记录水滴形状。每个纳米纤维膜测量3 次,并报告其平均值。
在37℃、SGF 中测定LEV8/CS/PVA 纳米纤维膜的体外释放特性。在规定的时间间隔提取2mL SGF,补充等量的新的SGF,并保证释放过程中SGF 的量不变。紫外分光光度计试验表明,LEV 在SGF 中的特征吸收峰在298nm,用λmax=298nm 的紫外分光光度计测定LEV 释放量。
1.5 细胞毒性试验
用NIH3T3 小鼠胚胎成纤维细胞检测制备的纳米纤维膜的细胞毒性,用MTT 比色法检测成纤维细胞活性。将纳米纤维膜切成4×4mm2的样品,经紫外线照射灭菌后放入24 孔无菌板中。将NIH3T3 小鼠胚胎成纤维细胞悬液(1×104个/孔)倒入培养孔中。将0.5gMTT加入到100mLPBS中配制MTT溶液,用0.22μm 膜过滤除去溶液中的细菌。37℃培育24、48、72h 后,取出孔板中的培养基;加入70μL MTT 溶液,黑暗培养4h,再加入600μL DMSO 溶解形成的深蓝色甲瓒晶体。最后用紫外分光光度计测定570nm 波长处的光密度。所有实验重复三次。
1.6 抑菌性能测试
用大肠杆菌和金黄色葡萄球菌评价制备的纳米纤维膜的抗菌活性。整个实验过程如下:将3.3g 营养琼脂溶解于100mL 蒸馏水中制备营养琼脂培养基。将营养琼脂培养基在121℃高压灭菌40min,之后置于培养皿内,在超净工作台中用微量加样器分别吸取150μL 大肠杆菌和金黄色葡萄球菌菌液置于每个固体培养基上,用接种环涂匀。用打孔器将纳米纤维膜切成直径为15mm 的圆形,用于抑菌试验。用于测试的样品在超净工作台中被紫外线照射灭菌15min,放置在培养基表面,37℃恒温箱培养48h。抗菌活性由抑菌区的大小表现。
用幽门螺旋杆菌评价制备的纳米纤维膜的抗菌活性。整个实验过程如下:将改良Skirrow氏琼脂基础4.25g,溶于100mL 蒸馏水中,之后在121℃高压灭菌15min。待温度降至50~60℃时,加入P-76 抗生素溶液(已预先紫外灭菌1h)一支和12mL 马血清,混合均匀,趁热置于培养皿中,等待数分钟,冷却凝固后备用。取液氮保存的幽门螺旋杆菌菌液,待平衡到室温后,在超净工作台中用微量加样器吸取150μL 菌液于固体培养基上,用接种环涂匀。将纳米纤维膜切成10mm×10mm 的矩形,用于抑菌试验。用于测试的样品在超净工作台中被紫外线照射灭菌15min,放置在培养基表面,放入微需氧袋(85%N2,10%CO2,5%O2)。用蒸馏水浸湿滤纸一片,以维持所需湿度。随即于10s 内将微需氧产气袋迅速放入到微需氧发生袋,避开滤纸侧,封紧微需氧袋口,37℃恒温箱培养48h。抗菌活性由抑菌区的大小表现。
2 结果与讨论
2.1 纳米纤维膜的微观形貌
图1 所示为制备的纳米纤维膜的微观形貌,图1(a)为CS/PVA 纳米纤维膜,从图中可以看出,纤维直径较为均匀,无明显串珠,利用Digimizer 测量其纤维直径,为125.3±78.3nm,由于纳米纤维结构的存在,大大提高了其比表面积,便于药物与生物流体间产生良好的接触而使得纳米纤维具有良好的药物释放效果。图1(b~e)分别为不同LEV 含量的纳米纤维膜的微观形貌,其平均纤维直径分别为138.0±90.4nm,148.8±89.3nm,145.5±91.2nm,147.9±108.0nm,结果表明随着LEV 含量的增加,平均纤维直径呈现先增加后平稳的趋势。纤维的直径与纺丝液的电导率和黏度有关,当纺丝液黏度过大时,聚合物溶液将受到较大的拉伸阻力,进而造成纤维直径增大[15]。造成纤维直径增大的原因可能是LEV 的加入使纺丝液黏度增加,或降低了纺丝液的电导率,进而造成纤维直径增加[16]。搭载LEV 的纤维中出现实心纺锤体,可能是因为部分药物分散不均,进而形成药物团聚体,并随射流被纺出。

图1 制备的纳米纤维膜的SEM 图像和直径分布图a:CS/PVA; b: LEV2/CS/PVA; c: LEV4/CS/PVA; d: LEV6/CS/PVA;e: LEV8/CS/PVAFig. 1 The SEM images and diameter distribution of the prepared nanofibrous membranes
2.2 FTIR 分析
可通过红外光谱进一步明确LEV 与CS/PVA纳米纤维膜之间的结构,图2 是CS、PVA、CS/PVA 纳米纤维膜、LEV8/CS/PVA 纳米纤维膜的红外谱图。在3350cm-1、3289cm-1处存在双峰,为CS 中以缔合作用形成氢键的OH- 的伸缩振动吸收峰与NH2-伸缩振动吸收峰相重叠而产生的[17]。2869cm-1处为CH2-伸缩振动吸收峰,1647cm-1、1589cm-1处分别为酰胺Ⅰ与酰胺Ⅱ的弯曲振动吸收峰,1375cm-1,1150cm-1,1060cm-1分别为C-N 键伸缩振动吸收峰,C-O 键伸缩振动吸收峰与壳聚糖吡喃环中C-O 键特征吸收峰,与报道相一致[18]。PVA 的红外谱图中,3317cm-1为OH- 伸缩振动吸收峰,2911cm-1处为CH2-伸缩振动吸收峰,1733cm-1处为未脱乙酰化的酰胺键中的C=O 双键伸缩振动吸收峰,1092cm-1处为C-O键伸缩振动吸收峰[19]。LEV 在1619cm-1、1539cm-1处存在特征吸收峰,为C=O 与N-H 的伸缩振动吸收峰[20],指纹区吸收峰较为复杂,该区间内的特征吸收峰可为是否搭载药物提供依据。

图2 CS、PVA、CS/PVA 纳米纤维膜、LEV、LEV8/CS/PVA 纳米纤维膜的红外光谱Fig. 2 The infrared spectra of CS, PVA, CS/PVA nanofibrous membrane and LEV, LEV8/CS/PVA nanofibrous membrane
当CS 与PVA 共混纺丝后,并未出现新的特征吸收峰,仅出现了部分峰增强与减弱。原因为CS 与PVA 掺杂后相互间起到一定的包埋,将相应的特征吸收峰减弱,而在1083cm-1处,出现了明显的峰强度增加的现象,其为吡喃环中C-O 键特征吸收峰,证明成功地将CS 纺到PVA中[21]。当加入LEV后,LEV8/CS/PVA 纳米纤维膜中出现了1620cm-1,1132cm-1,928cm-1,858cm-1,630cm-1处的特征吸收峰,这是CS、PVA 所不具有的,证明成功地将LEV 搭载到CS/PVA纳米纤维中。
2.3 XRD 分析
利用XRD 对CS、PVA、CS/PVA 纳米纤维膜、LEV 及LEV8/CS/PVA 纳米纤维膜进行分析,可以揭示LEV 在CS/PVA 纳米纤维膜中的物理状态和分布。CS 的XRD 图谱在2θ=19.82°出现峰值,且为弥散的宽吸收峰,证明CS 有着一定的半结晶性[18]。PVA在2θ=16.78°、22.5°出现两个弥散宽峰,证明PVA 结晶性不如CS,且将CS 作为少组分与PVA 共混纺丝后,XRD 图谱与PVA 相似,而CS 的衍射峰消失,证明PVA破坏了CS的结晶结构,使得其结晶度下降[21]。LEV 在2θ=6.64°、9.68°、13.08°、15.78°、19.40°、26.36°处有明显的窄而高的衍射峰,与文献报道一致,表明LEV 有纯晶体性质[22]。而在LEV8/CS/PVA 纳米纤维膜的XRD 图谱中,LEV 的衍射峰均消失,仅在2θ=19.76°时出现弥散宽峰,证明LEV 在纳米纤维膜中未以结晶态形式分布,即LEV 被CS/PVA 纳米纤维包埋。

图3 CS、PVA、CS/PVA 纳米纤维膜、LEV、LEV8/CS/PVA 纳米纤维膜的XRD 曲线Fig. 3 The XRD patterns of CS, PVA,CS/PVA nanofibrous membrane and LEV, LEV8/CS/PVA nanofibrous membrane
2.4 水接触角测试
生物材料的润湿性对于纳米纤维来说是一个非常重要的参数,具有良好亲水性的纳米纤维膜能够与生物流体接触,让药物从纳米纤维中释放。图4(a~e)显示了不同LEV 含量的纳米纤维膜亲水表面的润湿性,图4(f)显示了水接触角的变化趋势。所制备的纳米纤维膜的水接触角由49.2°变为30.2°。与CS/PVA 纳米纤维膜相比,载药纳米纤维膜显示出接触角值的减小,表明载药纳米纤维膜亲水性有所提高。这可能归因于加入LEV 后造成了纤维表面粗糙度与比表面积增加[23]。

图4 制备的纳米纤维膜的水接触角图及趋势图a:CS/PVA; b: LEV2/CS/PVA; c: LEV4/CS/PVA; d: LEV6/CS/PVA; e:LEV8/CS/PVAFig.4 The water contact angle and trend of the prepared nanofibrous membranes
2.5 药物的释放
图5所示为所制备的LEV8/CS/PVA 纳米纤维膜的LEV 释放曲线。数据表明,LEV8/CS/PVA 纳米纤维膜在模拟胃液环境下,在0~12h 内快速释放,LEV释放率达到约80%,在12~35h 内,释放曲线呈缓慢增长趋势,表现出缓释行为,最终药物释放率达到约96%。表明LEV8/CS/PVA 纳米纤维膜具有短时间提供较高药物浓度,长时间持续给药的潜力。制备纤维膜的材料均具有亲水性,当样品接触SGF 时,由于较高的pH 值,CS 无法溶解,而仅发生溶胀,在纳米纤维结构中,溶胀与药物扩散均需要时间,进而导致分散在纤维表面的LEV 能够迅速地扩散至SGF 中,而处在纤维中心的LEV 在溶胀与扩散的双重阻力下呈现出缓慢释放的效果[24]。
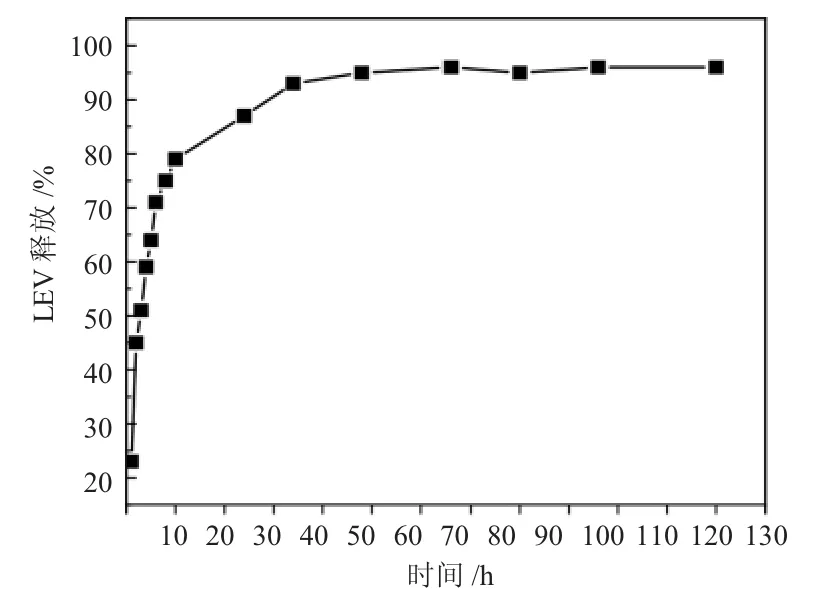
图5 LEV8/CS/PVA 纳米纤维膜在SGF 环境下的LEV 释放曲线Fig.5 The LEV release curve of LEV8/CS/PVA nanofibrous membrane in SGF
2.6 体外细胞毒性测试
用MTT 法评价了制备的纳米纤维膜的生物相容性。图6 展示了制备的纳米纤维膜和对照组对NIH3T3小鼠胚胎成纤维细胞增殖作用的比较。从图中可以看出不同LEV 含量的纳米纤维膜上的细胞的吸光度随着培养时间的增加而增大,说明细胞在不断地增殖。这是由于纳米纤维膜的多孔结构可以为细胞生长提供支架,促进细胞生长所需营养物质的循环,从而促进细胞的生长和增殖[25]。在培养72h 后,不同LEV含量的纳米纤维膜上细胞的吸光度和对照组无显著差异,表明制备的纳米纤维膜均未表现出明显的细胞毒性,具有良好的生物相容性。

图6 制备的纳米纤维膜对NIH3T3 小鼠胚胎成纤维细胞增殖作用的比较Fig.6 Comparison of the proliferation of NIH3T3 mouse embryonic fibroblast cells on the prepared nanofibrous membranes
2.7 抑菌性测试
LEV 是一种广谱抗菌药物,对革兰氏阳性和革兰氏阴性细菌有着较好的抑菌活性[25]。以大肠杆菌、金黄色葡萄球菌和幽门螺旋杆菌为研究对象,对制备的纳米纤维膜的抑菌活性进行了研究。图7(a~b)分别展示了不同LEV 含量的纳米纤维膜对大肠杆菌和金黄色葡萄球菌的抑菌区。从图中可以看出,未搭载LEV 的CS/PVA 纳米纤维膜对大肠杆菌和金黄色葡萄球菌具有一定程度的抑制作用,这是由于CS 本身具有抗菌活性[26]。然而,与CS/PVA 纳米纤维膜相比,可以很明显地看出搭载了LEV 的LEV2/CS/PVA、LEV4/CS/PVA、LEV6/CS/PVA 和LEV8/CS/PVA纳米纤维膜对大肠杆菌和金黄色葡萄球菌具有很强的抑制作用,抑菌圈明显增大。分析原因为LEV 从纳米纤维中释放出来并慢慢地向四周扩散,最终导致抑菌圈的扩大[25]。图7(c)展示了不同LEV 含量的纳米纤维膜的抑菌圈的直径变化趋势。搭载了LEV的纳米纤维膜的抑菌圈直径比CS/PVA 纳米纤维膜大很多,但是并没有出现随着LEV 含量的增加而持续增大的趋势,这可能是由于药物扩散距离的限制。图7(d)展示了不同LEV 含量的纳米纤维膜对幽门螺旋杆菌的抑菌效果。从图中可以明显地看出,未搭载LEV 的CS/PVA 纳米纤维膜对幽门螺旋杆菌没有抑菌作用,而搭载了LEV 的纳米纤维膜表现出了很强的抑菌作用,最终出现了抑菌区的重叠。对大肠杆菌、金黄色葡萄球菌和幽门螺旋杆菌的抑菌性能测试实验结果在48h 后取得,结果表明搭载了LEV的纳米纤维膜的抑菌区一直明显地存在,这证明了所设计的搭载LEV 的纳米纤维膜具有广谱的、长期的抑菌效果。

图7 制备的纳米纤维膜的抑菌活性Fig. 7 The antibacterial activity of the prepared nanofibrous membranes
3 结 论
本实验采用一步静电纺丝技术,将LEV 对幽门螺旋杆菌有强效抑制作用的特性与CS/PVA 纳米纤维结构相结合,制备了搭载LEV 的LEV/CS/PVA 纳米纤维膜,并对其作为潜在的治疗胃溃疡的新方法进行了评价。LEV/CS/PVA 纳米纤维膜具有良好的纳米纤维结构,水接触角测试表明了其具有良好的亲水性,这有利于其和生物流体接触。体外释放测试表明LEV 有长时间的释放效果。体外细胞毒性测试表明制备的纳米纤维膜具有良好的生物相容性。抑菌试验表明,搭载LEV 的纳米纤维膜对大肠杆菌、金黄色葡萄球菌与幽门螺旋杆菌具有广谱的、长效的抑菌效果。这些结果表明LEV/CS/PVA 纳米纤维膜在治疗胃溃疡中具有潜在的应用价值。

