菌-肠-脑轴与血脑屏障通透性的相关性研究进展
华嵘暄, 高 晗, 王博雅, 郭玥昕, 梁 宸, 高 磊, 尚宏伟, 徐敬东
华嵘暄, 首都医科大学临床医学专业“5+3”长学制 北京市 100069
高晗, 首都医科大学基础医学院生理学与病理生理学系北京市100069
王博雅, 北京大学医学部临床医学八年制 北京市 100083
郭玥昕, 首都医科大学口腔医学专业“5+3”长学制 北京市 100069
梁宸, 首都医科大学临床医学专业 北京市 100069
高磊, 首都医科大学生物医学工程学院生物医学信息学系 北京市 100069
尚宏伟, 首都医科大学基础医学院形态学实验中心 北京市 100069
徐敬东, 首都医科大学基础医学院生理学与病理生理学系 北京市 100069
华嵘暄, 首都医科大学临床医学“5+3一体化”专业学生, 研究方向为消化生理学与临床医学.
Rong-Xuan Hua, Clinical Medicine “5+3” Program, Capital Medical University, Beijing 100069, China
Han Gao, Jing-Dong Xu, Department of Physiology and Pathophysiology, School of Basic Medical Sciences, Capital Medical University, Beijing 100069, China
Bo-Ya Wang, Clinical Medicine Program, Peking University Health Science Center, Beijing 100081, China
Yue-Xin Guo, Oral Medicine “5+3” Program, Capital Medical University, Beijing 100069, China
Chen Liang, Clinical Medicine, Capital Medical University, Beijing 100069, China
Lei Gao, Department of Biomedical Informatics, School of Biomedical Engineering, Capital Medical University, Beijing 100069, China
Hong-Wei Shang, Morphological Experiment Center, School of Basic Medical Sciences, Capital Medical University, Beijing 100069, China
0 引言
随着研究技术的不断完善, 大脑不再被认为是一个独立存在的器官而单独履行其功能. 越来越多的研究表明, 中枢神经系统(central nervous system, CNS)有许多的外周调节途径, 其中肠道是日益关注的焦点, 肠道菌群对宿主的生理和心理健康特别是对大脑发育过程的影响引起了人们广泛兴趣. 肠道菌群影响中枢和外周神经胶质细胞的发育, 调节其在整个生命过程中的稳态. 肠道微生物对肠神经胶质细胞的发育、迁移和分化至关重要, 并参与粘膜免疫反应, 并维持肠道上皮屏障功能. 而病理状态下肠道菌群多样性降低, 有益菌群减少, 致病菌增加, 可导致肠上皮细胞间紧密连接(tight junction, TJ)减弱, 屏障作用降低, 肠道微生物发生移位, 引起组织的慢性炎性病理变化. 近年来有研究结果令人倍感兴奋: 在使用肠道菌群移植后阿尔兹海默(alzheimer’s disease, AD)、帕金森病(parkinson’s disease, PD)等神经功能障碍有所缓解, 推测肠道菌群对脑功能的调节作用可能与血脑屏障(blood-brain barrier, BBB)相联系, 而神经退行性疾病的发生也与之相关. 本文由肠道菌群出发, 阐述菌-肠-脑轴与BBB完整性相关性的最新进展, 以期从肠道出发, 为预防和治疗神经系统疾病提供新的方向.
1 肠道菌群
肠道菌群与宿主长期互惠共生, 其数量级与人类全身细胞总数相当, 超过10个, 其中绝大部分位于回肠末端与结肠. 肠道内微生物数量如此之庞大, 其代谢等功能对宿主的影响不容小觑, 目前已经证实, 乳酸菌和双歧杆菌有利于肠道屏障功能的维持, 而梭状芽孢杆菌过度增殖可能打破免疫稳态致使通透性增加, 造成炎性肠病等异常.
肠道菌群及其代谢物的作用不止于此, 动物实验证实肠道菌群与脑之间存在一定功能上的联系, 给无菌小鼠移植微生物后BBB通透性降低, 与之相反肠道微生物的缺失会导致BBB通透性增加, 出现TJ蛋白occludin, claudin-5明显减少. 特别是长期服用抗生素的小鼠肠道微生物数量和多样性降低, 动物可出现认知功能障碍、海马神经损伤以及记忆力下降; 而服用益生菌的作用则与之相反. 这些结果提示肠道菌群的稳态与脑功能联系密切. 随着脑-肠之间相关性研究的深入, 着眼肠道菌群以解决中枢神经系统问题已成为当今研究热点.
2 BBB通透性改变
20世纪初, 研究人员发现动物接受静脉注射苯丙胺后, 其余器官均有苯丙胺分布, 唯独脑组织例外-这不由让人想到有某种屏障的存在影响这种物质的扩散. 随后研究证实在脑部毛细血管和神经胶质细胞间存在BBB. 众所周知, BBB是循环系统和中枢神经系统之间重要的“活跃接口”, 对营养物质的运输和代谢物的清除具有调控作用, 同时兼备对潜在有毒、有害物质的滤过作用, 以维持CNS的稳态. 因此, BBB的通透性增加被视为神经元损伤、脑内环境稳态失衡、神经退行性疾病发生的重要原因.
BBB的构成并不简单(如图1), 包括脑微血管内皮细胞(brain microvascular endothelial cells, BMECs)、周细胞、星形胶质细胞终足、小胶质细胞和细胞外基质等. BMECs间TJ由三类蛋白(由claudins、occludins和连接黏附分子组成的跨膜蛋白; 胞质附着蛋白zonulae occludens 1-3; 以及细胞骨架蛋白)有序排列组成, 限制一些大分子物质及细菌透过, 以保持脑内部的内环境稳态. 周细胞环绕在BMECs外, 能够起到控制毛细血管管径, 调节胞吞、免疫细胞运输的作用. 小胶质细胞作为BBB建立过程中的重要细胞, 是CNS的“第一道防线”, 分泌血管生长素, 促进脑血管生成, 同时又能通过CX3CR1、CD11b/c和CD45的抗原标记判定脑实质中血源性物质和潜在炎症刺激. 有研究表明, 当胚胎期血管发生完成后, 去除小胶质细胞不会导致BBB功能的改变, 提示小胶质细胞对BBB的维持并非必要. 如图1A所示, 星形胶质细胞的终足包绕在周细胞与内皮细胞外, 作为“第二道物理屏障”选择性地阻挡微生物、大分子化合物等物质的通过. 神经元借助星形胶质细胞与BMECs形成内皮-神经元的联系, 能够传导神经信号, 调节局部血流量, 对于维持大脑内血流的稳定发挥重要的调节作用. 为了完成通过血浆进入CNS的物质的滤过, 机体可谓“煞费苦心”.
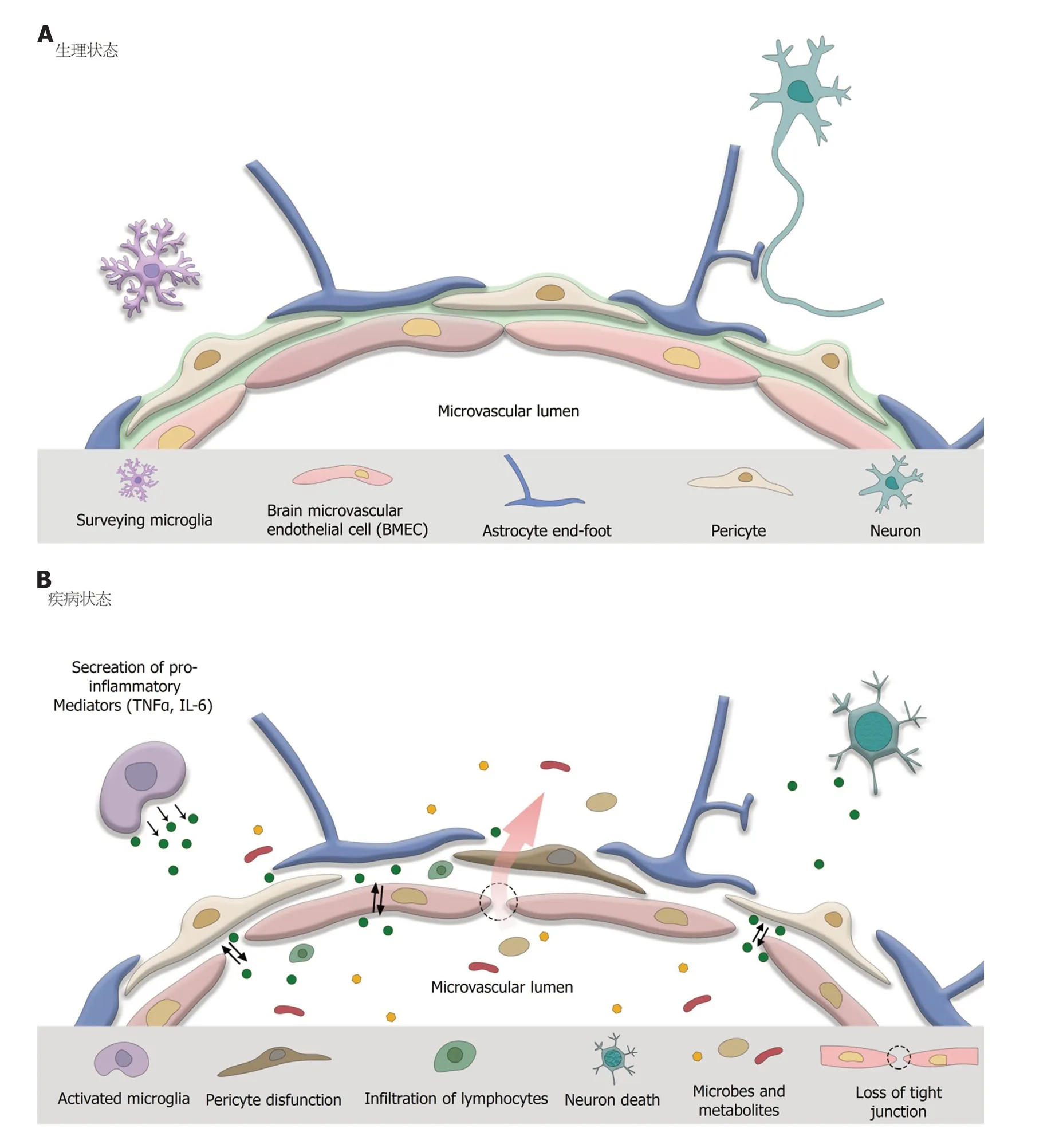
图1 血脑屏障构成方式改变模式图. A: BBB的神经血管内皮单元由BMEC、周细胞、星形胶质细胞以及小胶质细胞等构成; B: 当创伤和感染时, BMEC间紧密连接的破坏引起BBB通透性增加, 免疫细胞以及小胶质细胞释放TNFα, IL-6, BBB渗透性增加, 导致细胞外基质缺失以及神经元死亡. Surveying microglia: 未激活的小胶质细胞; Brain microvascular endothelial cell, BMEC: 脑微血管内皮细胞; Astrocyte end-foot: 星形胶质细胞末梢足突; Pericyte: 周细胞; Neuron: 神经元; Microvascular lumen: 微血管腔隙; Activated microgila: 激活的小胶质细胞; Pericyte disfunction: 周细胞功能丧失; Infiltration of lymphocytes: 淋巴细胞的浸润; Neuron death: 神经元死亡; Microbes and metabolites: 微生物及其代谢产物; Loss of tight junction: 紧密连接的丧失; Secretion of pro-inflammatory mediators: 促炎因子的释放; BBB: 血脑屏障; IL-6: 白细胞介素-6.
诚然BBB的生理结构也是“双刃剑”, 精细的生理结构也让BBB的病理改变难以修复. 如图1B所示, 创伤及感染导致小胶质细胞由静息时的高度分支状变为肾形或杆状的活化形式并释放促炎因子. 这使BBB通透性增加, 引起血源性免疫细胞、细胞因子、菌群代谢物的渗透, 这又会引起慢性颅内炎症, 其与BBB的受损通常相伴发生, 很难分清因果关系. 紧密连接的减少、BMECs的破坏、星形胶质细胞与小胶质细胞的活化、外周免疫细胞渗透皆可使BBB完整性降低.
3 神经退行性疾病源起BBB通透性改变
肠道生态系统由庞大的细菌数量形成稳定的生态圈, 其代谢产物将信号可传递远端器官, 因此肠道菌群与免疫系统、激素、大脑、宿主代谢等功能都有相关性. 最新的研究表明, 肠道菌群与肥胖、炎症性疾病、神经系统发育障碍等疾病相关. 目前, 肠道菌群紊乱与神经退行性疾病的发生、发展相关性研究已经引起了广泛的关注.
神经退行性疾病是造成老年人残疾, 生活障碍与运动障碍的主要因素之一, 给社会和家庭带来巨大的压力. 如AD、PD、血管性痴呆、路易体痴呆、额颞叶痴呆等. 生理状态下BBB具有选择性屏障的作用, 外周T细胞不能进入脑实质; 但在AD患者脑实质中出现中性粒细胞以及CD4T细胞亚群中的Th1和Th17细胞的浸润. Th17细胞分泌促炎因子白细胞介素(interleukin, IL)-17、IL-21和IL-22与神经元上受体结合, 诱导其凋亡, 这是CNS疾病的特点之一. 可见, 相伴而生的BBB功能的下降与颅内炎症直接对神经退行性疾病具有一定的相关性. 因此, 保护并重建BBB完整性, 避免淋巴细胞的浸润、血管内皮炎症的出现势必在预防与治疗AD及其他神经退行性疾病中尤为关键.
除BBB完整性对神经退行性疾病有相关影响外, 近年来对α突触核蛋白(α synuclein, α-Syn)的研究也成为热点. α-Syn由140个氨基酸组成小分子蛋白质, 由于PD患者的α-Syn的突变可破坏α-Syn螺旋结构, 使之形成β-折叠进而聚集并产生具有神经毒性作用的纤维丝样蛋白聚集体, 最终导致PD的发生. 有研究证实α-Syn参与突触小泡运输调节与控制内质网稳态. 值得注意的是单体或聚集的α-Syn能在细胞之间迁移或通过BBB, 加速神经病理状态的发展. 尽管目前对其确切功能尚不清楚, 但有证据表明α-Syn是多巴胺释放和突触小泡循环所必需的. 在人回盲部也发现病理相关的α-Syn, 此处有大量菌群聚集, 推断可能是病理α-Syn产生的源头. 在小鼠模型中发现了PD方面与胃肠中致病性α-Syn产生并积累的相关性. α-Syn以跨突触传递方式, 从肠道神经元传递到迷走神经, 通过轴腔逆向运输的方式沿迷走神经上行至延髓及脑桥被盖, 此处正是PD发病第一、二阶段的病理区域. 然而研究提示, 迷走神经并不是PD发生发展的必要条件, 啮齿类动物实验中切断迷走神经, 虽能延缓但不能阻断PD发病. 在脊髓损伤或缺血后α-syn水平增加, 并导致神经退行性疾病发展, 小胶质细胞的迁移与活化在其中有重要作用, 但α-syn是否调节以及如何调节小胶质细胞还未知晓. 基于此, 研究肠道微生物-肠内分泌细胞-肠神经元-肠道免疫系统之间的相互作用, 对于探索肠道与CNS的相互作用具有重要的意义.
4 菌-肠-脑轴影响BBB通透性
从原来的无人问津到如今如火如荼, 肠-脑轴已经成为目前神经科学不可回避的热门话题. 在过去的十年里, 大量的研究发现, 肠道中数以万亿计的细菌可能会对大脑产生深远的影响, 并可能与一系列疾病有关. 菌-肠-脑轴(intestine flora-gut-brain axis)是连接肠道微生物群与中枢神经系统的双向信号通路.
4.1 肠粘液屏障作为菌-肠-脑轴起点 肠道通过机械屏障和免疫屏障抑制微生物及代谢物与肠上皮的直接接触. 肠腔内有粘液分泌, 并伴随免疫球蛋白及抗菌肽的释放, 共同构成屏障被形象地称为粘膜“防火墙”, 保护机体以避免致病菌的攻击.
肠上皮覆盖之粘液主要由高度糖基化的蛋白质组成, 主要是杯状细胞分泌的粘蛋白2(mucin2, MUC2), 糖基化的MUC2能够保护蛋白质免受微生物蛋白酶的降解. 小肠的粘液层相对结肠较弱, 但其丰富的潘氏细胞中含有大量抗菌分子. 当受到肠道菌群刺激后, 潘氏细胞分泌α-defense限制其繁殖; 而ILC3淋巴细胞通过释放IL-22促进抗菌肽(antimicrobial peptide, AMP)的合成, AMP跨细胞进入肠道, 防止产碱菌的生成; 诱导岩藻糖基转移酶的合成, 使得上皮聚糖的岩藻糖基化, 从而抑制肠道菌群. 此外, 肠道粘膜下的浆细胞分泌免疫球蛋白A(immunoglobulin A, IgA), 参与肠道生物屏障的构成, IgA进入肠腔后与细菌或其表面抗原结合, 抑制微生物靠近肠上皮细胞. 共生细菌也能诱导同源性免疫球蛋白G(immunoglobulin G, IgG)反应. IgG抗体可通过识别高度保守的蛋白质以识别并结合多个菌群以限制病原微生物的增长.
肠道粘膜“防火墙”完整性的破坏意味炎症和疾病的发生, 上述的多种防御机制互相维持平衡, 每个环节完整性对肠道菌群微环境的稳态起着重要作用.
4.2 菌-肠-脑轴影响BBB的三种路径 菌-肠-脑轴可通过三种特别重要的方式作用于BBB, 如图2所示. 首先可以直接通过神经元将信号传递给大脑的神经网络. 肠道上皮的肠内分泌细胞表面会表达短链脂肪酸(short chain fatty acid, SCFA)的G蛋白偶联受体, SCFA通过后者刺激肠内分泌细胞释放神经肽, 将信号通过支配肠道的肠神经元及迷走神经传导至脑干. 随着年龄增长, 肠道处的巨噬细胞(Mφ)因子增加导致肠神经元对炎症信号的反应变化, 肠道神经元的凋亡增加. 这会造成肠-脑沟通能力受损, 影响肠道功能. 菌群代谢物可调节免疫细胞因子的释放, 充当神经递质.
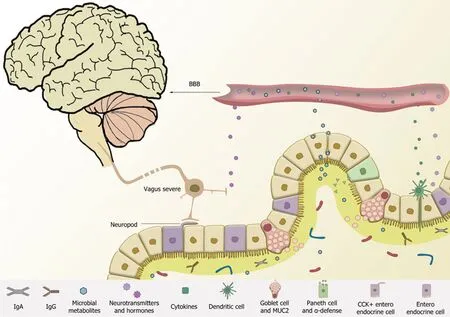
图2 菌-肠-脑轴交互调节模式图. 肠道微生物代谢产物通过借助循环系统将细菌代谢物运输到BBB传递信息, 或诱导神经递质的产生或直接以代谢物作为神经递质影响中枢神经系统; 通过肠内在神经系统和外来神经系统网络结构进行双向信号传导; 多种途径共同作用, 以复杂关系、跨系统的方式构建菌-肠-脑轴双向通路. Neurotransmitters and hormones: 神经递质与激素; Cytokines: 细胞因子; Dendritic cell: 树突状细胞; Paneth cell and MUC2: 杯状细胞细胞和MUC2; Paneth cell and α-defense: 潘氏细胞和α-防御素; Entero endocrine cell: 肠内分泌细胞; vagus nerve: 迷走神经; BBB: 血脑屏障; IgA: 免疫球蛋白A; IgG: 免疫球蛋白G.
其次, 通过血液循环将分泌出的细胞因子与免疫信号分子运输到达BBB. 肠内分泌细胞检测到菌群代谢物后, 释放激素并伴随饮食代谢物与神经递质通过血液运输至BBB. BBB上的特定受体能够允许营养物和一些调节性因子通过BBB直接进入到脑组织中. 衰老、损伤、感染等引发的上皮屏障被破坏可以导致细菌及其代谢物的渗透, 触发炎症免疫反应, 且有可能引起肠神经元死亡. 如果肠道炎症持续存在, 会致使血清中TNF、IL-6、IL-1β等因子升高, 引发全身性的炎症反应, 破坏BBB. 脑部炎症会促进免疫细胞外渗, 激活小胶质细胞, 促进炎症信号的传递, 形成恶性循环. 因此, 在神经退行性疾病发病早期, 体内可能存在微生物与免疫细胞相互影响, 肠上皮屏障受损与细菌感染, 并通过影响肠脑细胞因子和免疫细胞运输而促进疾病发展.
第三, 代谢物激活的免疫细胞可通过血流在BBB处释放可溶性因子, 从而影响其完整性并改变脑细胞的炎症状态. TNFα可上调BBB处与脑中的黏附因子等, 促进Mφ和白细胞向脑外部渗透, 下调紧密连接破坏BBB完整性.
此外, 近期研究还发现肠上皮细胞和神经元之间存在一种直接联系“neuropod”, 这是一类特化的肠内分泌细胞, 与肠道周围神经元形成突触释放谷氨酸作为神经递质从而快速传递肠道与微生物的化学信号. 这种途径能更直接更有效地响应肠道菌群代谢物的产生. 深入研究发现, 肠内分泌细胞并不只分泌一种信号分子, 而是利用不同的分泌小泡来储存丰富的信号分子. 这些分子在不同的排列组合下传递不同信息, 如营养价值、机械膨胀、渗透性、pH或温度等. 因此通过“neuropod”肠上皮细胞能轻松与迷走神经进行信息传递, 进而构成肠-脑通路. 如, 在小鼠模型中葡萄糖刺激cck肠内分泌细胞可通过谷氨酸神经传递激活迷走神经结节神经元, 这些研究中的信号通路对菌-肠-脑信息交流的积极作用令人欣喜.
肠-脑双向通路, 影响饱腹信号和食欲调节, 以及记忆、学习、情绪等功能, 并且与CNS疾病发生密切相关.
5 肠道菌群及代谢产物影响BBB
正如前面所说BBB与CNS之间存在功能上的联系, 诠释肠道菌群及其代谢产物通过直接或间接的方式调节BBB通透性影响CNS神经元的功能. 使用健康小鼠的肠道菌群移植到无菌小鼠体内会使之BBB完整性和TJ蛋白表达量上调, 提示肠道菌群具有调节BBB的潜在作用. 肠道菌群的主要代谢产物SCFA和维生素在宿主体内具有信号传导功能, 能够通过循环系统到达BBB, 对BBB完整性以及CNS功能等具有调节作用.
5.1 短链脂肪酸与BBB的关系 SCFA是肠道菌群重要的代谢产物之一, 是含1-6个碳原子的有机酸, 包含乙酸、丙酸、丁酸、乳酸、异丁酸等, 90%的SCFA是由肠道菌群发酵膳食纤维的终产物. 有95%被结肠粘膜吸收, 仅有少部分能进入到循环系统中. 它们为微生物提供能量与碳元素, 也能促进肠道蠕动和水盐吸收, 提供饱腹感. 作为信号分子在调节宿主代谢免疫系统和细胞增殖方面具有关键作用.
SCFA不仅对宿主消化系统有作用, 还可作用到单核巨噬细胞、淋巴细胞等免疫细胞通过影响炎症因子的释放, 细胞趋化反应, 抑制免疫效应等细胞增殖等参与肠道内的免疫调节在肠道抵御致病菌中起重要的作用. 在GPR43的小鼠表现为免疫屏障功能缺陷, 肠上皮受损并出现全身性炎症, 无菌小鼠在口服丁酸盐后, BBB的TJ蛋白上调, 通透性降低. 给颅外伤模型小鼠丁酸梭菌灌胃后BBB的通透性降低、TJ蛋白水平上调、认知功能障碍得到改善; 体外培养的BMECs在表达丙酸盐受体后, 可下调脂多糖受体CD14相关mRNA表达, 抑制低密度脂蛋白受体相关蛋白-1的表达. 这保护BBB免受氧化应激, 减轻炎症反应, 降低了BBB的渗透性, 保护了BMECs. 此外, SCFA能通过BBB激活小胶质细胞上由外周免疫细胞表达的游离脂肪酸受体2/3(FFAR2/3), 发挥抗炎作用阻断小胶质细胞与促炎因子间的正反馈调节作用, 保护神经元及神经胶质细胞免受炎症损害.
当然, SCFA对宿主的作用具有多样性. 实验研究证实自闭症小鼠模型中较高比例的丙酸盐可导致症状加剧, 补充丁酸盐后症状缓解. 由此观之, SCFA对神经系统的影响不是靠单一因素决定的, SCFA构成比例在发挥作用时需要特别关注. 由此可见, 无论是在预防还是治疗中, SCFA的平衡对BBB的作用是显而易见的, 其主要通过上调紧密连接蛋白、减轻神经炎症、调节受干扰的小胶质细胞功能三方面发挥作用. 就现有证据来看, SCFA可以缓解由于中枢神经元功能受损引起的功能障碍, 但如何配置SCFA间的最佳比例有待进一步研究.
5.2 维生素与BBB完整性的关系 维生素(vitamin, Vit)是维持人体生理功能不可缺少的营养素, 是物质代谢中起重要调节作用的许多酶的组成成分, Vit是人体必需从饮食肠道菌群中获得的物质, 虽然该物质在体内既不是构成身体组织的原料, 也不作能量来源, 但是具有抗氧化、基因调控和辅助因子的重要作用. 肠道菌群产生的维生素主要在结肠被吸收, 而从食物中直接获得的维生素则是在小肠被吸收. 其中, 细菌来源的Vit K(menaquinone-7, MK-7), 作为γ-谷氨酰羧化酶辅助因子, 可催化谷氨酸残基羧化为Vit K依赖性蛋白中的γ-羧基谷氨酸残基, 这是蛋白激活的关键步骤; Vit B是另一可由肠道菌群为人类提供的必须营养素, 研究表明256种常见肠道细菌的基因组中包含了全部8种Vit B的合成途径. 肠道菌群与维生素代谢产物的对应关系见表1.

表1 肠道菌群源性的维生素的功能关系
肠道菌群代谢产生的维生素对宿主有重要影响. MK-7的生成有助于提供抗氧化活性并保护细胞膜免受脂质过氧化作用. VitK具有免疫调节作用, 调节人巨噬细胞中TNF-α、IL-1α和IL-1β等细胞因子表达从而影响到BBB和小胶质细胞的活性,而这些改变很可能有助于降低AD、PD发病. 此外抗凝剂华法林(VitK拮抗剂)的过度使用造成数百万患者如心房颤动、深静脉血栓形成、肺栓塞等血栓症状. 与AD发病相关的因素之一载脂蛋白E4(APOE4)等位基因, 其携带着普遍血液中Vit K水平较低, 并且脑容量明显小于其他APOE基因型. 由此推断Vit K可能与脑损伤创伤修补有关. Vit K还通过减缓α-syn原纤维化, 从而生成短的原纤维和无定形聚集体, 它们不易产生合成囊泡渗漏, 这一过程可抑制PD发病. 有研究表明在饮食中增加摄入Vit K可以减轻老年人的记忆衰退. 肠道菌群的建立伴随着Vit B族合成量趋于稳定, 而缺乏Vit B导致多发性神经病、神经性脚气病等. Vit B(叶酸)和神经管的形成相关, 缺乏会导致认知障碍. 叶酸甲酯是为数不多被认可对抗抑郁的药物之一. Vit B和Vit B、B等可以缓解AD认知下降相关区域的大脑萎缩. 因此, 作为肠道菌群一大产物的维生素与脑部健康的关联性已得到证实.
总之, 这些肠道菌群代谢产物能够以多种方式调节宿主生理功能, 除影响BBB外还可直接作用于肠上皮屏障, 未来的维生素研究对于认识维生素的调控及其如何有助于预防和治疗神经系统疾病而言至关重要.
6 调控肠道菌群作为预防和治疗神经退行性疾病的潜在价值
正如本文所述肠道菌群及其代谢产物对BBB的影响及影响方式, 以及脑神经和胃肠道之间的复杂的网络联系以菌-肠-脑轴的起点, 在神经退行性疾病的预防与治疗中很可能作为潜在的有效切入点.
6.1 益生菌促进肠道微环境稳态 益生菌是适当添加或天然存在于食品中的有益微生物. 常见益生菌包括双歧杆菌、乳杆菌、乳球菌、肠球菌、链球菌等. 早在20世纪初人们就发现了乳酸杆菌可缓解抑郁症, 由此产生了“精神益生菌”这一名词, 用来表示益生菌在有关脑与心理疾病中的积极作用. 随着对神经退行性疾病的深入了解, 大量证据支持益生菌在AD、PD等神经退行性疾病中的有益作用. 实验表明, 为PD患者提供双歧杆菌与乳酸杆菌混合物后, 可见患者运动功能得到改善. 而在AD模型小鼠中施用双歧杆菌与乳酸杆菌混合物, 可明显改善学习记忆能力, 下调氧化应激反应, 减少大脑中组织病理学标记, 恢复神经元细胞蛋白水解能力.
益生菌可通过调节GABA与谷氨酸释放, 协调控制神经元兴奋和抑制平衡; 促进脑源性神经生长因子的释放; 同时参与促炎和抗炎因子的调节, 缓解炎症导致的BBB通透性增加, 防止潜在有害物质进入大脑. 由此观之, 益生菌缓解AD、PD等疾病的证据, 为其在疾病缓解与治疗中提供了理论支持.
6.2 通过粪便微生物菌群移植改善肠道微环境 粪便微生物群移植(fecal microbiota transplantation, FMT)是指将健康肠道中含有肠道菌群的粪便通过灌肠、鼻饲、内窥镜等方法移植到患有相关病症的受体中, 从而改善其肠道环境以起到治疗疾病的作用. 因此, FMT被用于改善宿主行为的研究. 有研究发现GFBALB/c小鼠中利用FMT定殖了来自NIH Swiss小鼠菌株肠道内的微生物, 定殖后的BALB/c小鼠海马中脑源性神经生长因子水平升高, 其探索行为增加; 相反, 用BALB/c小鼠肠道微生物菌群定植无菌NIH Swiss小鼠会表现出更多的胆怯. 利用FMT将正常小鼠的粪便微生物群移植至PD模型小鼠后, 表现出较明显的神经保护作用, TNF驱动的神经炎症减少, 且脑中多巴胺和血清素的水平增加, 从而使得运动状况得以改善. 因此, FMT在神经退行性疾病治疗中值得被进一步关注.
7 结论
肠-脑轴是将大脑和肠道功能整合的双向信息交流系统, 肠道微生物参与肠-脑轴的功能反应, 在肠道与大脑的信息交流中发挥着非常重要的作用, 肠道菌群与神经退行性疾病有相关性, 且定植特定菌群或将健康机体内微生物群落移植等方法直接促进了这类疾病的缓解. 越来越多的证据令人信服, 并在基于微生物的疗法中看到了巨大的潜力. 因此, 菌-肠-脑通路及其中涉及的相关分子可能作为潜在治疗或预防神经退行性疾病的靶点.
8 问题与展望
尽管目前越来越多的研究证实菌-肠-脑轴影响BBB通透性进而影响CNS, 但距离改善神经退行性变为首的影响众多老年人健康的疾病的目标, 还有许多研究工作. 如何将已有的分子水平及动物水平的研究推广到患者身上, 如何把握“通过饮食调节脑部功能”这条捷径并制定临床可行的防治方案, 如何从多处靶点找到干预疾病发展的通路或药物, 这些都是目前研究者们应当重点关注的方面. 期待有老年杀手之称的神经退行性疾病之僵局能够从菌-肠-脑通路获益.

