冰温发酵鳜鱼对鱼肉滋味及其生物胺含量的影响
徐鸣,万金庆,2,3*,侯博玉
1(上海海洋大学 食品学院,上海,201306)2(上海水产品加工及贮藏工程技术研究中心,上海,201306) 3(农业部水产品贮藏保鲜质量安全风险评估实验室,上海,201306)
鳜鱼(Sinipercachuatsi),又称桂花鱼,是鮨科、鳜属的鱼类,鱼肉有补气血、益脾胃之功能,具有重要的经济价值[1]。发酵是用于食品保存的一种常见加工方式,在改善食品营养和功能特性方面起着重要作用[2],在发酵作用下,鱼体内的脂肪、蛋白质及其他有机物降解成游离脂肪酸、氨基酸、核苷酸和其他小分子物质,给予鱼肉特殊的滋味,深受消费者们的喜爱[3-4]。传统发酵鳜鱼的制作是在新鲜鳜鱼中加入盐份,于10~20 ℃条件下发酵1周左右制成。虽然所需时间短,但得到的成品会含盐量偏高,腥臭味重,风味差。为了提发酵鳜鱼品质,厂家开始改用低温低盐的发酵方式,虽然发酵时间相对较长,但鱼肉的品质滋味更佳[5-6]。本实验更进一步降低温度,采用冰温发酵的方法对鳜鱼进行发酵,并与常温下发酵相对比,研究发酵过程中鱼肉的生物胺、核苷酸、游离氨基酸、感官评价以及pH、微生物、总挥发性盐基氮(total volatile basic nitrogen,TVB-N)等指标,为冰温发酵鳜鱼提升产品品质提供科学的理论依据。
生物胺是一类具有生物活性的低分子质量含氮有机化合物的总称,在水产品中尤其是发酵水产品中普遍存在[7]。人体内源性生物胺是活性细胞内不可或缺的化合物,可以起到调节血压以及血糖的浓度,调节DNA、RNA和蛋白质合成,以及抗氧化的作用,但摄入过多生物胺会引起头疼、肠胃不适、甚至导致中毒及危害生命[8],因此,生物胺可以作为水产品品质及安全的重要指标,而生物胺的安全限量没有统一的国际标准。美国食品药物管理局(Food and Drug Administration,FDA)限定人体摄入组胺和酪胺的含量不超过50 mg/kg,酪胺和苯乙胺含量不得超过100~800 mg/kg和30 mg/kg[9],欧洲食品安全局(European Food Safety Authority,EFSA)规定水产品中组胺的含量在100~200 mg/kg[10]。食品中生物胺的总量超过1 000 mg/kg,将诱发人体中毒[11]。
1 材料与方法
1.1 材料及试剂
新鲜鳜鱼、食用钠盐,上海临港新城农工商超市。
生物胺标准品,上海生工公司;衍生试剂丹磺酰氯(dansyl chloride,DNS-Cl)、乙腈(色谱纯)、乙醚(分析纯)、丙酮(分析纯)、氨水(分析纯)、乙酸铵(色谱纯),上海泰坦科技股份公司;三氯乙酸、高氯酸、氢氧化钠、氢氧化钾、氯化钠、平板计数琼脂、MRS培养基、PDA培养基,国药集团化学试剂有限公司。
1.2 仪器与设备
LHS-150HC恒温恒湿箱,上海一恒科学仪器有限公司;pH计,上海仪电科学仪器股份有限公司;TGL-16M型台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;Kjeltec 8400全自动凯氏定氮仪,丹麦FOSS;L-8800氨基酸全自动分析仪,日本Hitachi;W2690/5高效液相色谱仪,美国Waters;Symmetry C18(4.6 mm×250 mm,5 μm),美国Waters公司;滤膜针头滤器(13 mm,0.22 μm),上海安谱实验科技股份有限公司;A25实验室小型均质机,上海福克设备有限公司;垂直流SW-CJ-2F超净工作台,苏州尚田洁净技术有限公司。
1.3 实验方法
1.3.1 样品处理
将新鲜鳜鱼宰杀,去鳞去内脏,洗净后切成大小相近的鱼块,加入3%(质量分数)的食用盐均匀涂抹并整齐铺满发酵盒,盖上盖子。取两块鱼肉于-18 ℃的冰箱中,将温度采集仪的热电偶固定于鱼肉中心位置,10 s记录1次温度,至鱼肉完全冻结,得到鱼肉的冰点为-2.5 ℃。将上述鱼肉分别置于10、-1.5 ℃的恒温恒湿箱中发酵。10 ℃条件下的鱼发酵4 d,每隔1 d取1次样,冰温条件下的鱼发酵15 d,每隔3 d取1次样,取样品真空包装于-18 ℃冰箱保存,备用。
1.3.2 pH测定
参考并改进CHEN等[12]的方法,切碎取肉糜2.0 g,加入蒸馏水18 mL,均质,8 000 r/min离心10 min,取上清液进行测定。
1.3.3 微生物含量测定
参考并改进GB 4789.2—2016《食品安全国家标准 食品微生物学检验菌落总数的测定》和曾雪峰[13]的方法,每组鱼肉样品无菌操作取样3 g,切碎后加入27 mL无菌生理盐水(0.9 g/L),均质15 min,梯度稀释,选取3个适宜稀释度的样液,取0.1 mL 的样液倾注在不同培养基上培养,测定不同的微生物数量,每个样液做3个平行。乳酸菌(lactic acid bacteria,LAB)用MRS培养基,30 ℃下培养2~3 d;酵母用PDA 培养基,25 ℃下培养3~4 d,菌落总数(total viable counts,TVC)用PCA平板计数培养基,30 ℃培养3 d,进行菌落总数计算,以lgCFU/g表示。
1.3.4 TVB-N测定
依据 GB 5009.228—2016《食品中挥发性盐基氮的测定》中的分析方法测定TVB-N值。
1.3.5 呈味核苷酸测定
参考徐美禄等[14]方法略有改动。取3.0 g发酵鱼肉,加入10 mL 10%(质量分数)高氯酸溶液匀浆,超声处理5 min后离心(4 ℃,10 000 r/min,15 min)取上清液,5%(质量分数)高氯酸5 mL 洗涤沉淀,相同条件下离心,合并2次上清液。使用氢氧化钾溶液调节pH至6.5,用50 mL容量瓶定容,摇匀后0.22 μm水相滤膜过滤打入进样瓶进行测定。试验采用GL Inertsil ODS-3 色谱柱(4.6 mm×250 mm)等梯度洗脱,柱温30 ℃,流速1 mL/min,进样量10 μL,紫外254 nm检测。
1.3.6 游离氨基酸测定
参考WANG等[15]的方法并有所改动。称取2.0 g 样品,加入15 mL 5%(质量分数)三氯乙酸溶液,匀浆,超声处理5 min,4 ℃静置2 h,离心(4 ℃,10 000 r/min,10 min),取上清液5.0 mL,氢氧化钠溶液调节pH至2.0,10 mL容量瓶定容,摇匀后0.22 μm水相滤膜过滤打入氨基酸全自动分析仪进样瓶进行测定。
1.3.7 生物胺测定
生物胺的提取参照GIGIREY等[16]的方法。称取2 g鱼肉,加入10 mL 0.4 mol/L的高氯酸,均质10 min,均质液在12 000×g冷冻离心10 min,重复2次提取后收集上清液,用0.4 mol/L 的高氯酸定容至25 mL。
生物胺的衍生参照GIGIREY等[16]的方法进行。取1 mL的提取液加入200 μL 2 mol/L氢氧化钠调节pH值,再加入300 μL饱和碳酸氢钠和2 mL的丹磺酰氯(10 mg/mL)混合均匀,在40 ℃水浴45 min,然后加入100 μL氨水(25 g/L),室温下避光静置40 min,用乙腈定容到5 mL。最后,取上清液过0.45 μm有机相膜打入进样瓶待测。
1.3.8 味精当量(equivalent umami concentration,EUC)的计算
EUC[17]表示呈味核苷酸和鲜味氨基酸在协同作用下产生的鲜味强度,是以谷氨酸钠(monosodium glutamate,MSG)的含量来表示100.0 g样品中总呈鲜物质的量。其计算如公式(1)所示:
EUC=∑aibi+1 218(∑aibi)×(∑ajbj)
(1)
式中:EUC,g MSG/100g;ai表示Asp和Glu(鲜味氨基酸)含量,g/100g;bi表示Asp和Glu相对于MSG的鲜度系数(其中Glu=1.0,Asp=0.077);aj表示呈味核苷酸肌苷酸(inosine monphosphate,IMP)、单磷酸腺苷(adenosine monophosphate,AMP)的含量,g/100g;bj表示呈味核苷酸相对于IMP的鲜度系数(其中IMP=1.0,AMP=0.18);1 218是协同作用系数。
1.3.9 数据分析
利用Origin lab 2017 软件绘制曲线,用Excel 2010和SPSS 25.0软件分析单因素ANOVA检验来进行显著性和方差分析,P<0.05为差异显著,P>0.05为差异不显著。
2 结果与分析
2.1 游离氨基酸含量变化
2组不同条件下鳜鱼发酵过程中的氨基酸含量变化如表1、表2所示,2组鱼肉中游离氨基酸含量均随着发酵过程的进行逐渐增加,有显著性差异(P<0.05)。冰温发酵过程中,鲜味谷氨酸含量从9.46 mg/100g增加到第15天的38.24 mg/100g,增加近4倍,在第15天达到阈值,谷氨酸对呈现鲜味做出贡献。天冬氨酸在第15天达到最高值13.96 mg/100g,但始终未达到阈值,因此,天冬氨酸在整个过程中对鲜味的影响不大。鲜味氨基酸总量最高为52.60 mg/100g。10 ℃发酵过程中,谷氨酸和天冬氨酸及鲜味氨基酸总含量均在第3天达到最高值分别为31.20、12.24、43.44 mg/100g,其中,天冬氨酸同样始终未达到阈值,鲜味氨基酸总量小于冰温发酵鲜味氨基酸总量;冰温发酵过程中总氨基酸含量在第15天达到最高值757.85 mg/100g,10 ℃发酵过程中总氨基酸含量在第3天达到最高值579.44 mg/100g,有显著性差异(P<0.05),由以上分析可知,冰温发酵鳜鱼能够明显增加鱼肉中总游离氨基酸含量和鲜味氨基酸含量,提升鳜鱼的滋味。
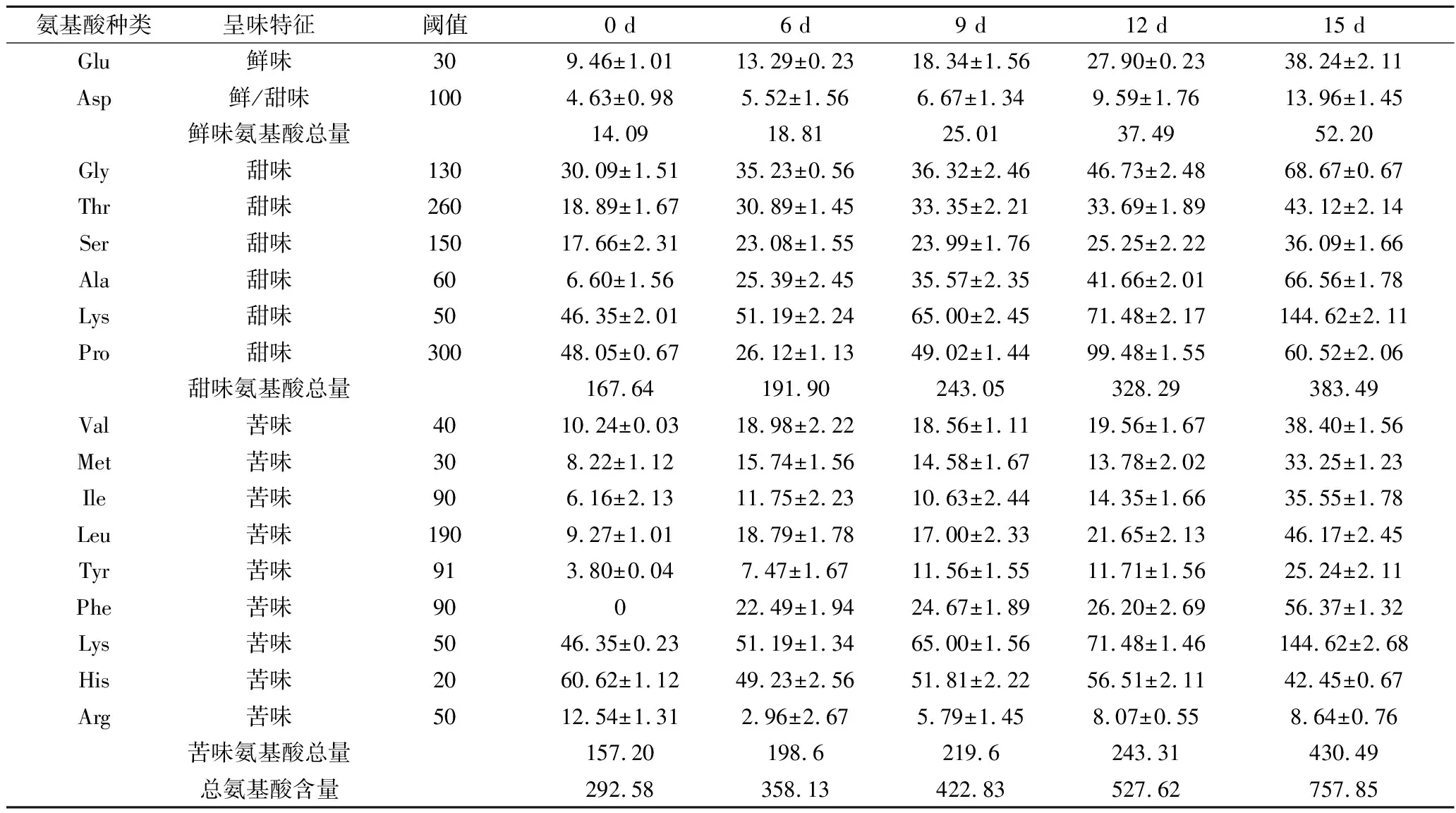
表1 鳜鱼冰温发酵过程中游离氨基酸含量的变化 单位:mg/100g
2.2 呈味核苷酸及EUC的变化
发酵过程中AMP、IMP和肌苷(inosine,HxR)含量具体变化见图1。AMP、IMP和HxR是鳜鱼发酵过程中主要的呈味核苷酸,IMP是最主要的呈鲜味氨基酸,AMP具有甜味、鲜味等品质,并且与Asp、Glu等会产生协同作用,呈现更强烈的鲜味[18-19],HxR具有苦味,是ATP降解的最终产物之一。由图1可知,冰温发酵第15天鱼肉中IMP含量为43.58 mg/100g,10 ℃发酵4 d鱼肉中IMP含量为26.11 mg/100g,有显著差异(P<0.05),IMP的阈值为25 mg/100g,在冰温发酵过程中,IMP含量始终大于阈值,所以,整个发酵过程中IMP始终对滋味起着重要贡献作用。虽然HxR对鱼肉滋味有负面作用,但发酵鳜鱼成品中的游离氨基酸、短链肽以及其他呈味核苷酸会掩盖弱化苦味,优化鱼肉滋味品质。
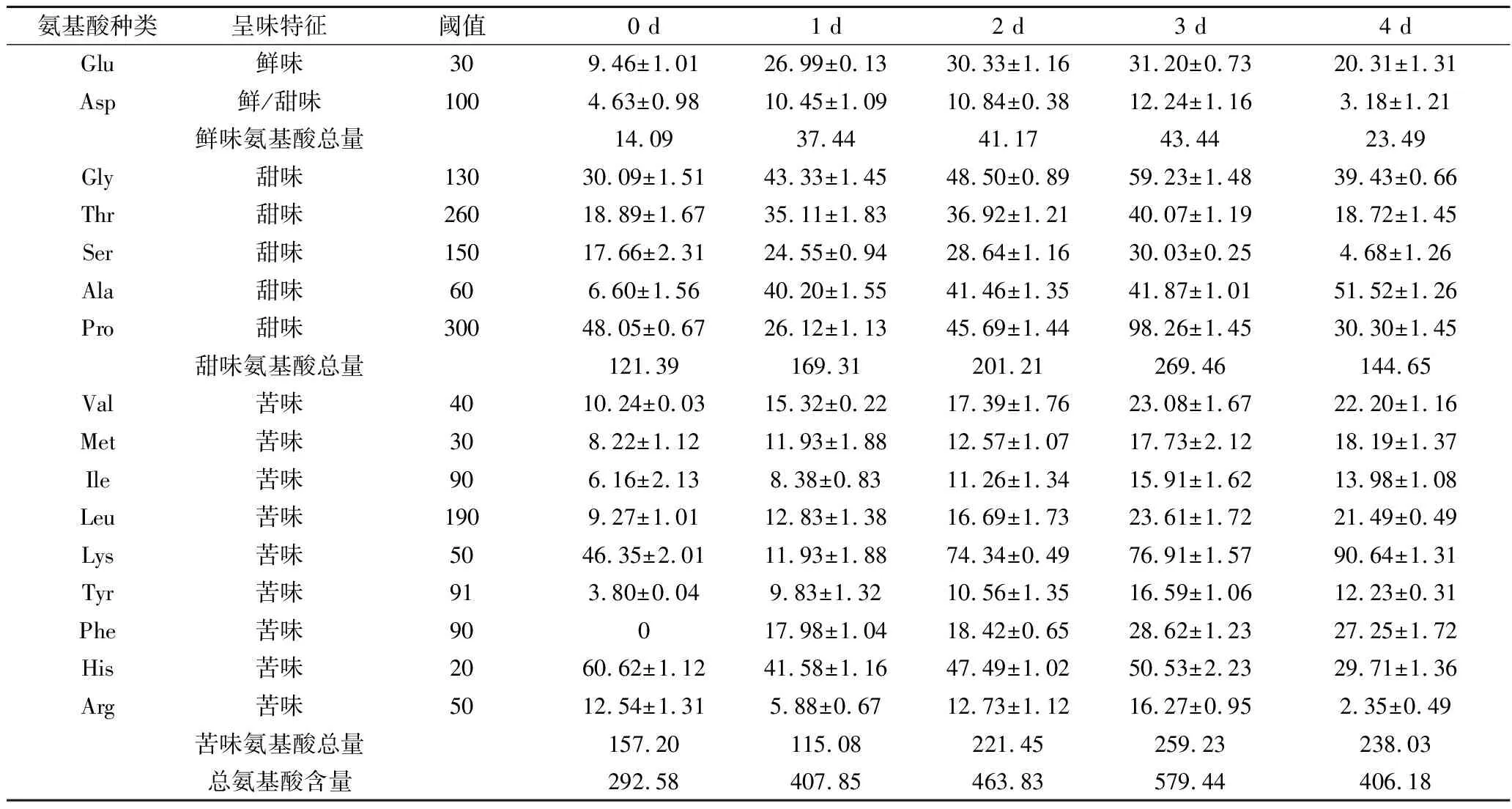
表2 鳜鱼10 ℃发酵过程中游离氨基酸含量的变化 单位:mg/100g
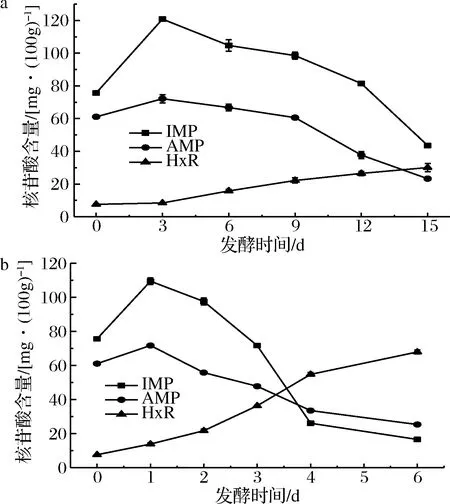
a-冰温发酵;b-10 ℃发酵图1 发酵过程中呈味核苷酸含量变化Fig.1 Changes of flavor nucleotide contents
呈味氨基酸和鲜味氨基酸协同作用具有增鲜效果,根据表3中数据可以看出,EUC随着发酵过程呈现先升高后降低的趋势,2组发酵鱼肉中的EUC均比新鲜鱼肉要高,冰温发酵15 d EUC达到最高值4.31 g MSG/100g,10 ℃发酵在第3天达到最高值3.52 g MSG/100g,随后显著降低。因此,冰温发酵相对于10 ℃发酵能够更好地提升鱼肉鲜味。
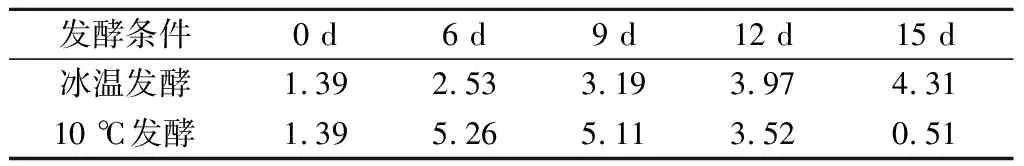
表3 鳜鱼发酵过程中EUC的变化 单位:g MSG/100g
2.3 生物胺含量的变化
冰温和10 ℃ 发酵过程中生物胺含量变化如表4所示,对新鲜鳜鱼进行生物胺含量的检测得到其中组胺含量为10.95 mg/kg,酪胺含量为0.30 mg/kg,精胺1.47 mg/kg,其他生物胺均未检测出,总胺含量为12.73 mg/kg。
2.4 pH和微生物的变化
随着发酵时间的增长,内源性和外源性氨基酸脱羧酶作用于游离氨基酸上形成生物胺[11]。由表4可知,冰温条件下,发酵到第15天时腐胺和尸胺含量由0分别增加到1.71、6.04 mg/kg,而10 ℃条件下发酵4 d,腐胺和尸胺含量分别达到25.66、8.96 mg/kg,两者差异极显著(P<0.01)。冰温发酵时,组胺、酪胺和精胺积累量也都随着发酵的进行显著增加(P<0.05),最终含量分别为22.16、31.65、10.39 mg/kg,β-苯乙胺积累量较少,仅为0.06 mg/kg;10 ℃发酵时,组胺、酪胺和精胺积累量同样也随着发酵进行显著增加(P<0.05),最终含量分别为21.33、21.45、17.56、0.41 mg/kg。冰温发酵6 d与10 ℃发酵2 d时的组胺含量无显著性差异(P>0.05)。2种不同发酵温度下,鳜鱼中生物按总累积量差异极其显著(P<0.01),冰温条件下的总胺含量为72.01 mg/kg,10 ℃条件下的总胺含量为95.36 mg/kg。根据标准,限定人体摄入组胺和酪胺的含量不超过50 mg/kg,酪胺和苯乙胺含量不得超过100~800和30 mg/kg[9],食品中生物胺的总量超过1 000 mg/kg,将诱发人体中毒[11],该2组实验组中生物胺含量均未超过该标准。
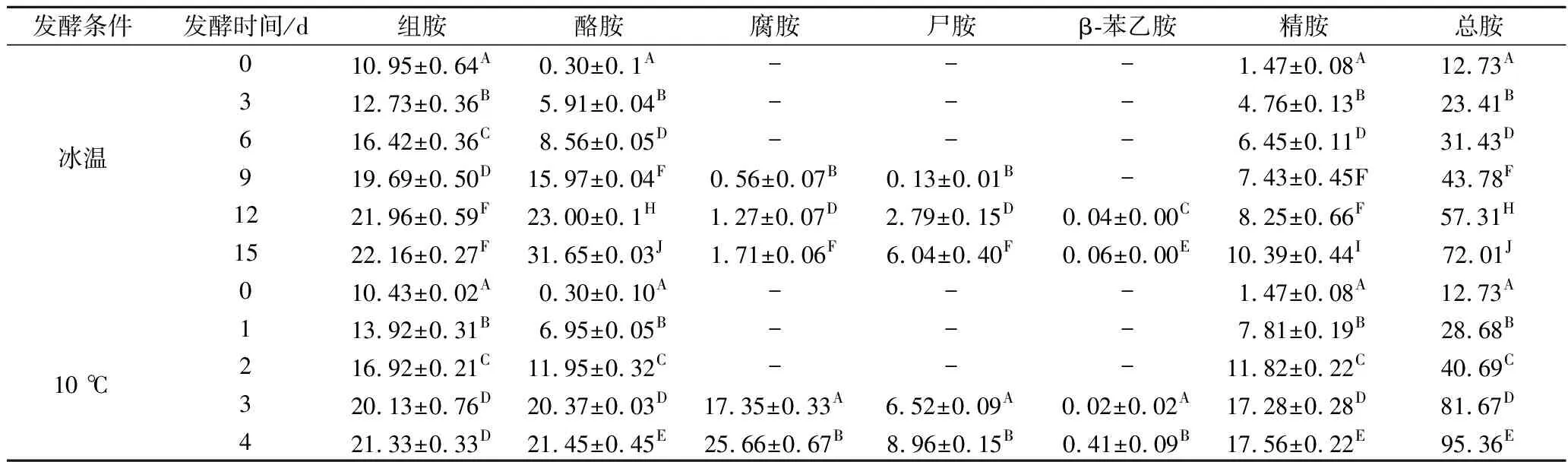
表4 鳜鱼发酵过程中生物胺含量的变化 单位:mg/kg
pH可反映鱼肉品质变化导致的酸碱程度的变化和蛋白质降解的变化[20]。由图2可知,新鲜鳜鱼的pH为6.90,随着发酵的进行,冰温条件下pH最终降为6.73,10 ℃条件下pH最终降为6.63,pH的降低有利于乳酸菌和酵母菌的生长,促进发酵,虽然此时的pH不是其最适生长温度,但是在此pH环境下酵母菌和乳酸菌仍能够生长繁殖。
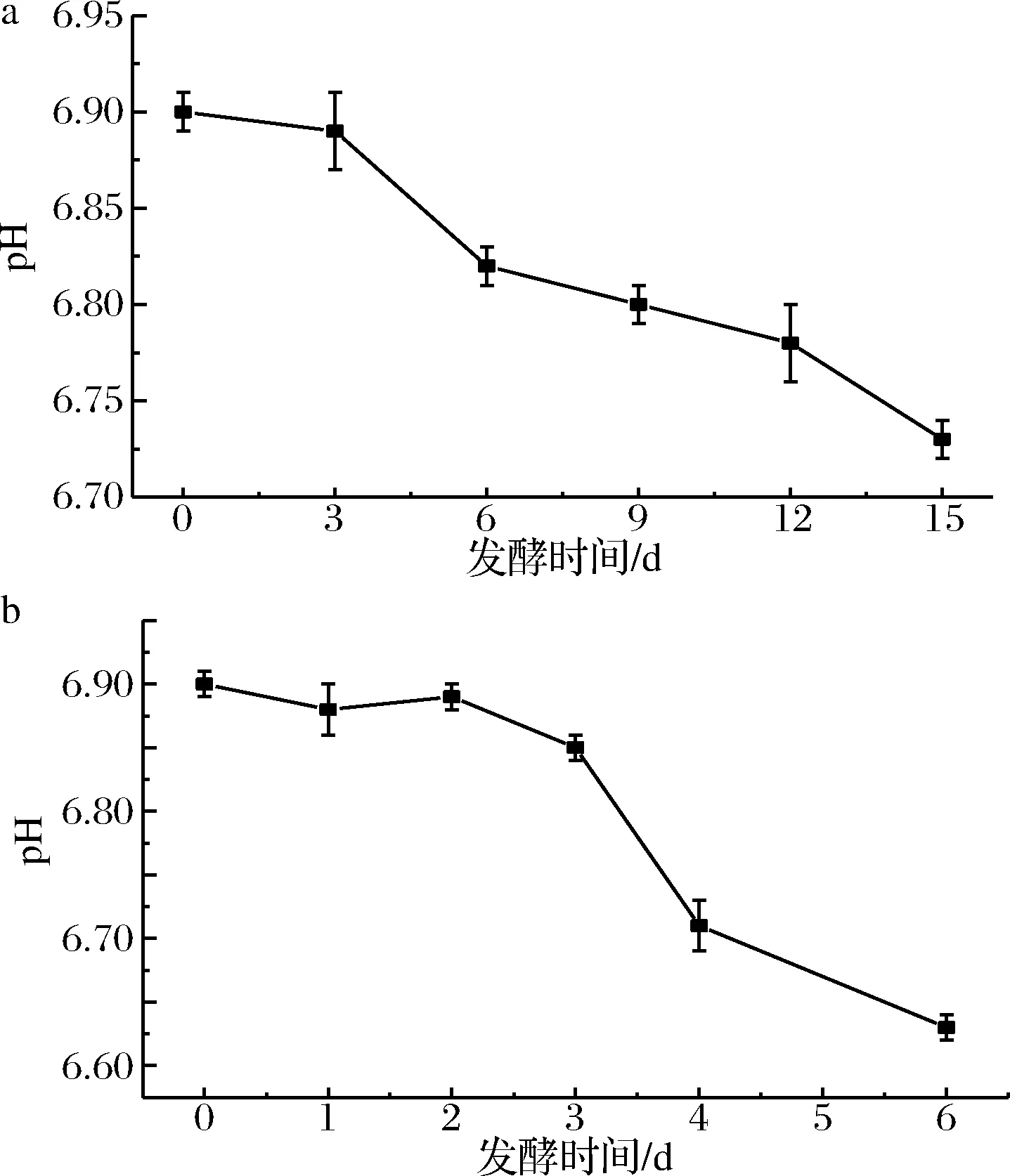
a-冰温发酵;b-10 ℃发酵图2 发酵过程中pH 变化Fig.2 pH changes during fermentation
由图3可知,新鲜鳜鱼中微生物含量很低,菌落总数为4.18 lgCFU/g,在不同发酵温度下,整个过程中各类微生物含量均呈现上升趋势,10 ℃发酵第4天的菌落总数最终达到7.46 lgCFU/g,而冰温发酵第15天的菌落总数仅为6.12 lgCFU/g,可见低温抑制了微生物的生长(P<0.05)。对发酵起决定性作用的乳酸菌和酵母菌含量在10 ℃第4天和冰温第15天分别为5.71、5.63 lgCFU/g和5.29、5.03 lgCFU/g,说明虽然低温抑制了微生物的生长,但仍有耐低温的乳酸菌和酵母菌能在冰温条件下生长繁殖。

a-冰温发酵;b-10 ℃发酵图3 冰温发酵过程中微生物数量变化Fig.3 Changes in the number of microorganisms during fermentation
2.5 TVB-N的变化
TVB-N值可反映蛋白质分解而产生的氨以及胺类等碱性含氮物质,从而反映水产品品质的变化[21]。由图4可知,新鲜鳜鱼中TVB-N含量为8.87 mg N/100g,随着发酵的进行,2组鱼肉中TVB-N的含量均显著提高(P<0.05),冰温发酵鱼肉在第15天时TVB-N含量达到20.15 mg N/100g,10 ℃发酵至第4天时其含量为29.32 mg N/100g,未超过鱼类产品含量中TVB-N含量的上限(30 mg N/100g)。

a-冰温发酵;b-10 ℃发酵图4 发酵过程中TVB-N变化Fig.4 TVB-N changes during fermentation
3 讨论
LEI等[22]和MADEJSK等[23]的研究表明温度是影响发酵食品中生物胺的一个重要因素,同时,冰温也是维持水产品良好滋味的温度带,在冰温带对鳜鱼进行发酵,不仅能够明显降低鱼肉中生物胺的含量,还可以显著提高鱼肉的品质和滋味。本实验通过对游离氨基酸、呈味核苷酸的研究,得到冰温发酵鳜鱼中鲜味氨基酸含量是10 ℃发酵的2倍,因此,冰温发酵鳜鱼的滋味明显优于10 ℃发酵。新鲜鳜鱼在发酵过程中,由于自身微生物和蛋白酶的作用,大分子蛋白被降解为小分子肽和游离氨基酸,根据上述讨论,冰温能够减少游离氨基酸向生物胺的转化从而增加了鲜味氨基酸含量。不仅如此,冰温还会影响ATP的降解过程,ATP的降解主要是由于磷酸化酶、组织蛋白酶等酶类以及微生物作用,发酵过程中,鱼体内的ATP降解为IMP,IMP再降解为HxR和次黄嘌呤,实验结果表明冰温发酵第15天的IMP含量是10 ℃发酵第4天的2倍,与蒋晨毓等[24]在研究中得出冰温能够延长IMP的积蓄时间,减缓IMP的进一步分解这一结论相一致。因此,冰温发酵鳜鱼能够提高鲜味核苷酸含量以及EUC,赋予发酵鱼肉更好的滋味。
水产品产生生物胺主要有3个方面的原因,一是产生具有氨基酸脱羧活性的微生物,二是足量的游离氨基酸,三是适合微生物的生长繁殖以及适合合成氨基酸脱羧酶的理化条件[25-26]。游离氨基酸不仅是发酵水产品生产生物胺的重要前体物质,而且为水产品中微生物的生长繁殖提供了重要能源。新鲜水产品中的生物胺含量较低,随着发酵的进行,在微生物以及酶的作用下生物胺含量不断增长。温度是影响微生物和酶作用的一个重要因素。根据实验结果,冰温发酵第9天微生物含量显著上升,而生物胺含量也是在第9天增加明显,开始产生尸胺、腐胺和β-苯乙胺,10 ℃发酵在第3天开始呈现相同的规律。由此可知,一方面,冰温能够抑制微生物的生长,鱼肉中氨基酸脱羧酶和蛋白质降解酶含量下降,从而减少了生物胺含量,结合pH值的分析,没达到其最适pH也可能是微生物生长缓慢的因素;另一方面,冰温发酵过程中产生的氨基酸未能经脱羧作用转化成生物胺,不仅降低了生物胺含量,同时也增加了鲜味氨基酸含量。这与WANG等[27]在探究大黄鱼生物胺与游离氨基酸的关系时得出的结论一致。

