微生物光电还原CO2合成乙酸对外电压的响应机制
周美洲,骆海萍*,曾翠平,刘广立,张仁铎
微生物光电还原CO2合成乙酸对外电压的响应机制
周美洲1,骆海萍1*,曾翠平2,刘广立1,张仁铎1
(1.中山大学环境科学与工程学院,广东省环境污染控制与修复技术重点实验室,广东 广州 510006;2.深圳合成生物学创新研究院,中国科学院深圳先进技术研究院,广东 深圳 518055)
以TiO2光阳极结合自养型生物阴极,构建双室微生物光电合成(MPES)系统,以光能作为主要的能量来源,探究MPES还原CO2合成乙酸的性能及其限制因素.结果表明,光阳极取代纯电化学阳极显著降低了MPES生物阴极对外电压的需求.MPES能持续稳定运行,平均产乙酸速率为(1.18 ±0.11)mmol/(L·d),法拉第效率为45.75%±3.97%.光阳极驱动阴极产生氢气,推测阴极微生物倾向于利用氢转移的方式来进行电子传递.外加电压通过影响光阳极的给电子能力从而对MPES的性能产生显著的影响,当外电压从0.4V升高至0.6V时,MPES的电流,乙酸产量和法拉第效率都显著提高,系统的性能主要受限于阳极.当外电压高于0.6V,系统电流,乙酸产量的增速减缓,法拉第效率在外加电压0.8V时达到最大值,随后下降,表明生物阴极的得电子能力已经达到饱和,此时MPES的性能主要受限于阴极.作为电子传递中间体,H2的不完全利用是法拉第效率没有随着外电压的增加进一步提升的原因.
微生物电合成(MES);光阳极;生物阴极;产乙酸;外电压
在生物电化学系统中,以电能驱动微生物还原CO2合成有机化合物的过程又被称为微生物电合成(MES)[1-2].在MES系统中,阴极微生物以无机碳如CO2作为唯一的碳源,以来自外电路的电子作为能量来源来合成有机物,如甲烷、乙酸、丙酸、丁酸以及一些醇类物质[3-4].乙酸是微生物电合成系统还原CO2的一种常见产物,作为一种液体燃料,更容易储存和运输,是一种重要的生产原料[5-6].由于能够去除大气中的CO2,减缓温室效应,同时回收CO2, MES被认为是一项环境友好型的技术[7].
由于CO2的热力学惰性,MES系统通常需要输入外电能来驱动电子流向阴极.阳极发生水的氧化,理论上需要1.23V,但是由于存在能量损耗,通常需要1.7~3.5V[8].与纯电化学阳极相比,以半导体材料构建光阳极来捕获光能,能大大降低对外电压的需求.而且,光能属于一次能源,电能属于二次能源,以光能替代电能,直接利用光能,能进一步减少能量损失,从而提高能量的利用效率.Liu等[9]在p-Si光阴极上富集纯菌,成功实现对光能的捕获,并且在的作用下将CO2还原成乙酸.Bian等[10]以氟掺杂氧化锡(FTO)负载光催化剂BiVO4/Mo作为光阳极捕获光能,在外加电压3V的作用下,系统连续运行7d,产生了6.42mmol/L的乙酸.但是,考虑到微生物光电合成(MPES)系统的实际应用,必须同时兼顾光催化材料的成本,稳定性以及光催化对微生物的毒害性.与其他半导体材料相比,TiO2由于具有合适的能带结构,非常适合用来做阳极,而且它还具有容易合成、稳定、无毒、价格低廉的优点[11-14].
本研究制备TiO2光阳极,结合自养型生物阴极,构建双室的MPES系统,探讨MPES系统回收CO2合成乙酸的性能,探讨影响MPES系统性能的因素,以期为实现人工光合作用固碳产能提参考.
1 材料与方法
1.1 TiO2光阳极的制备及表征
1.1.1 TiO2光阳极的制备 圆形的FTO导电玻璃(7Ω/m2;直径:34mm;厚度:2.2mm)用作TiO2的载体,在使用前用水,丙酮和异丙醇(//=1:1:1)超声清洗30min.根据水热法[15]合成TiO2纳米阵,将40mL纯水+40mL浓盐酸(质量浓度:36.5%~38%)充分混匀后,加入1.35mL钛酸丁酯(99%,天津大茂化学试剂有限公司),再次晃匀,将溶液转移至聚四氟乙烯高压反应釜中,然后将清洗好的FTO导电玻璃放入内衬中,使导电面朝上,150℃水热5h,至反应釜冷却后取出,用蒸馏水清洗,自然干燥.最后放入马弗炉,在550℃,空气氛围下退火3h,以增强稳定性.
1.1.2 扫描电镜(SEM) 使用扫描电子显微镜(SU8010,日立公司,日本)在3kV的加速电压下,观察制备的TiO2光阳极的表面形貌和横截面形貌.
1.1.3 X-射线衍射(XRD) 使用X-射线衍射仪(UltimaIV,日本理学)在Cu Kα辐射(=0.1540598nm)下表征TiO2光阳极的晶体结构.
1.1.4 线性伏安扫描 光阳极的光电化学测试在标准三电极体系中进行,0.04mol/LNaOH溶液作为电解液,铂丝电极和饱和甘汞电极(+0.242Vvs.SHE,雷磁232型)分别作为对电极和参比电极,在UV紫外灯(=370nm,=10mW/cm2)的照射下,使用电化学工作站(CHI1000C,上海辰华)对TiO2光阳极进行线性伏安扫描,扫描范围为-0.8~0.8V,扫描速率为5mV/s.
1.2 双室MPES系统的构建
MPES系统由1个双室反应器构成,包括1个阴极室和1个阳极室(6cm×6cm×6cm),所有的反应器均为有机玻璃制成,中间使用阳离子交换膜(CEM,Ultrex CMI-7000,美国)隔开.阴极为碳纤维编制而成的碳刷,使用前在马弗炉中450℃下煅烧30min,以除去表面的杂质[16].阳极为制备的TiO2光阳极,具体构成如图1所示.

图1 MPES系统还原CO2产乙酸示意
1.3 MPES系统的启动与运行
生物阴极室以经驯化的产乙酸混菌作为接种液[17],加入35mL自养培养基[17],阳极以0.04mol/L的NaOH作为电解液.使用UV紫外灯(=370nm,= 10mW/cm2)对阳极照射,外加0.8V低电压以促进光生空穴-电子的有效分离.使用多通路电压数据采集器(Model M2700,module M7708, Keithley Instruments,美国)采集电阻两端的电压.每24h更换新鲜的阳极电解液,阴极室每48h通入纯CO2气体5min,以补充碳源并维持阴极液的pH值在中性范围.以6d为1个周期,第1周期进行阴极液的半替换,以后每6d替换1次阴极液.
反应器成功启动后,待阴极生物膜稳定,将外电压分别调节为0.4,0.6,0.9V,以探讨不同外加电压下MPES系统性能的限制因素.
1.4 分析方法
根据数据采集器采集的定值电阻两端的电压变化,使用公式(1)计算电路中的电流.

式中:是电流, A;是外接定值电阻两端的电压, V;为定值电阻,=10Ω.
阴极液中的乙酸浓度由高效离子色谱 HPIC (CIC-D100,青岛盛瀚色谱技术有限公司)测定,色谱柱为亲水型阴离子色谱柱(SH-AC-4,250mm× 4.6mm,10μm),流动相为(2.0mmol/L Na2CO3+ 10.0mmol/L NaHCO3),流速为1.5mL/min,进样体积为25μL,柱温为35℃,抑制电流为75mA.在反应器运行期间对阴极室产生的气体进行检测,使用气相色谱仪(岛津GC-2014,日本)分析气体的组成.
生物阴极表面附着的微生物的形貌使用场发射扫描电镜(SEM)观察,阴极碳刷首先在2.5%的戊二醛固定液中固定3h,用0.1mol/L的磷酸盐缓冲液进行清洗.然后使用不同浓度的乙醇进行梯度脱水(30%,50%, 70%,90%,100%),最后用叔丁醇浸泡置换,冷冻干燥后,进行喷金处理,最后上机观察.
根据公式(2)计算乙酸产量的法拉第效率(FE):
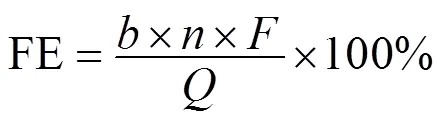
式中:为产生1mol乙酸的电子转移数量,=8;为1个周期内乙酸的累积物质的量,mol;为法拉第常数,=96485C/mol;代表1个周期内流过电路的电荷量, C,对电流和运行时间进行积分[式(3)].
2 结果与讨论
2.1 TiO2光阳极的光电化学分析
SEM图像表明,TiO2纳米棒紧密地生长在FTO玻璃上,平均长度为1.5μm(图2A和2B).图2C表明,与载体FTO玻璃相比,TiO2纳米线阵的衍射峰出现在36.1°,41.2°,62.7°和69.8°,分别对应晶面(101), (111),(002)和(112),表明FTO基底上生长的是金红石型TiO2(JCPDS21-1276).
如图2D所示,TiO2光阳极的起始电位为-0.63V(vs.SCE),并且随着外电势的增加,产生显著的光电流,在开灯-关灯循环操作下,保持稳定的光电响应,说明TiO2光阳极具有良好的光电化学性能.
2.2 MPES系统的性能
如图1所示,UV紫外灯(=370nm,光强= 10mW/cm2)是MPES系统的主要能量来源,为促进光生电子-空穴的有效分离,在阴阳极之间施加弱电压0.8V.如图3A所示,在以0.04mol/L的NaOH作为阳极电解液的条件下,生物-MPES系统产生了连续的电流,24h的平均电流约为0.89mA.黑暗条件下的生物对照组不产生电流,说明系统的电流是由光催化产生的光电流,弱电压0.8V不能驱动MPES系统产生电流.然而,非生物-MPES系统在光照下也能产生与生物-MPES系统相当的电流,仅比生物-MPES系统稍低,但是非生物阴极的电流在24h内的下降速度更快,这是因为TiO2光阳极给出的光电子使得非生物阴极达到产氢电势(表1),溶液中的H+可以作为电子受体从电极获取光电子进行析氢反应[7],从而形成系统电流.而对于生物阴极,除了溶液中的H+,阴极表面附着的电活性微生物也可以直接接受来自电极的电子[18],持续地进行生物催化反应,因此,生物阴极的电流比非生物阴极的电流相对稳定.
如图3B所示,生物-MPES系统在1个周期(6d)内产生的最大乙酸累积量为(7.1±0.68)mmol/L,然而,在以常用的纯电化学阳极材料钛板作为阳极材料构建的纯电化学MES体系中,在相同的操作条件下,外加1.5V电压只能产生微弱的电流(<0.2mA),不足以产生乙酸,只有当外电压升高至2.0V,MES系统的性能才能与MPES系统具有可比性(图3C).因此,从能量输入的角度上来看,相比以纯电化学阳极构建的MES系统,以TiO2光阳极构建的MPES系统能显著降低MES系统对外电压的需求.
以1个周期的电荷量和乙酸累积量进行计算得到MPES系统的法拉第效率为45.75%±3.97%,介于同样以混菌驯化生物阴极的研究的电子回收率(30%~70%)之间[7,19-24],但低于以纯菌驯化的p-Si光阴极[9].这是因为本研究中的接种物是混菌,微生物从阴极表面获得的电子除了用于合成目标产物(本研究为乙酸),还有可能用于产生其他副产物如甲烷[25]、其他小分子有机酸,如丙酸、丁酸等[26],以及用于微生物自身的生长如合成生物质.
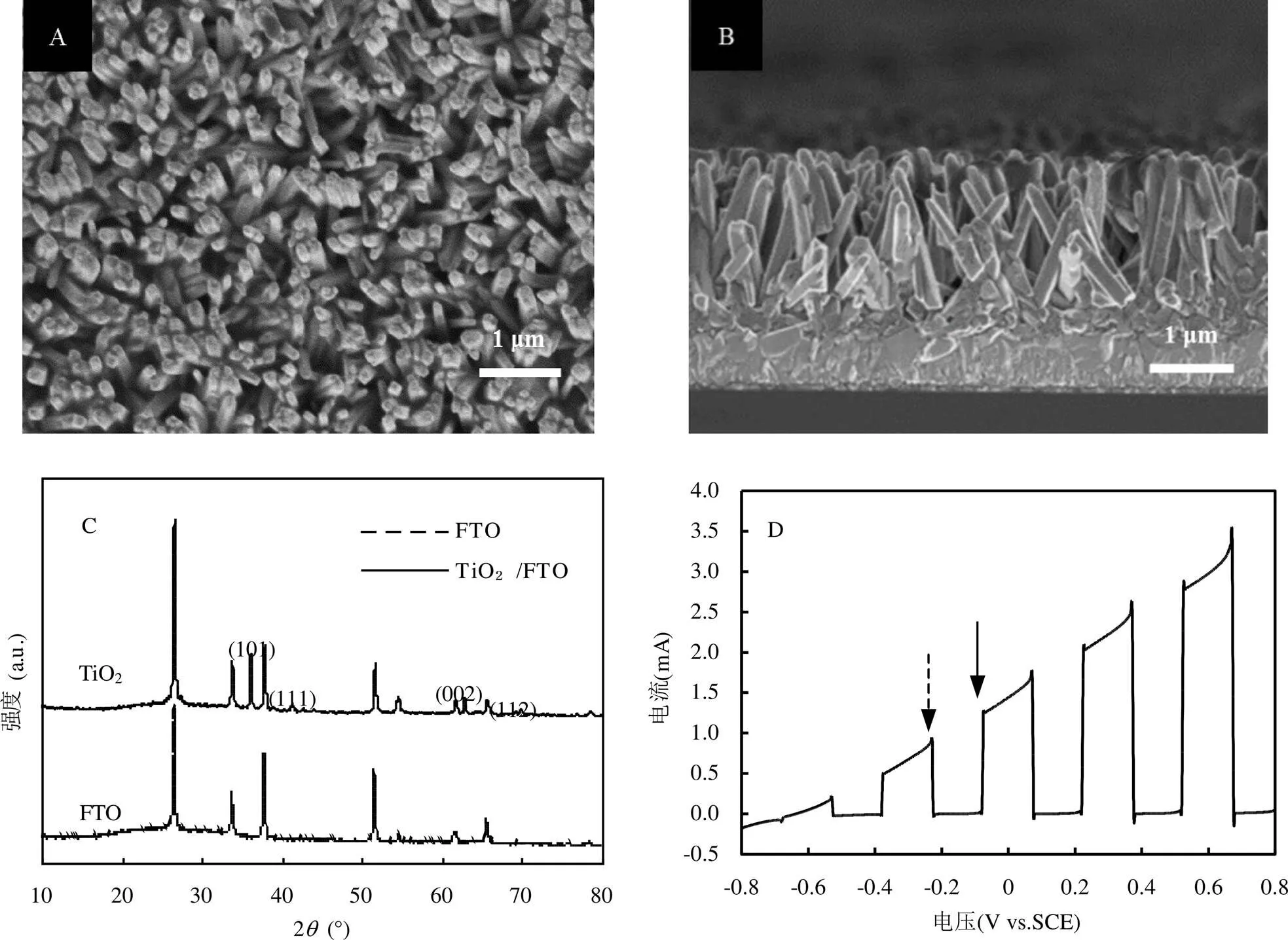
图2 TiO2光阳极的光电化学特性
A和B为TiO2光阳极的SEM图谱(A:俯视;B:侧视);C为TiO2光阳极和FTO载体的XRD图谱;D为TiO2光阳极在开灯-关灯循环下的线性伏安扫描图谱(箭头表示开灯-关灯循环,实线表示开灯,虚线表示关灯)
目前少数研究报道了利用光能来驱动MES系统进行CO2的还原,但多数研究的测试时间都低于1个星期[9-10,27-28],这对于实际应用远远不足(表1).本研究使用的TiO2光阳极可以多次反复利用,在进行CO2还原测试的1个月内,MPES系统表现出稳定的产乙酸性能(图3B),这是因为与其他光催化材料相比,TiO2光阳极具有相当好的稳定性,不容易受到光腐蚀,与其他昂贵的光催化材料相比,TiO2光阳极不仅具有合成方法简单的优点,而且价格低廉,因此能大大降低成本.
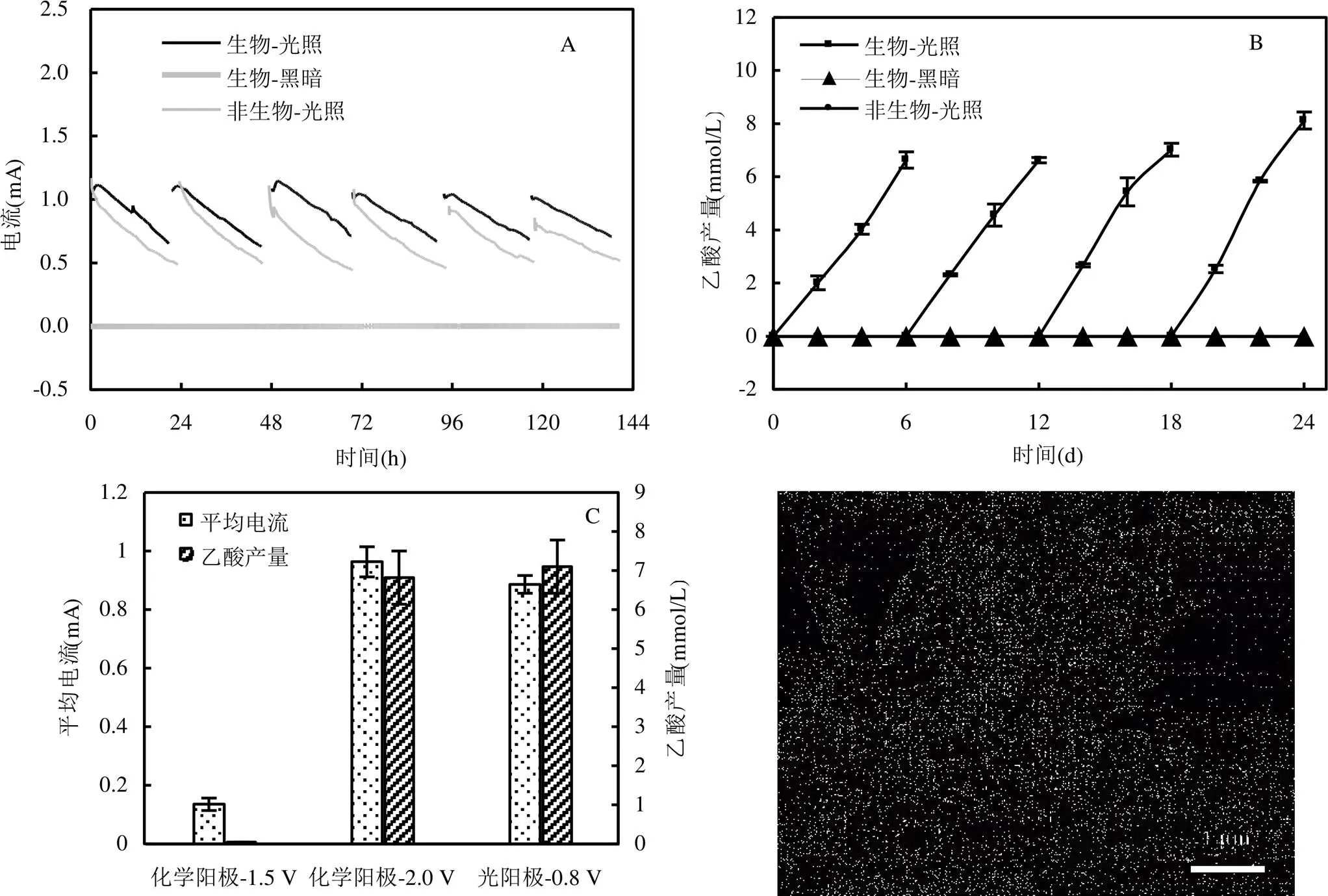
图3 MPES系统生物阴极性能
A为电流;B为乙酸产量;C为化学阳极和光阳极的对比;D为生物阴极的SEM图谱

表1 不同文献MPES系统性能的对比
注:+表示在运行期间有检测到;-表示在运行期间没有检测到.
微生物与电极之间的电子传递途径包括直接电子传递和间接电子传递,直接电子传递是指微生物通过导电菌毛、纳米导线和细胞色素C直接从电极表面获取电子,而间接电子传递是指微生物与电极之间通过电子传递中间体如原位产生的H2以及一些其他小分子物质来进行电子传递[29-31].本研究中非生物-MPES系统也产生了显著的电流(图3A),非生物阴极电势与生物阴极电势相当(表1),并且,在非生物阴极室检测到氢气的产生,但是阴极液中没有检测到乙酸的生成(图3B),说明电极的纯电化学反应产生了H2,但是不能产生乙酸,乙酸是在阴极微生物的作用下生成的.由于CO2的还原反应在热力学上是惰性反应,存在较高的能量壁垒,在没有微生物的作用下难以产生乙酸等多碳化合物[1,32].在生物阴极室中没有检测到H2(反应器内呈现负压),SEM结果表明阴极表面主要富集杆状菌(图3D).根据先前的报道[33],电极表面富集的这种杆状菌主要是能够自养固碳的醋酸杆菌(),能够利用H2作为电子传递媒介从电极获取电子还原CO2合成乙酸.因此,在生物阴极室中没有检测到H2可能是因为H2被微生物消耗了.推测在MPES系统中的阴极微生物倾向于利用氢转移的电子传递途径来获取光电子合成乙酸.
2.3 影响MPES系统性能的限制因素
MPES系统的性能取决于光阳极的给电子能力和生物阴极的得电子能力的平衡[28].由于光催化产生的空穴-电子对容易复合[34],因此,本研究施加低电压以促进光生空穴-电子的有效分离,不同的外加电压会影响光生空穴-电子的分离效率[36],从而影响光阳极的给电子能力,影响MPES系统的性能.
由图4A可以看出,当外电压从0.4V增加至0.6V,MPES系统电流显著上升,提高了2.25倍,但是当外电压从0.6V再次增加时,系统电流的增速变得缓慢,MPES系统电流在外加电压0.8V的条件下比0.6V提高了15.8%,0.9V比0.8V提高了9%,说明系统电流达到饱和.当外电压低于0.6V时,由于外电压过低,不能有效促进光生空穴-电子的分离,从而限制了光阳极的给电子能力.此时,系统的性能主要受限于光阳极.然而,当外电压高于0.6V时,阴极微生物接受电子用于还原CO2的能力已经达到饱和,因此,当外电压进一步升高时,MPES的系统电流并没有得到显著的提高.而阴极电势(图4B)的变化也说明了即使外电压进一步提高,阴极电势也没有出现显著的变化,说明此时影响MPES系统的性能的限制因素由光阳极的给电子能力转变为生物阴极的得电子能力.这可能是因为受到生物阴极有限生物量的影响以及电子在微生物和电极之间传递速度的限制[28,36].当外电压从0.6V增加至0.9V,虽然MPES系统的平均乙酸产量仍在缓慢增加(图4C),而外电压在0.8V时,系统的法拉第效率达到最大值,但是当外电压从0.8V进一步升高至0.9V时,系统的法拉第效率没有继续提升,反而下降(图4D),说明此时阴极的得电子能力和阳极的给电子能力已经达到平衡,再继续增加外电压对于MPES系统效率的提升影响不大.当外电压低于0.8V时,在MPES阴极室没有收集到H2,而当外电压升高至0.9V时,阴极室收集到少量的H2,这说明,在相对高的偏压下,阴极产生的H2作为电子传递媒介,没有被微生物充分利用,从而导致系统法拉第效率的下降.

图4 不同外加电压下MPES的性能
A为不同外电压下光电流对开灯-关灯循环的响应(箭头表示开灯-关灯循环,实线表示开灯,虚线表示关灯);B为生物阴极电势;C为乙酸平均产量;D为法拉第效率
3 结论
3.1 以TiO2光阳极结合自养生物阴极,以光能作为主要能量来源,成功构建能够在低电压下持续稳定将CO2转化为乙酸的MPES系统.
3.2 外电压对MPES系统的性能有显著的影响,当外电压低于0.6V时,MPES系统的性能受限于光阳极,当外电压大于0.6V时,系统的性能受限于阴极.
3.3 MPES系统效率的提升取决于阴极和阳极得失电子能力的平衡.在0.8V时,MPES系统取得最高的法拉第效率,电子传递中间体H2的不完全利用限制了法拉第效率的进一步提升.
[1] Nevin K P, Woodard T L, Franks A E, et al. Microbial electrosynthesis: feeding microbes electricity to convert carbon dioxide and water to multicarbon extracellular organic compounds [J]. mBio., 2010,1(2): e103-e110.
[2] Logan B E, Rossi R, Ragab A, et al. Electroactive microorganisms in bioelectrochemical systems [J]. Nature Reviews Microbiology, 2019, 17(5):307-319.
[3] Saratale R G, Saratale G D, Pugazhendhi A, et al. Microbiome involved in microbial electrochemical systems (MESs): A review [J]. Chemosphere, 2017,177(6):176-188.
[4] 张 尧,张闻杰,蒋 永,等.生物电化学系统固定二氧化碳同时产生乙酸和丁酸[J]. 应用与环境生物学报, 2014,20(2):174-178.
Zhang R, Zhang W, Jiang Y, et al. Simultaneous microbial electrosynthesis of acetate and butyrate from carbon dioxide in bioelectrochemical systems [J]. Chinese Journal of Applied and Environmental Biology, 2014,20(2):174-178.
[5] Chu N, Liang Q, Jiang Y, et al. Microbial electrochemical platform for the production of renewable fuels and chemicals [J]. Biosensors and Bioelectronics, 2020,150(2):111922.
[6] Bajracharya S, Srikanth S, Mohanakrishna G, et al. Biotransformation of carbon dioxide in bioelectrochemical systems: State of the art and future prospects [J]. Journal of Power Sources, 2017,356(7):256-273.
[7] Marshall C W, Ross D E, Fichot E B, et al. Long-term operation of microbial electrosynthesis systems improves acetate production by autotrophic microbiomes [J]. Environmental Science & Technology, 2013,47(11):6023-6029.
[8] Yang Y, Niu S, Han D, et al. Progress in developing metal oxide nanomaterials for photoelectrochemical water splitting [J]. Advanced Energy Materials, 2017,7(19):1-26.
[9] Liu C, Gallagher J J, Sakimoto K K, et al. Nanowire-bacteria hybrids for unassisted solar carbon dioxide fixation to value-added chemicals [J]. Nano Letters, 2015,15(5):3634-3639.
[10] Bian B, Shi L, Katuri K P, et al. Efficient solar-to-acetate conversion from CO2through microbial electrosynthesis coupled with stable photoanode [J]. Applied Energy, 2020,278(10):115684.
[11] Bai Y, Mora-Seró I, De Angelis F, et al. Titanium dioxide nanomaterials for photovoltaic applications [J]. Chemical Reviews, 2014,114(19):10095-10130.
[12] Chen X, Mao S S. Titanium dioxide nanomaterials: Synthesis, properties, modifications, and applications [J]. Chemical Reviews, 2007,107(7):2891-2959.
[13] Luo C, Ren X, Dai Z, et al. Present Perspectives of Advanced Characterization Techniques in TiO2-Based Photocatalysts [J]. ACS Applied Materials & Interfaces, 2017,9(28):23265-23286.
[14] Cheng J, Zhang M, Wu G, et al. Photoelectrocatalytic Reduction of CO2into Chemicals Using Pt-Modified Reduced Graphene Oxide Combined with Pt-Modified TiO2Nanotubes [J]. Environmental Science & Technology, 2014,48(12):7076-7084.
[15] Liu B, Aydil E S. Growth of oriented single-crystalline rutile TiO2nanorods on transparent conducting substrates for dye-sensitized solar cells [J]. Journal of the American Chemical Society, 2009,131(11): 3985-3990.
[16] Hou Y, Luo H, Liu G, et al. Improved hydrogen production in the microbial electrolysis cell by inhibiting methanogenesis using ultraviolet irradiation [J]. Environmental Science & Technology, 2014,48(17):10482-10488.
[17] Xiang Y, Liu G, Zhang R, et al. Acetate production and electron utilization facilitated by sulfate-reducing bacteria in a microbial electrosynthesis system [J]. Bioresource Technology, 2017,241(10): 821-829.
[18] Chiranjeevi P, Patil S A. Strategies for improving the electroactivity and specific metabolic functionality of microorganisms for various microbial electrochemical technologies [J]. Biotechnology Advances, 2020,39(3/4):107468.
[19] Patil S A, Arends J B A, Vanwonterghem I, et al. Selective enrichment establishes a stable performing community for microbial electrosynthesis of acetate from CO2[J]. Environmental Science & Technology, 2015,49(14):8833-8843.
[20] Bajracharya S, ter Heijne A, Dominguez Benetton X, et al. Carbon dioxide reduction by mixed and pure cultures in microbial electrosynthesis using an assembly of graphite felt and stainless steel as a cathode [J]. Bioresource Technology, 2015,195(11):14-24.
[21] Gildemyn S, Verbeeck K, Slabbinck R, et al. Integrated production, extraction, and concentration of acetic acid from CO2through microbial electrosynthesis [J]. Environmental Science & Technology Letters, 2015,2(11):325-328.
[22] Mohanakrishna G, Vanbroekhoven K, Pant D. Imperative role of applied potential and inorganic carbon source on acetate production through microbial electrosynthesis [J]. Journal of CO2Utilization, 2016,15(9):57-64.
[23] Bajracharya S, Yuliasni R, Vanbroekhoven K, et al. Long-term operation of microbial electrosynthesis cell reducing CO2to multi-carbon chemicals with a mixed culture avoiding methanogenesis [J]. Bioelectrochemistry, 2017,113(2):26-34.
[24] Xiang Y, Liu G, Zhang R, et al. High-efficient acetate production from carbon dioxide using a bioanode microbial electrosynthesis system with bipolar membrane [J]. Bioresource Technology, 2017, 233(6):227-235.
[25] Nevin K P, Hensley S A, Franks A E, et al. Electrosynthesis of organic compounds from carbon dioxide is catalyzed by a diversity of acetogenic microorganisms [J]. Applied and Environmental Microbiology, 2011,77(9):2882-2886.
[26] Batlle-Vilanova P, Ganigué R, Ramió-Pujol S, et al. Microbial electrosynthesis of butyrate from carbon dioxide: Production and extraction [J]. Bioelectrochemistry, 2017,117(6):57-64.
[27] Fu Q, Xiao S, Li Z, et al. Hybrid solar-to-methane conversion system with a Faradaic efficiency of up to 96% [J]. Nano Energy, 2018,53(8): 232-239.
[28] Xiao S, Li Z, Fu Q, et al. Hybrid microbial photoelectrochemical system reduces CO2to CH4with 1.28% solar energy conversion efficiency [J]. Chemical Engineering Journal, 2020,390(2):124530.
[29] Tremblay P, Angenent L T, Zhang T. Extracellular electron uptake: among autotrophs and mediated by surfaces [J]. Trends in Biotechnology, 2017,35(4):360-371.
[30] Marshall C W, Ross D E, Handley K M, et al. Metabolic reconstruction and modeling microbial electrosynthesis [J]. Scientific Reports, 2017,7(1):8391.
[31] Kumar A, Hsu L H, Kavanagh P, et al. The ins and outs of microorganism-electrode electron transfer reactions [J]. Nature Reviews Chemistry, 2017,1(3):5181-5192.
[32] Qiao J, Liu Y, Hong F, et al. A review of catalysts for the electroreduction of carbon dioxide to produce low-carbon fuels [J]. Chemical Society reviews, 2013,43(2):631-675.
[33] Luo H, Qi J, Zhou M, et al. Enhanced electron transfer on microbial electrosynthesis biocathode by polypyrrole-coated acetogens [J]. Bioresource Technology, 2020,309(4):123322.
[34] 李明玉,尚 薇,王心乐,等.光电化学协同催化降解甲基橙的研究[J]. 中国环境科学, 2009,29(5):512-517.
Li M, Shang W, Wang X, et al. The degradation of methyl orange with photo-electro-chemical synergistic catalysis system [J]. China Environmental Science, 2009,29(5):512-517.
[35] Irtem E, Hernández-Alonso M D, Parra A, et al. A photoelectrochemical flow cell design for the efficient CO2conversion to fuels [J]. Electrochimica Acta, 2017,240(6):225-230.
[36] Fu Q, Kuramochi Y, Fukushima N, et al. Bioelectrochemical analyses of the development of a thermophilic biocathode catalyzing electromethanogenesis [J]. Environmental Science & Technology, 2015,49(2):1225-1232.
Microbial photoelectric reduction of CO2to acetate and its response mechanism to external applied voltage.
ZHOU Mei-zhou1, LUO Hai-ping1*, ZENG Cui-ping2, LIU Guang-li1, ZHANG Ren-duo1
(1.Guangdong Provincial Key Laboratory of Environmental Pollution Control and Remediation Technology, School of Environmental Science and Engineering, Sun Yat-sen University, Guangzhou 510006, China;2.Shenzhen Institute of Synthetic Biology, Shenzhen Institute of Advanced Technology, Chinese Academy of Sciences, Shenzhen 518055, China)., 2022,42(2):907~913
For evaluating the performance of microbial photoelectric synthesis (MPES) to reduce CO2to synthesize acetic acid and its limiting factors, this study tried to construct a novel double-chamber microbial photo-electrosynthesis system (MPES)by coupling TiO2photoanode with biocathode and using solar energy as main energy. The replacement of pure electrochemical anodes by photoanodes significantly reduced the external voltage requirements of MPES biocathodes, and MPES could continue to operate stably, with an average acetic acid production rate of (1.18 ± 0.11) mmol/(L·d) and a Faraday efficiency of 45.75% ± 3.97%. The photoanode drives the cathode to produce hydrogen, suggesting that the cathodic microorganisms tend to use H2-mediated electron transfer. The external voltage influenced the performance of the MPES significantly by affecting the electron donating ability of the photoanode. When the external voltage was increased from 0.4~0.6V, the MPES current, acetate production and Faraday efficiency were significantly improved, and the performance of the MPES was mainly limited by the photoanode. When the external voltage was higher than 0.6V, the system current and the output of acetic acid increased mildly, and Faraday efficiency reached the maximum value at 0.8V, and then declined, indicating that the electron-acceptting ability of biocathode was saturated at 0.8V and the performance of the MPES was mainly limited by the biocathode. As an electron intermiate, H2was incompletely utilized during the operation of MPES, explaining why the Faraday efficiency was not further improved with an increase in external voltage.
microbial electrosynthesis system ( MES);photoanode;biocathode;acetate production;applied voltage
X703.1
A
1000-6923(2022)02-0907-07
周美洲(1996-),女,广东茂名人,中山大学硕士研究生,主要研究方向为水土环境污染修复.
2021-05-28
国家自然科学基金资助(42077286);中央高校基本科研业务费重点培育项目(19lgzd27);国家重点研发计划(2017YFB0903703)
* 责任作者, 副教授, luohp5@mail.sysu.edu.cn

