Fe3O4活化过硫酸盐体系同步去除诺氟沙星和铅
苏冰琴,刘一清,林昱廷,王 健,权晓慧,李 瑞,芮创学
Fe3O4活化过硫酸盐体系同步去除诺氟沙星和铅
苏冰琴1,2*,刘一清1,2,林昱廷3,王 健1,2,权晓慧1,2,李 瑞1,芮创学4
(1.太原理工大学环境科学与工程学院,山西 太原 030024;2.山西省市政工程研究生教育创新中心,山西 太原 030024;3.太原科技大学环境科学与工程学院,山西 太原 030024;4.山西嘉宝源科技有限公司,山西 太原 030006)
采用Fe3O4活化过硫酸盐(PS)同步去除水中的NOR(诺氟沙星)和Pb(II).探讨了Fe3O4投加量、PS浓度、初始pH值和Pb(II)浓度对NOR降解的影响.结果表明,NOR的降解符合伪一级反应动力学,在温度为30℃、NOR初始浓度为5.0mg/L、Pb(II)浓度为1.0mg/L、Fe3O4投加量为2.0g/L、PS浓度为1.5mmol/L、初始pH值为7.0的条件下,反应120min后,NOR降解率达90.2%,Pb(II)去除率为99.5%.自由基淬灭实验证实,硫酸根自由基(SO4-∙)是NOR降解的主要自由基.通过LC-MS分析结果推测了NOR可能的降解路径和中间产物.Fe3O4活化PS高级氧化工艺可作为一种同步去除有机污染物和重金属的工艺.
诺氟沙星;铅;Fe3O4磁性纳米颗粒;过硫酸盐;同步去除
共存于水环境中的抗生素和重金属,由于其综合毒性和相对流动性,对水体环境和人类健康造成更严重的危害[1-2].诺氟沙星(NOR)作为一种典型的抗生素药物,由于其抗菌谱广、抗菌作用强等优点被广泛应用于治疗肠炎、痢疾等疾病[3-4].残存在环境中的NOR降解性能差,在我国水环境检测中,NOR最高含量可达300ng/L[5],可通过食物链富集或者诱发细菌耐药性,对人类健康和整个水生态系统构成潜在的危害.另一方面,随着工业废水的排放,使水环境受到重金属污染,如冶金、染料、陶瓷、橡胶生产等工业废水中含有重金属铅.Pb(II)具有高毒性,只要有微量甚至痕量即可产生毒性效应[6],铅中毒后会危害神经、心血管、肾脏和免疫系统[7],且儿童发生铅中毒的机会远远超过成年人.
目前处理抗生素废水的传统方法有物理吸附、生物降解、膜处理、化学氧化和高级氧化法等[8-11],去除废水中重金属的传统方法包括化学沉淀、离子交换、膜分离和生物絮凝法等[12].基于过硫酸盐(PS)的高级氧化技术(AOPs)因其具有绿色高效、氧化能力强等特点受到广泛关注[13-14].PS可被过渡金属 (Fe2+、Co2+、Ag+等)[15]、金属氧化物[16]、热[17]、超声[18]、光[19]、碱[20]等活化生成具有较高氧化还原电位的活性自由基(SO4-∙或∙OH),降解水环境中大多数难生物降解有机物和新兴痕量污染物[21].其中,Fe3O4磁性纳米颗粒(MNPs)具有特定结构、较高的催化特性及可重复利用性[22-23],可作为理想的激活PS的催化剂[24-27],且Fe3O4磁性纳米颗粒因其具有比表面积大、分离速度快、吸附能力强,且可以磁性分离的特点[28-29],可以去除环境中多种重金属离子[30-31].
在有机物和重金属的去除过程中,Fe3O4磁性纳米颗粒的作用是一种包括物理化学吸附和活化PS作用在内的综合效应.本研究采用Fe3O4活化过硫酸盐体系同步去除废水中的NOR和Pb(II),探究Fe3O4/PS反应体系去除NOR和Pb(II)的影响因素及反应动力学,确定NOR和Pb(II)同步去除的反应条件,分析去除反应机理及NOR降解的反应途径,为处理抗生素和重金属复合污染废水的工程应用提供技术参考.
1 材料与方法
1.1 试剂和仪器
主要试剂:诺氟沙星(NOR, C16H18FN3O3, 纯度>99%);硝酸铅(Pb(NO3)2)、过硫酸氢钾(PS, KHS2O8)、硫酸亚铁(FeSO4·7H2O)、三氯化铁(FeCl3·6H2O)、碳酸钠(Na2CO3)、氯化钠(NaCl)、硝酸钠(NaNO3)、腐殖酸(HA)、乙醇(EtOH, CH3CH2OH)、叔丁醇(TBA, C(CH3)3OH),氢氧化钠(NaOH)、盐酸(HCl)均为分析纯.实验用水采用去离子水,以消除NOR降解的影响.
主要仪器:THZ-C型恒温振荡器(杭州佑宁仪器有限公司)、Model JY92-IIN超声波清洗机(宁波新芝生物科技股份有限公司)、Agilent 1260高效液相色谱仪(美国安捷伦公司)、DX-2700X射线衍射仪(美国 Thermo Scientific 公司)、HP-6019固相萃取仪 (天津市富城达科技有限公司)、EWAI-AA-7020原子吸收光谱仪(中国东西仪器公司)、FE20-pH计(梅特勒-托利多仪器有限公司)、AUY120分析天平(日本岛津公司)、UV5500紫外可见分光光度计(日本岛津公司)、TOC-VCPH分析测定仪(日本岛津公司).
1.2 Fe3O4制备与表征
采用共沉淀法制备Fe3O4磁性纳米颗粒.称取物质的量之比为2:1的FeSO4·7H2O与FeCl3·6H2O溶解于蒸馏水中,并快速加入到装有一定浓度氨水的三口烧瓶中,全程通入氮气的条件下,200r/min高速搅拌,控制温度为60℃.反应30min后,用磁铁将黑色的Fe3O4磁性纳米颗粒收集,用去离子水反复多次冲洗,直至上清液呈中性,置于真空干燥箱中60℃烘干24h,将其研磨后储存于干燥皿内保存备用.
使用高分辨率扫描电子显微镜(SEM)来观察Fe3O4催化剂的表面形貌,并结合X射线能谱(EDS)分析其元素构成,采用X射线衍射仪(XRD)来表征Fe3O4催化剂的晶相结构.通过比表面积/孔径分布及孔隙分析仪(BET)测试材料的孔径和比表面积;利用傅里叶变换红外光谱(FTIR)确定Fe3O4催化剂的官能团构成;采用X射线光电子能谱(XPS)技术对Fe3O4催化剂反应前后的元素构成进行分析.
1.3 实验流程
将一系列250mL的锥形瓶置于恒温振荡器中,控制温度为30℃,转速为250r/min,进行降解NOR的批量实验.将NOR和适量的Fe3O4催化剂一起快速加入锥形瓶中,搅拌30min,实现吸附-脱附平衡.再将KHS2O8迅速加入反应溶液中,调节pH值,进行反应120min.每隔一定时间从锥形瓶中量取2mL反应液,用0.22μm滤膜过滤,通过高效液相色谱(HPLC)测定其中NOR剩余浓度,计算其降解率.
采用去离子水配制硝酸铅溶液,加入锥形瓶中,进行同时去除NOR和铅的批量实验,每隔一定时间从锥形瓶中量取2mL反应液,用0.45μm滤膜过滤,利用原子吸收分光光度计测定剩余的Pb(II)浓度,计算其去除率.
所有实验都进行3次,结果以平均值和标准偏差的形式表示.
1.4 分析方法
NOR浓度通过Agilent 1260高效液相色谱仪(HPLC)进行检测,采用外标法定量分析.液相色谱柱为Agilent HC-C18(150mm´4.6mm, 5μm),柱温30℃;检测流动相为乙腈:甲酸水溶液(体积分数0.2%)= 20:80 (:);检测波长278nm;流速为0.2mL/min;进样量为10μL. NOR的降解速率采用伪一级反应动力学描述.
Pb(II)浓度采用EWAI-AA-7020原子吸收光谱仪测定.Pb(II)的去除率由方程式(1)计算:
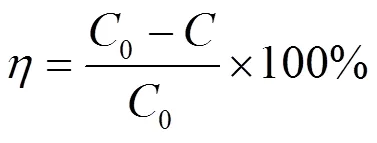
式中:0为Pb(II)的初始浓度,mg/L;为任一反应时刻Pb(II)的剩余浓度,mg/L.
PS的剩余浓度使用稍微修改的分光光度法测定[32].pH值使用便携式FE20-pH计测量.总有机碳(TOC)的变化采用TOC-VCPH总有机碳分析仪测定.
2 结果与讨论
2.1 Fe3O4催化剂的表征
采用扫描电镜可清晰观察到Fe3O4催化剂晶体为均匀的立方体颗粒,粒径约为35~45nm(图1(a)).由纳米Fe3O4的XRD图谱(图1(b))可知,在30.1°、35.4°、43.1°、53.4°、57.0°、62.5°、74.1°处具有较强的衍射峰,与标准Fe3O4(JCPDS PDF#65-3107)所具有的特征衍射峰相吻合,这说明制得的催化剂为纯度较高的Fe3O4.
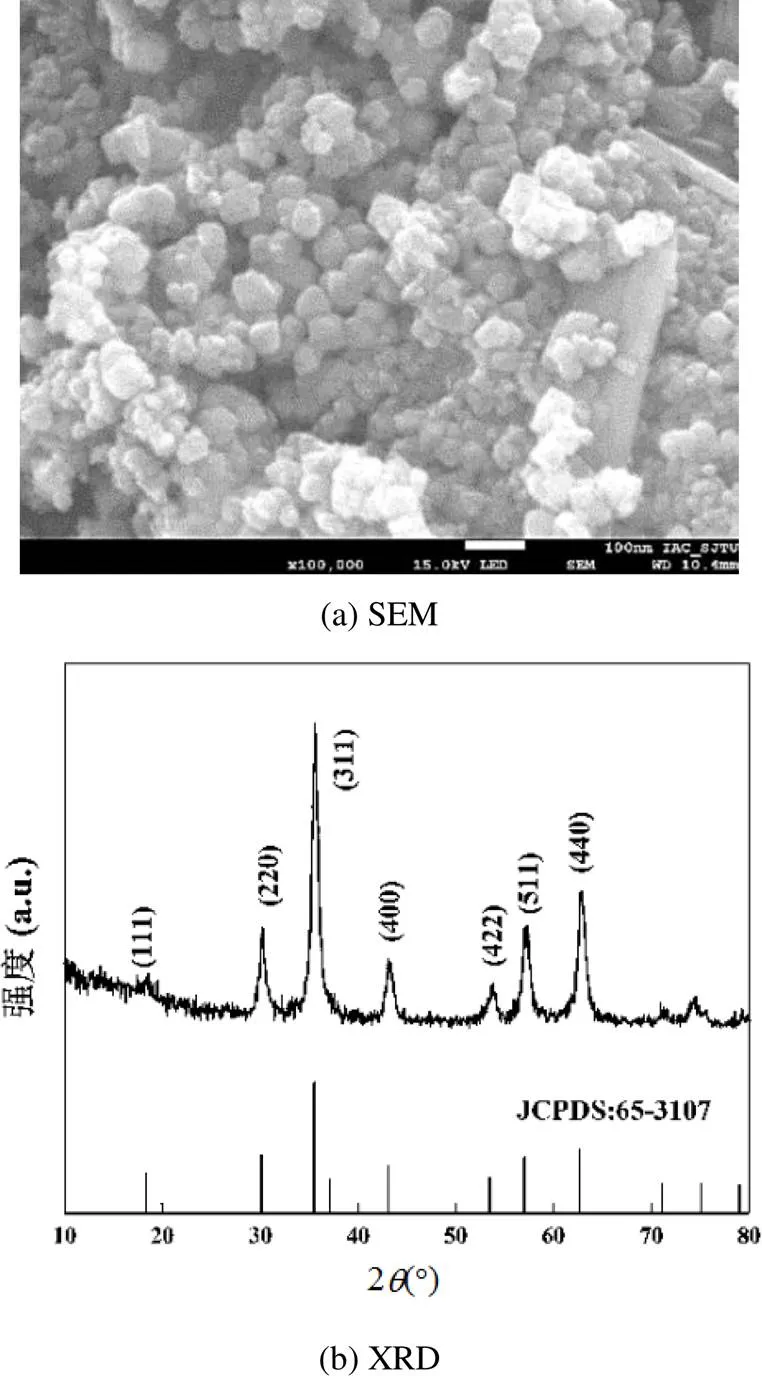
图1 Fe3O4的SEM和XRD图
采用比表面积及孔径分布分析(图2)发现,Fe3O4不完全符合IV型等温线的基本特征,说明Fe3O4属于既有微孔,又有介孔的不同多孔吸附材料.其平均孔径为12.94nm,比表面积为30.82m2/g,总孔容为0.11cm3/g,较小的孔容和较大的比表面积说明Fe3O4可以提供大量的活性反应位点,具有较好的催化反应活性和吸附性能.

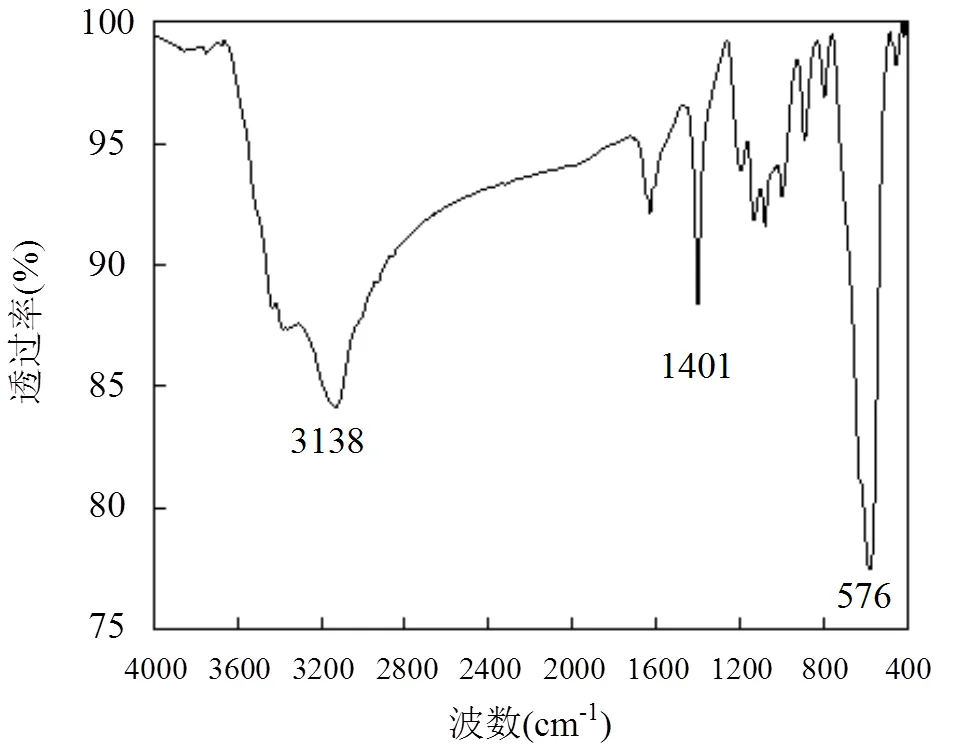
图3 Fe3O4的红外光谱图
由Fe3O4的FT-IR光谱图(图3)可知,在576,1401, 3138cm-1处出现3个较强的吸收峰.其中波长为576cm-1处为Fe—O伸缩振动峰,1401和3338cm-1处分别是H—O—H和O—H的伸缩振动峰.
2.2 Fe3O4/PS体系降解NOR的效果
2.2.1 不同体系对NOR去除效果的比较 由图4所示,体系中Fe3O4和PS单独存在时,NOR很难被直接降解.Fe3O4单独存在时,NOR在60min内的去除率只有10.5%,其去除量可能是由于少量的NOR被吸附在磁性纳米Fe3O4表面所致;PS单独存在时,NOR去除率仅为8.3%,说明PS较稳定,对NOR产生的单独氧化作用较弱.在Fe3O4/PS体系中,NOR的去除率显著提高,60min达到88.2%,这主要是因为Fe3O4催化PS产生SO4-∙,促进NOR被氧化降解,反应如式(2)所示.
S2O82−+ Fe2+→ SO4-∙ + Fe3++ SO42−(2)

图4 Fe3O4、PS和Fe3O4/PS体系中NOR的降解效率
[NOR]=5.0mg/L, [Fe3O4]=2.0g/L, [PS]=1.0mmol/L, pH=7.0,=30℃
2.2.2 Fe3O4投加量的影响 图5表明,Fe3O4活化PS降解NOR的过程符合伪一级反应动力学.随着Fe3O4投加量从0提高到2.0g/L时,NOR在120min时的降解速率常数obs为0.0117min-1,降解率达到93.3%.这主要是因为Fe3O4活化PS产生SO4-∙对NOR进行降解,随着Fe3O4投加量的上升,提供了更多的反应位点,加快了PS被活化的速度.
但当继续提高Fe3O4投加量至3.0g/L时,NOR的降解速率常数obs并未继续升高,反而降至0.0102min-1,NOR降解率也未进一步提高,稳定在90.2%左右.原因可能是因为反应后期随着PS的消耗,剩余的低浓度PS不足以完全利用Fe3O4所提供的反应位点,导致了过高Fe3O4投加量下NOR降解效率以及降解速率常数增速减慢.同时Fe3O4投加量继续加大时,溶液中的催化剂颗粒过多而发生团聚现象,导致比表面积降低,活性位点减少,NOR的降解率被抑制.因此,后续实验采用2.0g/L作为Fe3O4的最佳投加量.
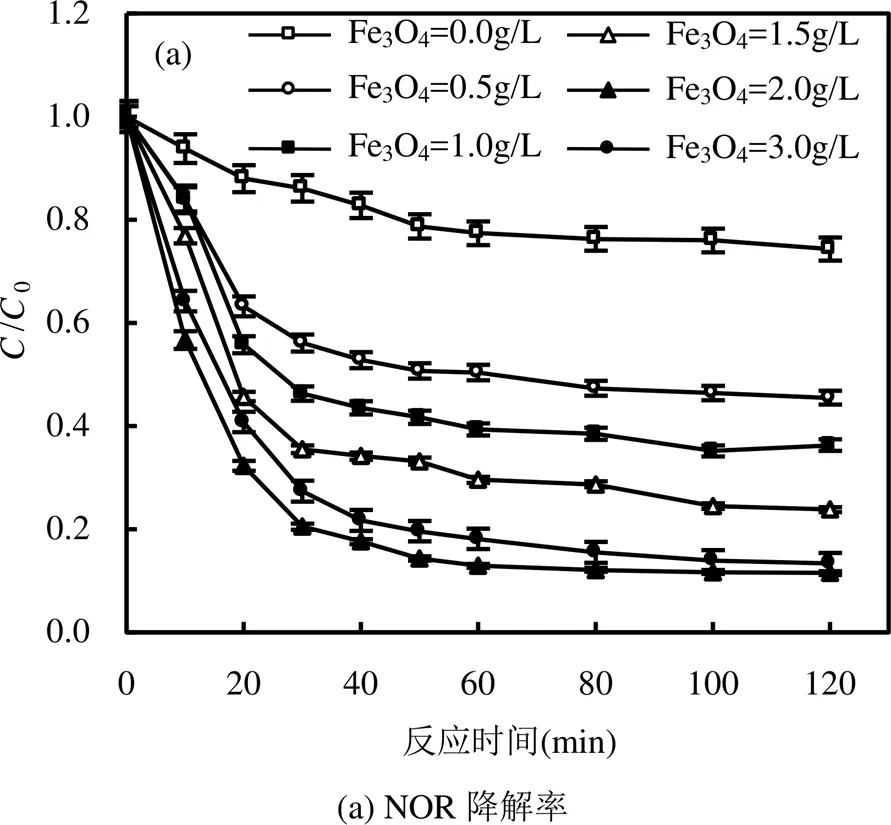
[NOR]=5.0mg/L, [PS]=1.0mmol/L, pH=7.0,=30℃
2.2.3 PS浓度的影响 如图6所示,当PS浓度由0提高至1.5mmol/L 时,NOR的降解率随着PS浓度的提高而迅速提高,反应120min时,NOR的降解速率常数obs为0.0121min-1,其降解率达到94.6%.当提高PS浓度至2.0mmol/L时,NOR的降解速率常数及降解效率无显著提高;继续提高PS浓度至3.0mmol/L时,NOR的降解速率常数obs出现下降趋势,降至0.0098min-1,其降解效率也降至92.2%.
这是因为Fe3O4/PS体系中PS浓度提高时(<1.5mmol/L),会产生更多SO4-∙,有利于NOR被氧化降解.而当PS浓度过高时(>2.0mmol/L),PS被活化所产生的SO4-∙数量不断增多,导致部分自由基发生了自我淬灭[36],反应如式(3)所示;同时溶液中过多的S2O82−也会消耗生成的SO4∙-,并生成氧化能力较弱的S2O8∙−,反应如式(4)所示,因此NOR的降解速率常数及降解效率均有所下降.因此,后续实验中选择1.5mmol/L PS作为对应2.0g/L Fe3O4的最佳浓度.
SO4∙−+ SO4∙−→S2O82-(3)
SO4∙−+ S2O82-→SO42-+ S2O8∙-(4)

[NOR]=5.0mg/L, [Fe3O4]=2.0g/L, pH=7.0,=30℃
2.2.4 pH值的影响 从图7可以看出,溶液初始pH值为3.0时NOR的降解效率最高,达到95.5%.当pH值由3.0升高到7.0时,NOR降解效率基本未发生改变.随着pH值升高至11.0时,NOR的降解效率受到明显抑制,降解速率常数obs从0.0103min-1降至0.0076min-1,NOR降解效率降至53.7%,这主要是因为,在酸性条件下(pH<7.0),NOR会产生质子化效应,使得分子结构中的哌嗪环带有正电,更容易与带负电的SO4-∙发生反应;而当pH值>7.0时,NOR在喹诺酮核的羧基电离,从而分子整体呈现负电荷,不利于其与SO4-∙的反应[37].此外,随着pH值升高,SO4-∙易于水解生成∙OH,反应如式(5)所示,而∙OH的氧化电位低于SO4-∙,降低了NOR的降解率;且在高pH值条件下,表面带负电荷的Fe3O4催化带负电荷的SO4-∙过程由于同性相斥作用受阻.综上,酸性条件有利于NOR的去除,NOR降解在pH=7.0下仍然可行,后期实验选择在中性条件下进行.
SO4∙-+ OH-→ SO42-+ ∙OH (5)
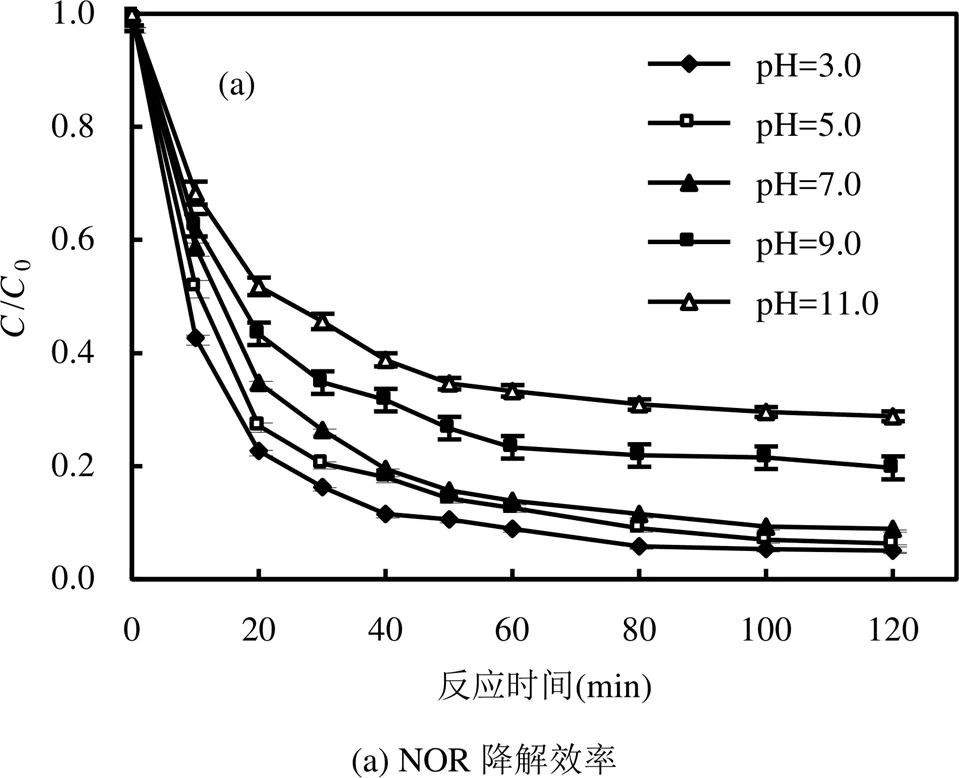
[NOR]=5.0mg/L, [Fe3O4]=2.0g/L, [PS]=1.5mmol/L,=30℃
如图8所示,当溶液初始pH³9.0时,反应过程中pH值逐渐下降,这可能是由于NOR在降解过程中生成了CO2和较低分子质量的有机酸所致;当溶液为中性和酸性(pH=3.0~5.0)时,反应过程中pH值略有增加,但变化并不显著,因为H2CO3是一种弱酸, pa1和pa2分别为6.3和10.3,其释放到溶液中的H+不足以改变溶液的pH值,故溶液中 pH值相对稳定,这与其他研究结果[35-36]相似.
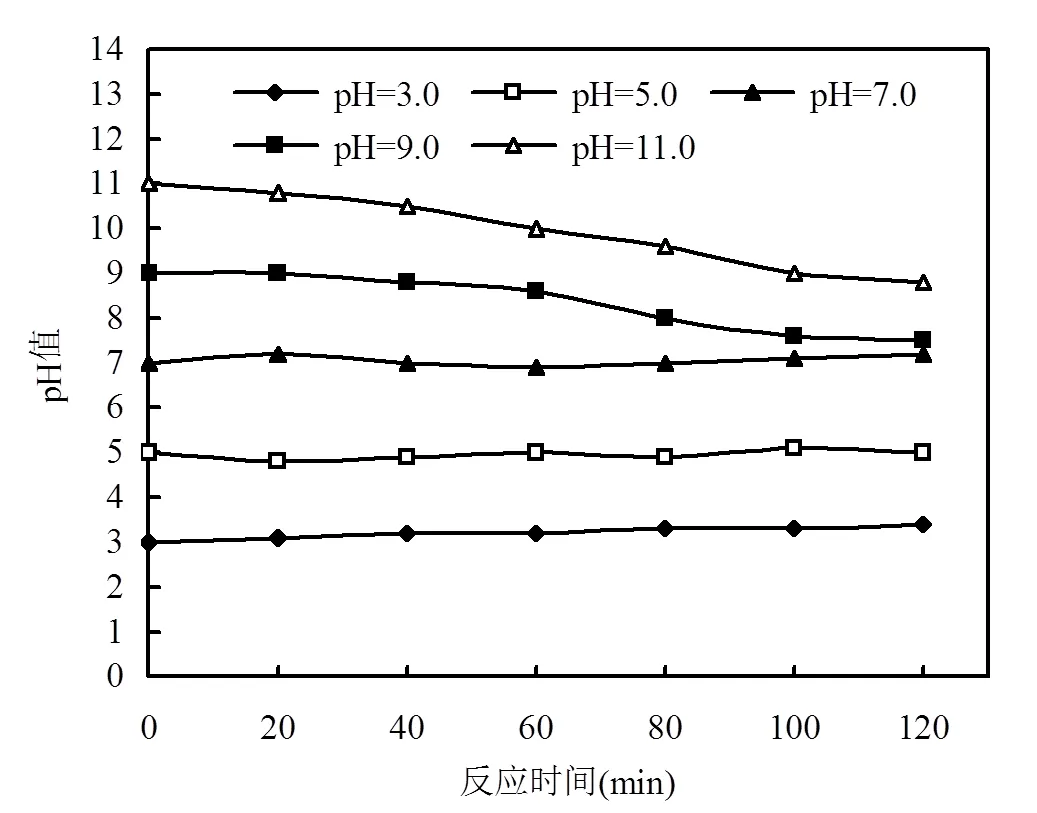
图8 NOR降解反应过程中pH值的变化
2.3 Fe3O4/PS体系对NOR和Pb(II)的同步去除效果
图9显示,Pb(II)抑制了NOR的降解,NOR的去除效率随着初始Pb(II)浓度的增加而降低.Pb(II)浓度为1.0mg/L时,NOR在120min内的去除率为90.2%,而当Pb(II)浓度为2.0mg/L时,NOR在120min内的去除率只有60.8%.NOR的降解反应符合伪一级动力学模型,其降解速率常数随着初始Pb(II)浓度的增加而显著降低.这可能是因为Fe3O4对Pb(II)的吸附作用造成了Fe3O4的氧化性和活性位点降低,从而降低了NOR的降解速率.随着初始Pb(II)浓度的增加,Pb(II)去除量略有下降.
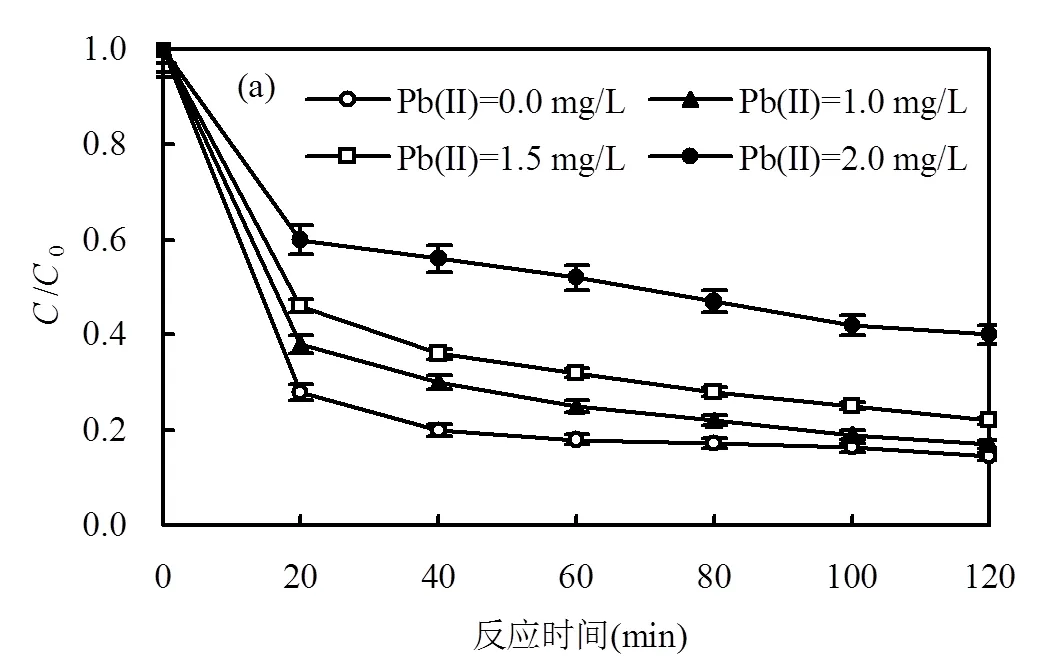
[NOR]=5.0mg/L, [Fe3O4]=2.0g/L, [PS]=1.5mmol/L, [Pb(II)]= 0~2.0mg/L,=30℃
2.4 NOR去除反应机制
2.4.1 自由基淬灭实验 采用甲醇(MeOH)和硝基苯(NB)[34]作为淬灭剂,来鉴定Fe3O4/PS体系中起主导作用的活性自由基,结果如图10所示.当Fe3O4/PS体系中加入MeOH后,对NOR的降解出现明显的抑制作用,NOR的降解效率大幅度下降,说明体系中有SO4-∙和∙OH的存在.而当体系中加入NB作为∙OH的淬灭剂时,对NOR的降解无明显抑制作用,说明体系中∙OH对降解NOR无主要贡献,据此判断体系中起主要氧化作用的是SO4-∙自由基.而当Fe3O4/PS体系中共同存在NOR和Pb时,加入MeOH和NB均对Pb的去除不产生影响,由此判断体系中Pb的去除并不是由Fe3O4活化PS的催化氧化作用来完成.

图10 自由基淬灭剂对NOR降解和Pb(II)去除效率的影响
[NOR]=5.0mg/L, [Pb(II)]=1.0mg/L, [Fe3O4]=2.0g/L, [PS]=1.5mmol/L, pH=7.0,=30℃
2.4.2 总有机碳分析 由图11所示,溶液中TOC随着反应的持续进行而逐渐降低,说明Fe3O4活化PS体系具有优良的矿化能力,反应进行至120min时TOC去除率达到59.6%,与NOR的降解效率90.2%相比,TOC去除反应并未彻底进行,这是因为体系中NOR降解生成了难降解的中间产物,并未完全转化为CO2和H2O等无机物质.

图11 NOR降解和Pb(II)去除过程中的矿化作用
[NOR]=5.0mg/L, [Pb(II)]=1.0mg/L, [Fe3O4]=2.0g/L, [PS]=1.5mmol/L, pH=7.0,=30℃
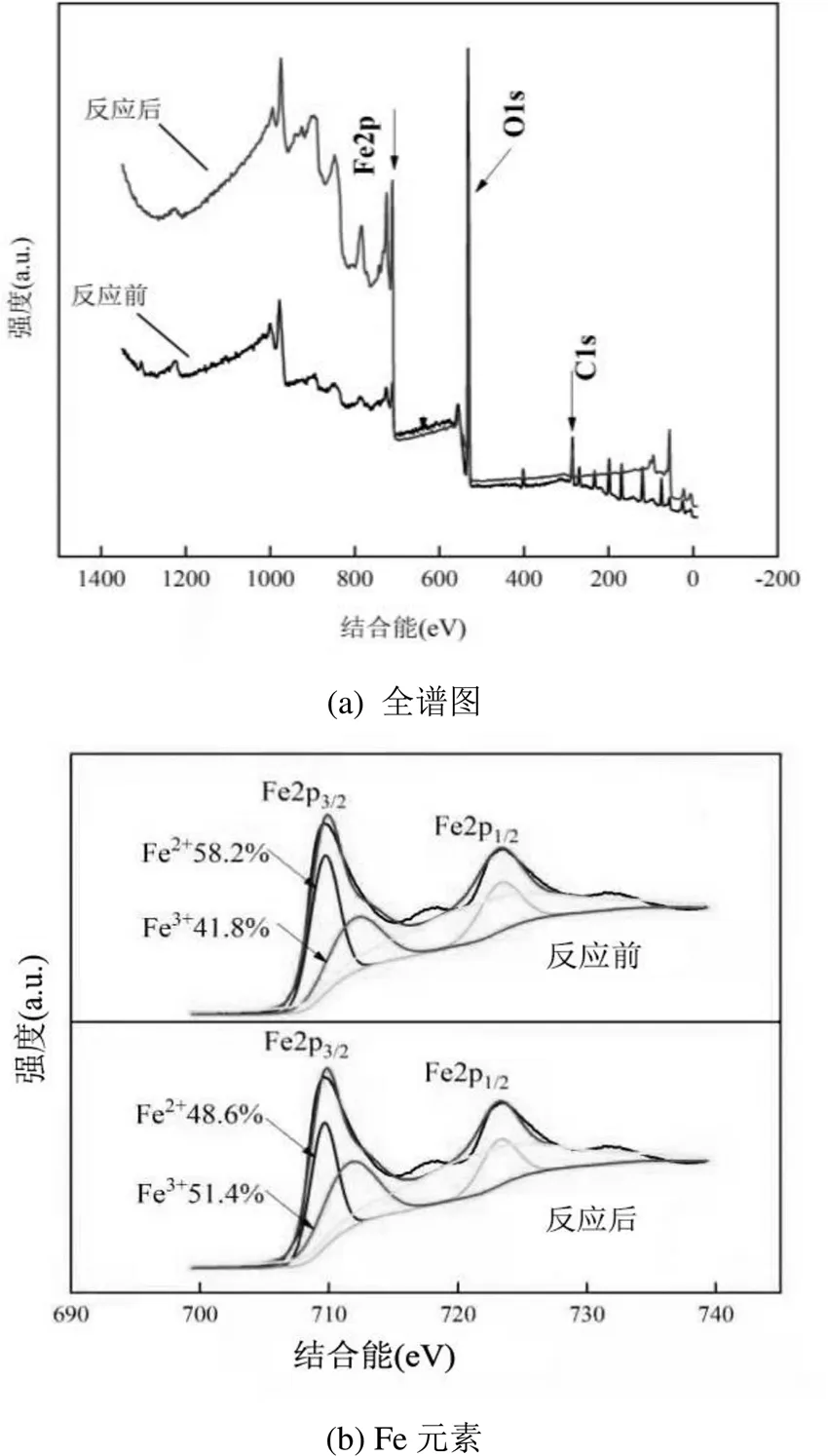
2.4.3 XPS分析 由图12(a)可以看出,Fe3O4催化剂表面主要包含Fe、C和O元素.其中,在结合能为285eV附近的峰为C 1s的峰,在制备Fe3O4催化剂中没有碳成分的加入,这是因为在XPS测试中加入了碳粉作为样品基底,因此全谱图中C元素具有一定的峰强度.
Fe元素的高分辨率谱图如图12(b)所示.反应前Fe3O4中的710.6和713.0eV的铁带为Fe(2p),观察到的位置与磁铁矿铁赋值的研究一致[38].反应后Fe3O4中的结合能略有增加,这表明Fe3O4中Fe2+和Fe3+组分的变化.其中,Fe3+的比例增加了9.6%,这表明在反应过程中部分Fe2+发生了电子捕获,参与了氧化反应.
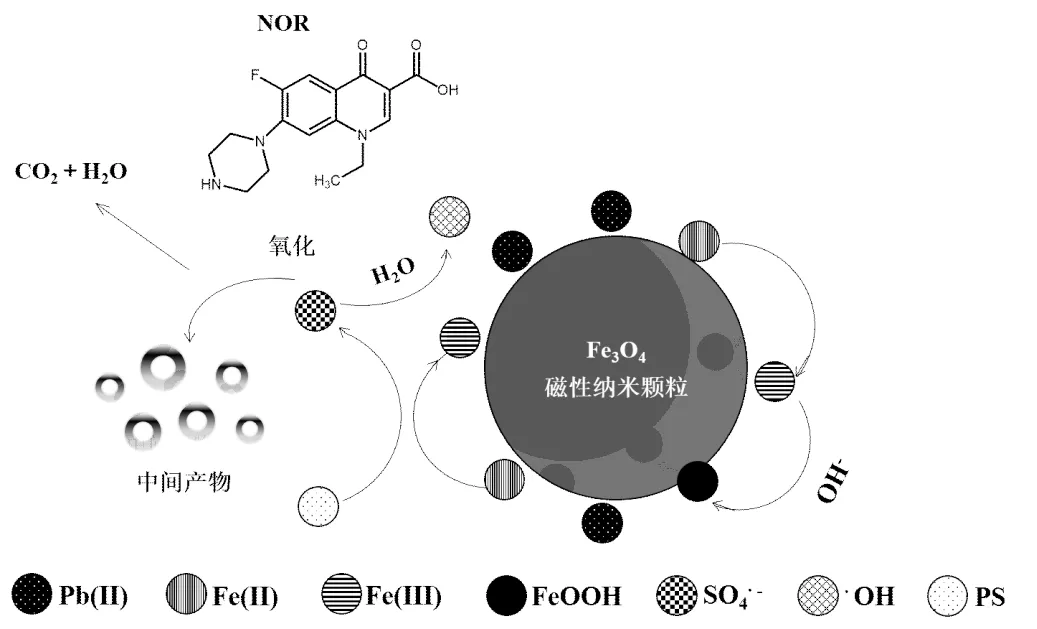
图13 利用Fe3O4/PS系统从水溶液中降解NOR和去除Pb(II)的反应机理示意
O元素的高分辨率谱图如图12(c)所示.反应前,结合能在529.4, 530.7, 531.4eV处的3个峰分别对应O2-、OH-和H2O.活化反应前后,Fe3O4中的O2-、OH-和H2O的含量发生变化,OH-和H2O的含量降低,表明OH-和H2O参与反应,并生成了H+和铁氧化物FeOOH[39];O2-在反应后的含量提升了4.1%,说明Fe3+能与有机物的官能团络合沉淀,达到去除有机物的效果.Fe3O4表面的Fe2+活化PS可生成SO4-∙,通过SO4-·与H2O的反应生成了∙OH,从而参加NOR降解过程.Fe2+可被氧化为Fe3+,并在Fe3O4表面上沉淀下来,从而形成Fe(氧)氢氧化物,如式(6)和(7)所示.
Fe3++ 3OH-→Fe(OH)3(6)
Fe3++ 3OH-→ FeOOH + H2O (7)
利用Fe3O4/PS系统降解NOR和去除Pb(II)的反应机理如图13所示.
2.5 NOR的降解途径
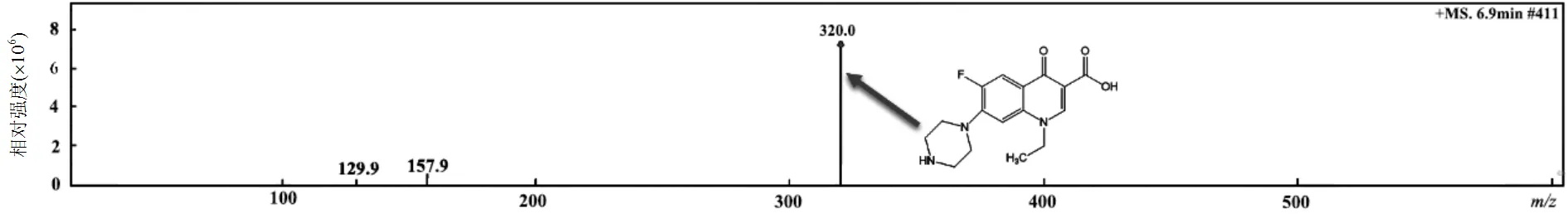


采用高分辨液质联用LC–MS系统对NOR降解过程中的中间产物进行了测定,通过分析质谱图14确定中间产物,中间产物的主要信息如表1所示,其中m/z=320为NOR,其余7种为NOR的降解中间产物.通过研究这些中间产物的分子结构式,提出了4种可能的NOR降解路径,结果如图15所示.
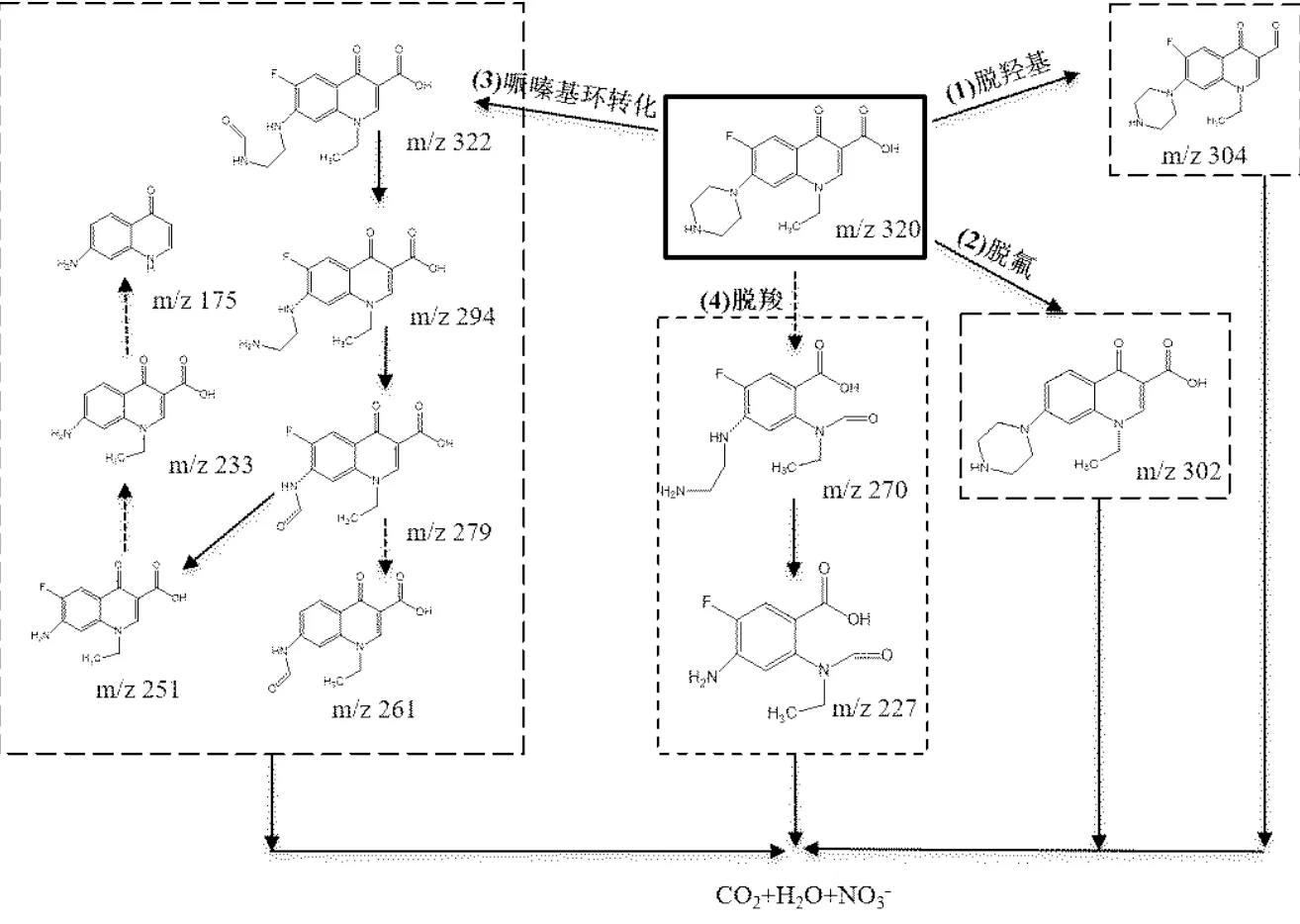
图15 Fe3O4/PS体系中NOR可能的降解反应路径
根据中间鉴定产物,推测NOR可能的降解途径包括脱羟基、脱氟、哌嗪基环转化和脱羧基这4个路径.路径I发生脱羟基反应,哌嗪环或喹诺酮基团上的C-H键,发生羟基化,形成中间产物N5(/= 304);路径II发生脱氟反应,NOR通过脱氟反应,形成中间产物N6(/=302),中间产物的MS质谱峰均较弱,因此脱氟反应不是NOR降解的主要路径;路径III发生哌嗪基环的转化,NOR的哌嗪环发生裂解,结构重排后形成中间产物N1(/=322)和N2(/= 294),进一步羟基化为N3(/=279),再发生脱氟反应形成(/=261),或者失去一个羰基基团而形成N4(/=251),继而形成(/=233)和(/=175);路径IV发生脱羧基反应,NOR通过脱羧作用分解形成中间产物(/=270)和N7(/=227),其质谱峰强度较弱,脱羧反应并不是NOR降解的主要路径.
综上可知,NOR结构中哌嗪环裂解与转化是Fe3O4/PS体系中NOR主要的降解路径.
2.6 Fe3O4的可重复使用性
为了评价Fe3O4的可重复使用性,采用4次Fe3O4活化PS实验,测定Fe3O4作为催化剂对NOR的去除率以及Fe3O4作为吸附剂对Pb(II)的去除率.每次运行后,用磁铁收集Fe3O4(MNPs),先用甲醇冲洗3次,再用蒸馏水反复洗涤,至洗涤液呈中性,然后循环进行下一批实验.图16显示,当Fe3O4循环使用次数增加时,NOR和Pb(II)的去除效率都逐渐降低.当Fe3O4加入到第4次循环使用时,NOR和Pb(II)的去除率分别为37.2%和45.6%.NOR去除率的降低表明Fe3O4有轻微的失活,这可能是因为吸附到Fe3O4表面的Pb(II)和NOR被氧化产生的各种中间产物覆盖Fe3O4的活性位点,致使其催化性能下降.Pb(II)去除率的降低可能是因为Fe3O4在反应过程中,其表面被氧化,使其化学组成改变,吸附性能下降所致.

图16 Fe3O4的稳定性和重复利用性
[NOR]=5.0mg/L, [Pb(II)]=1.0mg/L, [Fe3O4]=2.0g/L, [PS]=1.5mmol/L, pH=7.0,=30℃
3 结论
3.1 Fe3O4/PS体系通过同步参与NOR的氧化降解和Pb(II)的吸附去除,可以有效地去除水中NOR和Pb(II).
3.2 NOR降解反应符合伪一级反应动力学.提高Fe3O4投加量和PS浓度均能有效提高NOR降解率,但超过一定限值后对NOR降解效果没有促进作用.在NOR初始浓度为5.0mg/L,Pb(II)浓度为1.0mg/L, Fe3O4投加量为2.0g/L,PS浓度为1.5mmol/L,初始pH为值7.0,温度为30℃的条件下,反应120min后,NOR降解率达到90.2%,Pb(II)去除率为99.5%,TOC矿化率为59.6%.
3.3 自由基淬灭实验证实,Fe3O4/PS体系中存在SO4-·和·OH两种活性自由基,其中SO4-·为降解NOR的主导自由基.NOR的降解主要源于SO4-·的氧化作用,Pb(II)的去除主要源于Fe3O4的吸附作用.
3.4 Fe3O4/PS体系中NOR降解可能存在4种路径,分别是脱羟基、脱氟、哌嗪基环转化和脱羧基,根据中间产物推测出哌嗪环裂解和转化为NOR的主要降解路径.
[1] Yang Z, Jia S Y, Zhang T T, et al. How heavy metals impact on flocculation of combined pollution of heavy metals–antibiotics: A comparative study [J]. Separation & Purification Technology, 2015, 149:398-406.
[2] Wu D, Pan B, Wu M, et al. CoadsorptionofCuandsulfamethoxazole on hydroxylized and graphitized carbon nanotubes [J]. Science of The Total Environment, 2012,427:247-252.
[3] 张建强,黄 雯,陈 佼,等.羊粪生物炭对水体中诺氟沙星的吸附特性 [J]. 环境科学学报, 2017,37(9):3398-3408.
Zhang J Q, Huang W, Chen J, et al. Adsorption characteristics of norfloxacin in aqueous solution by sheep manure biochar [J]. Acta Scientiae Circumstantiae, 2017,37(9):3398-3408.
[4] 王盈霏,王枫亮,黎杰华,等.介孔氮化碳光催化降解诺氟沙星的动力学机制 [J]. 中国环境科学, 2018,38(4):1346-1355.
Wang Y F, Wang F L, Li J H, et al. Photocatalytic degradation kinetics and mechanism of norfloxacin using mesoporous g-C3N4under visible-light irradiation [J]. China Environmental Science, 2018,38(4): 1346-1355.
[5] 魏 红,史京转,李佳霖,等.超声、过硫酸钾协同去除水中诺氟沙星的效果 [J]. 环境科学, 2015,36(11):4121-4126.
Wei H, Shi J Z, Li J L, et al. Norfloxacin solution degradation under ultrasound’ potassium persulfate collaborative system [J]. Environmental Science, 2015,36(11):4121-4126.
[6] Brown E E, Gerrentsen P, Pollock B, et al. Psychiatric benefits of lithium in water supplies may be due to protection from the neurotoxicity of lead exposure [J]. Medical Hypotheses, 2018,115:94- 102.
[7] 李佳凡,姚竞芳,顾佳媛,等.黄浦江铅的人体健康水质基准研究 [J]. 环境科学学报, 2018,38(12):4840-4847.
Li J F, Yao J F, Gu J Y, et al. Human health-based water quality criteria of lead in Huangpu River [J]. Acta Scientiae Circumstantiate, 2018,38(12):4840-4847.
[8] Tan F, Sun D, Gao J, et al. Preparation of molecularly imprinted polymer nanoparticles for selective removal of fluoroquinolone antibiotics in aqueous solution [J]. Journal of Hazardous Materials, 2013,(244):750-757.
[9] Yang X, Flowers R C, Weinberg H S, et al. Occurrence and removal of pharmaceuticals and personal care products (PPCPs) in an advanced wastewater reclamation plant [J]. Water Research, 2011,45(16):5218- 5228.
[10] Rakhshandehroo G R, Salari M, Nikoo M R. Optimization of degradation of ciprofloxacin antibiotic and assessment of degradation products using full factorial experimental design by Fenton Homogenous process [J]. Global Nest Journal, 2018,20(2):324-332.
[11] Paul T, Miller P L, Strathmann T J. Visible-light-mediated TiO2photocatalysis of fluoroquinolone antibacterial agents [J]. Environmental Science & Technology, 2007,41(13):4720-4727.
[12] 汪 婷,高 滢,金晓英,等.纳米四氧化三铁同步去除水中的Pb(II)和Cr(III)离子 [J]. 环境工程学报, 2013,7(9):3476-3482.
Wang T, Gao Y, Jin X Y, et al. Simultaneous removal of Pb(II) and Cr(III) from wastewater by magnetite nanoparticles [J]. Chinese Journal of Environmental Engineering, 2013,7(9):3476-3482.
[13] 周爱娟,赵玉珏,刘芝宏,等.Fe(II)活化过硫酸盐处理喹啉工艺参数优化及生物毒性[J]. 中国环境科学, 2020,40(11):4795-4803.
Zhou A J, Zhao Y J, Liu Z H, et al. Accelerated quinoline removal by Fe(II)-activated persulfate: parameters optimization and biological detoxification analysis [J]. China Environmental Science, 2020,40(11): 4795-4803.
[14] 张饮江,相元泉,鲁 仙,等.零价铁激活过硫酸盐降解水中铬黑T特性 [J]. 中国环境科学, 2020,40(2):191-198.
Zhang Y J, Xiang Y Q, Lu Xian, et al. Characteristics on the Eriochrome black T(EBT) degradation in aquatics by Fe/persulfate system [J]. China Environmental Science, 2020,40(2):191-198.
[15] 刘美琴,宋秀兰.Fe2+激活过硫酸盐耦合活性炭深度处理焦化废水 [J]. 中国环境科学, 2018,38(4):1377-1384.
Liu M Q, Song X L. Fe2+activated persulfate coupled with activated carbon for advanced treatment of coking wastewater [J]. China Environment Science, 2018,38(4):1377-1384.
[16] 佘月城,董正玉,吴丽颖,等.MnFe2O4活化过一硫酸盐降解废水中LAS [J]. 中国环境科学, 2019,39(8):3323-3331.
She Y C, Dong Z Y, Wu L Y, et al. Degradation of LAS in wastewater by peroxymonosulfate activated by MnFe2O4[J]. China Environmental Science, 2019,39(8):3323-3331.
[17] Potakis N, Frontistis Z, Antonopoulou M, et al. Oxidation of bisphenol A in water by heat-activated persulfate [J]. Journal of Environmental Management, 2016,195(2):125-132.
[18] Xu L Y, Zhou X, Wang G L. Catalytic degradation of acid red B in the system of ultrasound/ peroxymonosulfate/Fe3O4[J]. Separation and Purification Technology, 2021,276:119417.
[19] Lu X, Shao Y, Gao N, et al. Degradation of diclofenac by UV- activated persulfate process: Kinetic studies, degradation pathways and toxicity assessments [J]. Ecotoxicology and Environmental Safety, 2017,141:139-147.
[20] Dominguez C M, Rodriguez V, Montero E, et al. Abatement of dichloromethane using persulfate activated by alkali: A kinetic study [J]. Separation and Purification Technology, 2020,241:11667.
[21] 黄智辉,纪志永,陈 希,等.过硫酸盐高级氧化降解水体中有机污染物研究进展 [J]. 化工进展, 2019,38(5):402-411.
Huang Z H, Ji Z Y, Chen X, et al. Degradation of organic pollutants in water by persulfate advanced oxidation [J]. Chemical Industry and Engineering Progress, 2019,38(5):402-411.
[22] Mona Kohantorabi, Gholamreza Moussavi, Paula Oulego, et al. Radical-based degradation of sulfamethoxazole via UVA/PMS - assisted photocatalysis, driven by magnetically separable Fe3O4@CeO2@BiOI nanospheres [J]. Separation and Purification Technology, 2021,267:118665.
[23] 苏冰琴,林昱廷,宋秀兰,等.磁性纳米Fe3O4活化过一硫酸盐降解三氯生性能 [J]. 中国给水排水, 2021,37(15):89-94,101.
Su B Q, Lin Y T, Song X L, et al. Degradation of triclosan in water by magnetic nanoscale Fe3O4activated peroxymonosulfate [J]. China Water & Wastewater, 2021,37(15):89-94,101.
[24] 张丽娜,钟 华,张俊涛,等.热,碱和Fe3O4激活过硫酸钠降解二恶烷的对比研究 [J]. 中国环境科学, 2017,37(10):3741-3747.
Zhang L N, Zhong H, Zhang J T, et al. A comparative study on activation of persulfate by heat, base and Fe3O4for degradation of 1,4-dioxane [J]. China Environmental Science, 2017,37(10):3741- 3747.
[25] 刘一清,苏冰琴,陶 艳,等.磁性纳米Fe3O4活化过硫酸盐降解水中磺胺甲恶唑 [J]. 环境工程学报, 2020,14(9):2515-2526.
Liu Y Q, Su B Q, Tao Y, et al. Degradation of sulfamethoxazole in water by magnetic nano-Fe3O4activated persulfate [J]. Chinese Journal of Environmental Engineering, 2020,14(9):2515-2526.
[26] Liu D, Zhang L, Li M K, et al. Magnetic Fe3O4-PS-polyacetylene composite microspheres showing chirality derived from helical substituted polyacetylene [J]. Micromole Rapid Common, 2012,33(8): 672-677.
[27] Kelly Peeters, Gaetane Lespes, Tea Zulian, et al. The fate of iron nanoparticles in environmental waters treated with nanoscale zero- valent iron, FeONPs and Fe3O4NPs [J]. Water Research, 2016,94: 315-327.
[28] Niu H, Di Z, Zhang S, et al. Humic acid coated Fe3O4magnetic nanoparticles as highly efficient Fenton-like catalyst for complete mineralization of sulfathiazole [J]. Journal of Hazard Materials, 2011, 190:559-565.
[29] Sun S P, Lemley A T. p-Nitrophenol degradation by a heterogeneous Fenton-like reaction on nano-magnetite: Process optimization, kinetics, and degradation pathways [J]. Journal of Molecular Catalysis A, 2011,349:71-79.
[30] SadaVenkateswarlu, Bhajanthri NateshKumar, BobbalaPrathima, et al. A novel green synthesis of Fe3O4magnetic nanorods using Punica Granatum rind extract and its application for removal of Pb(II) from aqueous environment [J]. Arabian Journal of Chemistry, 2019,12(4): 588-596.
[31] Guo S Z, Duan N, Dan Z G, et al. g-C3N4modified magnetic Fe3O4adsorbent: Preparation, characterization, and performance of Zn(II), Pb(II) and Cd(II) removal from aqueous solution [J]. Journal of Molecular Liquids, 2018,258(15):225-234.
[32] Tang X, Hashmi M Z, Zeng B, et al. Application of iron-activated persulfate oxidation for the degradation of PCBs in soil [J]. Chemical Engineering Journal, 2015,279:673-680.
[33] Moussav G, Momeninejad H, Shekoohiyan S, et al. Oxidation of acetaminophen in the contaminated water using UVC/S2O82-process in a cylindrical photoreactor: Efficiency and kinetics of degradation and mineralization [J]. Separation & Purification Technology, 2017, 181:132-138.
[34] 刘洪位,郭洪光,付 垚,等.硫酸根自由基降解诺氟沙星动力学因子优化分析 [J]. 水处理技术, 2016,42(3):27-31,42.
Liu H W, Guo H G, Fu Y, et al. Optimal analysis for kinetics factors on the degradation of norfloxacin using sulfate radical [J]. Technology of Water Treatment, 2016,42(3):27-31,42.
[35] Gong H, Chu W. Photodegradation of sulfamethoxazole with a recyclable catalyst [J]. Industrial & Engineering Chemistry Research, 2015,54(51):12763-12769.
[36] Wang S, Wang J. Radiation-induced degradation of sulfamethoxazole in the presence of various inorganic anions [J]. Chemical Engineering Journal, 2018,351:688-696.
[37] 张 君.活性炭纤维催化过一硫酸氢盐降解水中的酸性橙7 [D]. 青岛:中国海洋大学, 2014.
Zhang J. Activated carbon fiber catalyzed peroxymonosulfate oxidation of acid orange 7 in aqueous solution [D]. Qingdao: China Ocean University, 2014.
[38] Tan C Q, Gao N Y, Deng Y, et al. Radical induced degradation of acetaminophen with Fe3O4magnetic nanoparticles as heterogeneous activator of peroxymonosulfate [J]. Journal of Hazardous Materials, 2014,276:452-460.
[39] Dong H R, Deng J M, Xie Y K, et al. Stabilization of nanoscale zero-valent iron (nZVI) with modified biochar for Cr(VI) removal from aqueous solution [J]. Journal of Hazardous Materials, 2017,332: 79-86.
Simultaneous removal of norfloxacin and Pb(II) via Fe3O4-activated persulfate oxidation.
SU Bing-qin1,2*, LIU Yi-qing1,2, LIN Yu-ting3, WANG Jian1,2, QUAN Xiao-hui1,2, LI Rui1, RUI Chuang-xue4
(1.College of Environmental Science and Engineering, Taiyuan University of Technology, Taiyuan 030024, China;2.Municipal Engineering Graduate Education Innovation Center of Shanxi Province, Taiyuan 030024, China;3.College of Environmental Science and Engineering, Taiyuan University of Science and Technology, Taiyuan 030024, China;4.Shanxi Jiabaoyuan Technology Co. Ltd., Taiyuan 030006, China)., 2022,42(2):717~727
This study employed the advanced oxidation process ofpersulfate,activated with Fe3O4magnetic nanoparticles (Fe3O4/PS), for simultaneous removal of NOR (norfloxacin) and Pb(II) in wastewater. The effects of Fe3O4dosage, PS concentration, initial pH value and Pb(II) concentration on the degradation of NOR were investigated. Experimental results indicated that the degradation of NOR followed the pseudo-first-order kinetics. The degradation of NOR and the removal of Pb(II) reached to 90.2% and 99.5%, respectively, under the reaction conditions of temperature of 30℃, initial NOR concentration of 5.0mg/L, Fe3O4dosage of 2.0g/L, PS concentration of 1.5mmol/L, initial pH value of 7.0, and reaction time of 120minutes. Free radical quenching experiments confirmed that SO4-∙ was the dominant free radical in the degradation of NOR. The possible degradation pathways and intermediate products of NOR were inferred using LC-MS. This study indicated that the Fe3O4-activated PS oxidation process could be served as a novel technique for the simultaneous removal of organic pollutants and heavy metals.
NOR(norfloxacin);Pb(II);Fe3O4magnetic nanoparticles;persulfate;simultaneous removal
X703.1
A
1000-6923(2022)02-0717-11
苏冰琴(1972-),女,山西忻州人,副教授,博士,主要从事水污染控制理论与技术的研究.发表论文20余篇.
2021-07-09
国家自然科学基金资助项目(22008167);山西省自然科学基金资助项目(201801D121274);国家大学生创新创业项目(202010112010)
* 责任作者, 副教授, subingqin@tyut.edu.cn

