基于情境脉络培养学生的化学学科核心素养
——以“镁的提取及应用”教学设计为例
李康峰
(浙江省瑞安中学 325200)
1 教材分析
“镁的提取及应用”是化学1 (苏教版) 中专题2“从海水中获得的化学物质”中的一部分教学内容.本专题开宗明义地提出了学习重点是如何从海水中获取人类需要的物质,教材通过介绍海水中碘、溴和镁的工业提取方法,将物质的提取与性质融合在一起.本节课的学习是对金属冶炼方法及性质学习的延伸和发展.
2 教学过程
2.1 创设学习情境
视频引入青海察尔汗盐湖“镁害”现象,展示图1所示图片.

图1
习近平主席在考察盐湖情况时特别强调“镁害”治理问题.
报道中指出:察尔汗盐湖公司在生成大量钾肥的过程中有10倍于钾盐的镁盐排出,长期暴露空气中水分蒸发后形成晶体堆积.截止2008年青海钾肥厂排出的卤水中氯化镁含量达300多万吨.这在当地造成了极大的环境问题——镁害.
2.2 学习任务1——“镁害”变“镁利”
[设疑]镁害问题如此严重,对当地的生活环境造成极大的影响,是否有解决方法?
[学生]可以将镁害进行提炼制成单质镁
[教师]展示老卤的主要成分表格(见表1),如果要将镁害变成单质镁,需要经历哪些过程?请同学们小组讨论后进行路线设计.

表1
[学生1]需要对老卤进行分离提纯,制得纯的氯化镁,然后电解氯化镁得到单质镁.
[学生2]往卤水中加碱产生氢氧化镁沉淀,分离后灼烧成MgO,再通入还原性气体,比如CO或者H2,不是也能得到镁单质.
[学生3]镁单质非常活泼,应该不能被还原吧.就像金属钠制备也只能用电解法.
[教师]活泼的金属冶炼一般都选用电解法,还原法也是可以的,但是需要一定的条件.比如二战时期也曾使用木碳、金属钾高温还原氧化镁得到镁单质,但是存在很多的不利因素最终被淘汰.目前世界各国金属镁冶炼工业中比较成熟的炼镁方法大致可分为两大类: 一类是熔盐电解法(约80%),另外一类是硅热法(约20%). 无论哪种方法,均需要获得纯净的MgCl2固体.
[教师]分离提纯的步骤如何操作?
[学生1]将镁害用水溶解后加入氢氧化钠溶液,过滤得到氢氧化镁沉淀.再加入盐酸就可以得到氯化镁了.
[学生2]还不行,这时候是氯化镁溶液,直接电解得到不单质镁的.先要结晶后析出固体才能电解.
[教师]电解饱和食盐水时,得到的是氢氧化钠、氢气和氯气.所以电解法制备金属单质一定要在无水环境中.展示图1所示资料卡.

图1
请阅读资料卡并思考是否直接电解氯化镁晶体就可以得到单质镁?说明理由.
[学生]不能直接电解氯化镁晶体.因为氯化镁晶体带有结晶水,受热后产生氧化镁,氧化镁熔点很高,电解需要消耗大量的能源.所以有应该在氯化氢气流中加热失水得到无水氯化镁后再电解.
[教师]和氯化钠不同,氯化镁晶体带有结晶水,需要在一定条件下得到无水氯化镁后才能用于电解.这项技术要求非常高,除了仪器设备要抗酸,还要保证无水环境等.直到2016年12月份,察尔汗盐湖公司攻克了此项技术,设计了图2所示流程图,终于解决了困扰多年的镁害问题,生产的镁产量已经居全国前列,真正实现了“镁害”到“镁利”的转变.
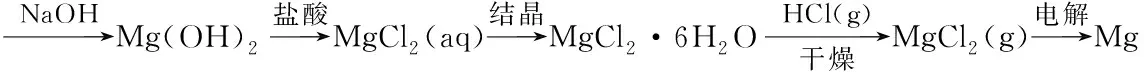
图2
设计意图:青海盐湖的镁害问题是实际生产生活中的真实存在问题,是一种宏观辨识的体现,引导学生用已学知识解决镁害问题这一过程是微观探析的一种方式.很好的培养了学生宏观辨识与微观探析这一学科核心素养的发展.运用物质的分离提纯思想进行镁害提纯的步骤培养了学生用已有知识解决问题的能力,即模型认知核心素养的体现;“镁害”变“镁利”的问题解决,即制备单质镁的方法分析过程,也是极大的考查了学生证据推理、模型认知等学科核心素养.
2.3 学习任务2——海水中提取镁工艺
[设疑]海水中存在着大量的氯化镁,可以如何开发利用镁呢?请结合察尔汗盐湖镁害的处理步骤,小组合作,实验探究、方案讨论.提供实验试剂:海水、卤水、0.5mol/L NaOH溶液,澄清石灰水.
[学生1]我们通过实验分析,卤水中加入氢氧化钠溶液产生沉淀比较明显,所以应该先将海水浓缩得到卤水,卤水中加入氢氧化钠得到氢氧化镁沉淀.然后沉淀中加入盐酸生成氯化镁溶液,氯化镁溶液进行结晶,在氯化氢气流中失水得到无水氯化镁,再电解得到单质镁.
[学生2]我觉得还可以加入氢氧化钙进行沉淀.因为海边可以的话可以从贝壳中直接获得.这样会比较经济实惠.
[教师]分析的非常有道理,要从经济角度分析(见表2).
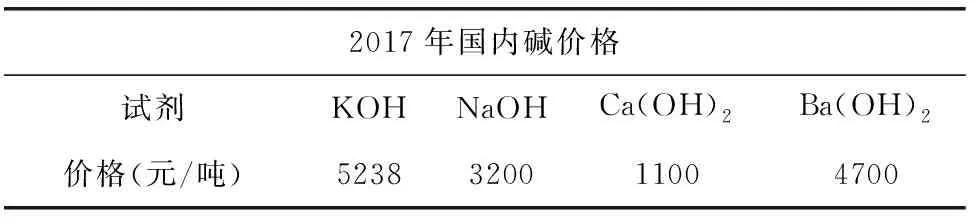
表2
[学生3]我们小组做了实验,发现澄清石灰水加入卤水和海水中都没有明显的沉淀产生.
[学生4]可以加入石灰乳.
[教师]经过同学们的数据分析和实验探究,我们实现了海水中镁离子的分离提纯,同时也富集了镁.再选用电解法实现化合态镁到游离态镁的转化,电解时要特别关注氯化镁自身和环境的无水.海水中提取镁技术中你觉得还需要考虑什么问题?
[学生]尾气处理.生成的氯气可以和氢气反应生成氯化氢,生产盐酸用于循环利用.
[教师]企业生产在追求经济利益最大化的同时也要绿色化生产.就像察尔汗盐湖公司一样,走出钾、抓住镁、发展锂、整合碱、优化氯,综合发展.
设计意图:通过对察尔汗盐湖中镁害问题解决,学生建立了一种模型建构,通过对模型的迁移应用,很好的解决了新情境中镁的提纯问题——海水中镁的获取.教学中设置的学生活动和实验探究,确立以学生为主体地位,同学之间的互相探讨、实验探究、评价分析共同完成方案设计.属于学科核心素养中实验探究和创新精神,在化学学习过程中不断质疑和佐证,不断思考和总结,是一种创新精神的体现.
2.4 学习任务3——镁的性质及用途
[设疑]察尔汗盐湖公司生产大量镁被用于生活中的各个领域.你能举出一些例子吗?
[学生]制造信号弹、生产烟花、做成镁合金用于汽车、飞机、火箭等领域的零部件材料.
[教师]用途反映性质,你能从镁的这些用途中猜猜镁会具有哪些性质吗?
[学生]进行猜测(见表3).

表3
[教师]请同学们再从镁原子的微观结构来分析它还能有哪些性质呢?
[学生]镁能和非金属单质反应,如氯气、氧气、溴蒸气;能与酸反应;能与水反应;能与盐溶液反应.
[教师]镁的性质我们可以通过前面学习的钠的性质进行预测,那么镁和水反应现象与金属钠和水反应一样吗?
实验探究:金属镁与水反应
实验过程:
①取1支试管,加入少量蒸馏水备用
②用镊子取出广口瓶中的一条镁条,用砂纸打磨镁条表面至露出金属光泽.放入试管中,观察现象.
③用试管夹夹紧试管,在酒精灯上加热试管至沸腾,观察现象;并滴入两三滴酚酞试液,观察现象.
(学生分小组进行实验)
[学生]镁与冷水几乎不反应,热水中发生反应,镁条表面产生少量气泡,滴入酚酞试液变红,说明生成了氢氧化镁.
[教师]镁除了具有活泼金属的通性,它镁能与氮气、二氧化碳发生化学反应.请同学们注意观察实验现象.
[演示实验]
①镁条与氮气的燃烧反应(氮气由亚硝酸钠和氯化铵饱和溶液制备得到);
②镁条与二氧化碳的燃烧反应.
(反应后的集气瓶通过实物投影展示).
[学生1]都是剧烈燃烧,发出耀眼的光,产生白烟.
[学生2]镁条在二氧化碳中燃烧好像更耀眼,而且瓶壁上还观察到一些黑色小颗粒.
[教师]观察的非常仔细,那么请同学们完成这两条化学反应方程式的书写.
[教师]通过对镁性质的学习,请同学们再来说说,察尔汗盐湖公司镁害处理生产车间需要注意哪些问题?
[学生1]防火、防酸、防水.
[学生2]不能用二氧化碳和水灭火,所以车间需要放置一些沙子,用于灭火.
[学生3]及时的处理氯气,避免与金属镁接触反应.
设计意图:通过镁的用途和结构的分析,预测镁的性质.引导学生从物质的微粒观、元素观等分析物质的性质,发展了学生微观探析和宏观辨识的能力.同时也注重学生体会科学探究的一般过程和方法,从预测和假设到实验的验证分析,初步了解科学思维方法,建构研究化学变化的思路和模型,也发展了许是证据推理和模型认知的学科核心素养.

