阴道脱落细胞中PD-1、PD-L1、MIF表达水平与HR-HPV感染及宫颈病变程度的相关性分析
豆中敏,李紫阳
(1.周口市第一人民医院妇科,河南 周口 466700;2.周口市第一人民医院普外科,河南 周口 466700)
宫颈癌是发生在宫颈部位的一种恶性肿瘤,多发生与中老年女性[1]。高危型人乳状瘤病毒(HRHPV)持的主要原因[2]。从HR-HPV持续感染到癌前病变,再到宫颈癌的发生是一个较长的过程,定期筛查和注射疫苗有助于早期预防宫颈癌的发生[3]。因此早期诊断、尽早治疗续感染是导致宫颈癌发生有助于提高治疗效果,改善预后[4]。阴道局部环境内的免疫性细胞因子在宫颈病变发病机制中发挥的作用受到了越来越广泛的重视[5]。程序性死亡分子1(PD-1)、程序性死亡配体1(PD-L1)、巨噬细胞移动抑制因子(MIF)在机体的免疫应答与炎症反应中起重要作用,有研究报道其在肝癌、肺癌、乳腺癌等肿瘤疾病中有表达,并与肿瘤预后有关[6]。在以往的研究中关于PD-1、PD-L1、MIF水平与HR-HPV感染及宫颈癌病变程度均有报道,但关于三者联合检测的报道较少,本研究以不同宫颈病变患者为研究对象,检测不同宫颈病变患者阴道分泌液中PD-1、PD-L1、MIF表达水平,探讨阴道局部微环境中PD-1、PD-L1、MIF水平的变化与HR-HPV感染及宫颈病变程度的关系,为临床宫颈癌的早期诊断与预防提供新的思路与参考依据。
1 资料与方法
1.1 一般资料 连续收集2017年1月至2020年3月到本院妇科门诊进行宫颈癌筛查结果中宫颈HR-HPV阳性的150例患者为研究对象,对其进行HPV分型检测及宫颈液基细胞学检查,根据组织病理学结果将150例患者分别记为慢性宫颈炎组47例,低级别上皮内病变组43例,高级别上皮内病变组31例,宫颈癌组29例。
纳入标准:(1)受检者有性生活史;(2)无免疫疾病者;(3)配合检查;(4)受检前3 d无阴道冲洗及放药,24 h内无性生活。排除标准:(1)合并其他恶性肿瘤;(2)妊娠期货月经期;(3)子宫切除史;(4)近期内有服用抗生素及免疫抑制剂。
1.2 检测方法 阴道分泌液中PD-1、PD-L1、MIF检测方法及阳性标准:将门诊完成取材的阴道分泌物送至门诊实验室进行阴道分泌物检测,采用免疫组织化学SP法检测标本中的PD-1、PD-L1、MIF水平,将检测样本进行石蜡包埋样本切片处理,将切片放置在30%的乙醇中进行处理,放置在45~50℃水槽中进行展片,放入45℃的温箱中进行干燥,之后在蒸馏水中浸泡1 min进行水化,在苏木素水溶性溶液中进行染色,待HE染色玻片制备完成后,在显微镜下观察宫颈癌癌细胞和浸润淋巴细胞染色情况。检测过程中使用的MIF鼠抗人单克隆抗体、小鼠单克隆抗体to PD1、小鼠单克隆抗体IgG1抗体均购自美国abcam公司。
1.3 判定标准 PD-1、PD-L1、MIF以包膜和细胞质呈棕黄色着色为阳性[7]。每个切片选取5个高倍视野,每个视野计数100个细胞,计数阳性细胞百分数,同时观察阳性细胞染色强度。以阳性细胞百分数计数:≤5%为0分,6%~35%为1分,36%~65%为2分,≥65%为3分;以染色强度计分:无染色为0分,淡黄色为1分,棕黄色为2分,深棕色为3分,将两种计分的相加的总分进行判断,评分>2分为阳性,≤2分为阴性。
1.4 HR-HPV检测 将取材好的标本封装固定,送至病理科实验室,宫颈HPV采用Cobas 4800 HPV DNA检测方法进行检测,根据宫颈脱落细胞DNA及β-globin的Ct值判读确定HR-HPV阳性结果。
1.5 观察指标 (1)收集不同宫颈病变组患者的临床资料,包括年龄、初次性生活年龄、分娩次数,比较资料的均衡性。(2)比较不同宫颈病变患者的PD-1、PD-L1、MIF表达水平。(3)比较不同宫颈病变患者HR-HPV感染情况。(4)比较HR-HPV感染与HR-HPV未感染患者的PD-1、PD-L1、MIF表达水平。(5)采用Spearman相关性分析PD-1、PD-L1、MIF表达水平与HR-HPV感染及宫颈病变程度的关系。
1.6 统计学分析 采用SPSS 18.0统计分析数据,计量资料用(±s)表示,采用t检验,计数资料用百分数表示,比较用χ2检验,采用Spearman相关性分析PD-1、PD-L1、MIF表达水平与HR-HPV感染及宫颈病变程度的关系,检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 各组患者的临床资料比较 四组患者的年龄、初次性生活年龄、分娩次数比较差异无统计学意义(P>0.05)。见表1。
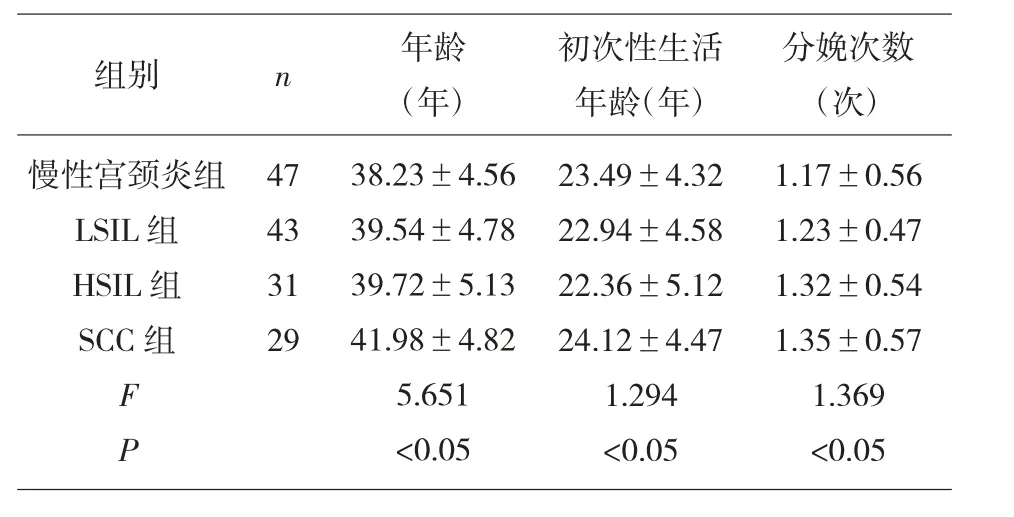
表1 四组患者的临床资料比较[(n)%]
2.2 各组患者的PD-1、PD-L1、MIF表达水平比较随着宫颈组织病变的进展PD-1、PD-L1、MIF表达水平呈增高趋势,组间比较有差异(P<0.05),且PD-1、PD-L1、MIF在SCC组表达水平显著高于其他三组(P<0.05)。见表2。

表2 各组患者的PD-1、PD-L1、MIF表达水平比较[(n)%]
2.3 不同级别的宫颈病变中HR-HPV感染情况比较 四组不同程度的宫颈病变HR-HPV阳性率分别为31.91%、65.12%、83.87%、100.00%,HR-HPV阳性率随着宫颈病变严重程度的加重而升高,组间比较差异有统计学意义(P<0.05)。见表3。

表3 不同级别的宫颈病变中HR-HPV感染情况比较[(n)%]
2.4 HR-HPV感染与PD-1、PD-L1、MIF表达比较HR-HPV(+)组的PD-1、PD-L1、MIF表达水平高于HR-HPV(-)组,两组比较差异具有统计学意义(P>0.05)。见表4。
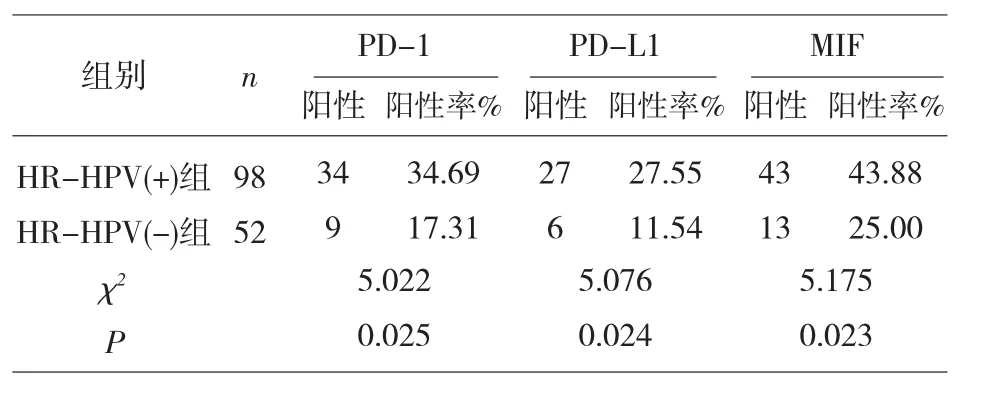
表4 HR-HPV感染与PD-1、PD-L1、MIF表达比较[(n)%]
2.5 相关性分析Spearman相关性分析,HR-HPV感染与PD-1、PD-L1、MIF表达水平呈正相关(P<0.05),宫颈病变程度与PD-1、PD-L1、MIF表达水平呈正相关(P<0.05)。见表5。

表5 PD-1、PD-L1、MIF表达水平与HR-HPV感染及宫颈病变程度的相关性分析
2.6 PD-1、PD-L1、MIF在宫颈组织中阳性表达显微镜染色图片。见图1。

图1 a、b、c分别为PD-1、PD-L1、MIF在宫颈组织中阳性表达的显微镜染色图片
3 讨论
HPV是球形DNA病毒感染引起的一种性传播疾病,可能导致肿瘤或尖锐湿疣或皮肤的黏膜的赘生物[8]。HPV病毒有两百种左右的亚型,人的皮肤和黏膜最常见的感染大概有几十种,根据它引起癌变的风险可分为高危型和低危型[9]。持续性的、高危型的HPV感染是宫颈癌和宫颈癌前病变发生的重要原因[10]。临床治疗宫颈癌是以化疗、放疗、手术治疗等综合治疗为主,近年来细胞免疫治疗引起了越来越多医学工作者的关注。
本研究发现随着宫颈组织病变的进展PD-1、PD-L1、MIF表达水平呈增高趋势,组间比较有差异,且PD-1、PD-L1、MIF在SCC组表达水平显著高于其他三组。分析可能的原因是一种重要的免疫抑制分子,为免疫球蛋白超家族。PD-L1是一种跨膜蛋白,免疫系统的抑制有关[11]。PD-1与PD-L1结合,可以传导抑制性的信号,减低淋巴结CD8+T细胞的增生,而且PD-1还可以借由调节Bcl-2基因,控制淋巴结中抗原特异性T细胞的聚积,促进肿瘤的免疫逃逸[12]。MIF是一种内分泌免疫物质,能够限制体内巨噬细胞的活动,有助于肿瘤细胞的增殖[13]。这点与PD-1、PD-L1、MIF的阳性表达在宫颈炎、低级别上皮内病变、高级别上皮内病变、宫颈癌患者依次增高可以得到印证。研究发现四组不同程度的宫颈病变HR-HPV阳性率分别为31.91%、65.12%、83.87%、100.00%,HR-HPV阳性率随着宫颈病变严重程度的加重而升高,组间比较差异显著。HPV/hr是指高危型HPV,检查有高危型HPV阳性,需要进一步做HPV分型检查,明确是否有HPV16、18这两个亚型感染。如果HPV16/18阳性,需要进一步做阴道镜检查+宫颈活检,明确是否有宫颈病变。在有性生活的女性中,HPV感染很普遍,最初可以诱导女性发生低级别的鳞状上皮内病变,其中大部分在机体免疫应答中清除,少部分会进展为宫颈癌。如果检查结果是其他高危型HPV阳性,但是TCT检查结果是正常的,可以定期复查,每年做一次宫颈TCT和HPV检查。提示HR-HPV是宫颈病变发生的重要原因,与当前国内外研究基本一致[14]。研究发现HR-HPV(+)组的PD-1、PD-L1、MIF表达水平高于HR-HPV(-)组,两组比较差异具有统计学意义。HPV感染后,大多数患者可以通过自身的免疫调节进行清除,少数患者会持续感染,发展为宫颈上皮内瘤,甚至癌变。近来不少研究显示机体免疫调节对HPV引发的致癌过程至关重要,HPV能够逃避免疫监视,与PD-1、PD-L1、MIF细胞免疫因子在免疫调节过程中发挥作用有很大关系。有研究认为HPV可能与细胞免疫因子共同促进癌症的演变[15]。PD-1与PD-L1结合可以抑制T细胞增殖,并促进T细胞凋亡,提高CD8细胞毒性T细胞功能,促进抗肿瘤免疫应答。Spearman相关性分析,HR-HPV感染与PD-1、PD-L1、MIF表达水平呈正相关,宫颈病变程度与PD-1、PD-L1、MIF表达水平呈正相关。提示PD-1、PD-L1、MIF与HPV感染和宫颈病变进程密切相关,对宫颈癌的诊断与预防具有主要的参考价值。
综 上 所 述,PD-1、PD-L1、MIF表 达 水 平 与HR-HPV感染及宫颈病变程度呈正相关,表明PD-1、PD-L1、MIF表达可能与肿瘤的发生、发展过程密切相关,定期检测对患者的病情发展具有一定的指导作用。

