急性白血病化疗后粒缺伴发热患儿血清hs-CRP、PCT水平变化及临床意义
张晗,张娴,向金峰,张蔚晨
(1.南阳市中心医院儿童血液肿瘤科,河南 南阳 473000;2.南阳市中心医院检验科,河南 南阳 473000)
急性白血病(Acute leukemia,AL)是造血系统的恶性克隆性疾病,主要表现为骨髓、外周血、及其他组织中的异常克隆细胞增殖分化并破坏正常造血,临床常表现为贫血、急性出血、感染等[1-3]。根据世界卫生组织(World health organization,WHO)对其分类为急性淋巴细胞白血病 (Acute lymphoblastic leukemia,ALL)和急性髓系白血病(Acute myelogenous leukemia,AML),以及急性未明系列白血病,临床多采用化疗进行治疗,但化疗后患儿均会出现不同程度骨髓抑制,致使白细胞、中性粒细胞、血红蛋白和血小板等全血细胞下降[4-6]。当中性粒细胞绝对计数低于0.5×109/L时称为粒细胞缺乏症,患儿由于骨髓抑制免疫力降低,极易继发口腔、皮肤、呼吸道、肛周和血流感染,出现发热、咳嗽、肛周疼痛等临床症状,体温可高达39~40℃,显著影响化疗的治疗周期,重则出现脓毒症、感染性休克危及生命[7-8]。研究发现,血清学变化常早于临床症状,故选择敏感炎症指标对AL化疗后粒缺后预测感染有重要意义。超敏C反应蛋白(Creactive protein,hs-CRP)是机体受到外在感染后急性合成的急性相蛋白,可随炎症消退和组织功能恢复逐渐下降,在儿童感染中均有较高的表达水平[9-10]。降钙素原(Procalcitonin,PCT)在正常生理状态下血清PCT含量极低,但在机体出现感染时,肝肾等器官会产生大量PCT,故其可反映炎症的感染程度[11-12]。本次研究旨在探讨AL化疗后粒缺伴发热患儿血清hs-CRP、PCT水平动态变化,及hs-CRP、PCT水平对AL化疗后粒缺患儿预测发热的临床价值。
1 资料与方法
1.1 一般资料 回顾性选取2017年1月至2020年11月在我院收治的AL患儿137例,根据患儿是否发热分组为发热组(n=94)和无发热组(n=43)。纳入标准:符合中华医学会第十次全国血液学学术会议对AL诊断标准[13],且所有病例均经病理学检查确诊,均采用化疗方法治疗;所有病例均符合中国中性粒细胞缺乏伴发热患者抗菌药物临床应用指南[14],中性粒细胞计数(Neutrophil,NEUT)≤0.5×109/L。排除标准:合并其他恶性肿瘤;1周内有手术史、外伤史;合并免疫系统疾病;精神疾病史;临床资料不完整。发热组:单次口腔温度≥38.3℃(腋温≥38.0℃),或至少1 h口温持续>38℃(腋温≥37.7℃)。男性71例,女性23例;年龄3~10岁,平均年龄(6.53±2.67)岁;AML39例,ALL55例。无发热组:其中男性28例,女性15例;年龄3~9岁,平均年龄(6.17±2.45)岁;AML 21例,ALL 22例。比较两组患儿性别、年龄和疾病种类一般资料无显著差异(P>0.05)。
1.2 方法
1.2.1 一般资料 根据本研究目的自行设计调查表,在电子病历系统收集患儿性别、年龄、疾病种类、病程和实验室检查结果中性粒细胞绝对计数(Absolute count of neutrophils,ANC)、Hb(Hemoglobin,Hb)和外周血血小板(Platelet,PLT)。
1.2.2 检测ANC、Hb和PLT分别于化疗前采集两组患儿空腹静脉血3 mL于EDTA-K2抗凝试管,采用Sysmex XE-5000全自动血液分析仪检测患儿ANC、Hb和PLT,ANC<0.5×109/L为粒细胞缺乏。Hb正常参考范围:男性120~160 g/L,女性为110~150 g/L,新生儿:170~200 g/L、儿童:110~160 g/L。PLT正常参考范围(100~300)×109/L。
1.2.3 检测血清hs-CRP和PCT水平 分别于发热组化疗前(T0),化疗药物结束后3 d(T1),粒缺合并发热后第1 d(T2),抗感染治疗后第7 d(T3)、化疗后恢复期(T4)采集患儿空腹静脉血5 mL保存于不抗凝试管,离心(德国Hettich MIKRO220/220R离心机)并分离血清(3 000 r,10 min),取上层清液置于-20℃冰箱保存,从采集到检验≤2 h。采用电化学发光法检测患儿PCT水平,仪器选择罗氏Cobas e601全自动电化学发光仪。采用胶乳增强免疫比浊法检测hs-CRP水平,仪器日立7600全自动生化分析仪,试剂盒由武汉菲恩生物科技有限公司提供,测定操作严格按说明书步骤进行。
1.2.4 检测血培养 发热组于患儿发热时急查血培养,抽取患儿静脉血5 mL于BACT/ALERT培养瓶,采集后即刻送往病原微生物室培养3~5 d,采用BACT/ALERT 3D血培养仪检测,细菌培养采用梅里埃VITEK2全自动微生物分析仪对病原菌结果进行分组为血培养阳性组和血培养阴性组。
1.3 统计学处理 采用SPSS 18.0统计学软件进行数据分析,满足正态分布且方差齐的计量资料采用(±s)表示,采用两样本独立t检验比较组间差异,计数资料用率表示,采用χ2检验,采用受试者工作曲线(Receiver operating characteristic,ROC)曲线分析血清hs-CRP和PCT水平检测对AL化疗后粒缺患儿发热的预测价值。P<0.05为差异有统计学意义。
2 结果
2.1 比较两组一般资料 两组患儿在性别、年龄、病情种类、病程、ANC、Hb和PLT一般资料比较无显著差异(P>0.05),见表1。
表1 比较两组一般资料(±s)

表1 比较两组一般资料(±s)
一般资料性别无发热组(n=43)发热组(n=94) t/χ2 P 1.597 0.206男女年龄(岁)种类28(65.12)15(34.88)6.17±2.45 71(75.53)23(24.47)6.53±2.67 0.751 0.647 0.453 0.421 A M L A LL病程(年)A N C(×109/L)Hb(g/L)P L T(×109)21(48.84)22(51.16)2.54±0.67 0.34±0.11 71.24±0.87 105.34±13.57 39(41.49)55(58.51)2.62±0.84 0.31±0.12 71.38±0.86 108.45±10.25 0.549 1.392 0.881 1.483 0.583 0.165 0.379 0.141
2.2 比较两组患儿T0、T1和T4期血清hs-CRP和PCT水平T0期两组hs-CRP和PCT无显著差异(P>0.05),T1期与T4期发热组hs-CRP和PCT均高于无发热组(P<0.05),发热组T4期hs-CRP和PCT高于T0期,无发热组T0期与T4期无显著差异(P>0.05),见表2。
表2 比较两组患儿T0、T1和T4期h s-CRP和PCT水平(±s)

表2 比较两组患儿T0、T1和T4期h s-CRP和PCT水平(±s)
注:与T0比较,*P<0.05;与T1期比较,#P<0.05。
组别h s-CRP(mg/L)T0 T1 T4 PC T(ng/mL)T0 T1 T4发热组(n=94)无发热组(n=43)t P 5.72±1.35 5.41±1.48 1.168 0.245 9.16±1.44*6.27±0.83*14.832<0.001 19.15±2.04#5.34±0.15 57.834<0.001 0.34±0.11 0.36±0.12 0.928 0.354 0.97±0.14*0.41±0.23*14.737<0.001 0.42±0.09#0.39±0.08 1.957 0.006
2.3 比较发热组患儿不同时期hs-CRP和PCT水平 发热组T1期hs-CRP和PCT水平显著高于T0(P<0.05),T2期患儿hs-CRP和PCT水平显著高于T1和T0(P<0.05),T3期患儿hs-CRP和PCT水平显著低于T2期(P<0.05),T3期hs-CRP水平显著高于T1期,但PCT与T1期比较无显著差异(P>0.05),T4期hs-CRP水平高于T0(P<0.05),PCT水平与T0无显著差异(P>0.05),见表3。
表3 发热组患儿不同时期h s-CRP和PCT水平(±s)

表3 发热组患儿不同时期h s-CRP和PCT水平(±s)
注:与T0比较,*P<0.05;与T2比较,#P<0.05。
时间T0 T1 T2 T3 T4 h s-CRP(mg/L)5.72±1.35 9.16±1.44*66.29±6.54*29.42±6.17#19.15±2.04#PC T(ng/mL)0.34±0.11 0.97±0.14*4.97±0.53*0.81±0.12#0.42±0.09#
2.4 不同血培养结果发热患儿血清hs-CRP和PCT水平 发热组患儿血培养阳性19例(20.21%),血培养阳性组hs-CRP、PCT水平显著高于血培养阴性组患儿(P<0.05),见表4。
表4 不同血培养结果发热患儿血清h s-CRP和PCT水平(±s)

表4 不同血培养结果发热患儿血清h s-CRP和PCT水平(±s)
组别血培养阳性(n=19)血培养阴性(n=75)t P h s-CRP(mg/L)75.24±7.12 41.39±5.26 23.235<0.001 PC T(ng/mL)5.12±0.58 3.17±0.34 19.053<0.001
2.5 采用ROC预测分析检测hs-CRP和PCT水平对化疗后粒缺期患儿发热预测价值 hs-CRP和PCT预测化疗后粒缺期感染的AUC为0.687和0.713,联合检测预测价值更高(AUC=0.832,P<0.05),见表5、图1。

表5 ROC预测分析检测h s-CRP和PCT水平对化疗后粒缺期患儿发热预测价值分析
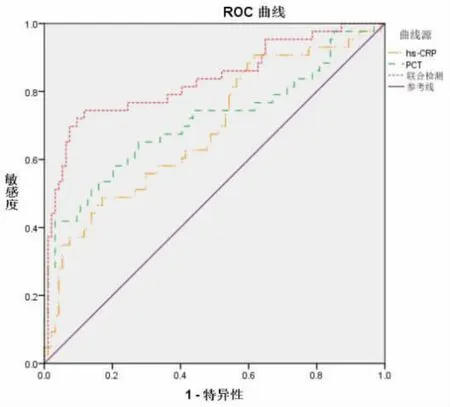
图1 ROC预测分析检测h s-CRP和PCT水平对化疗后粒缺期患儿发热预测价值特征
3 讨论
AL是我国常见恶性肿瘤,近些年受环境、饮食结构等因素影响发病率逐年上升,严重增加了家庭和社会负担[15-16]。目前临床常见的治疗方法仍然是化疗,但化疗后常出现骨髓抑制等并发症有继发感染的风险,部分患儿不得不中途暂停化疗行抗感染等对症处理。然而该感染缺乏特异性临床表现,多表现为发热,但化疗期间出现发热因素复杂多样,故常被人们忽视,因此早期发现化疗后粒缺患儿感染对治疗和预后有重要意义。本研究分析了患儿性别、年龄、疾病种类、病程、ANC、Hb和PLT一般资料未见显著差异。
本研究发现,T1期与T4期发热组hs-CRP和PCT均高于无发热组,发热组T4期hs-CRP和PCT高于T0期。人体PCT常由甲状腺C细胞生成,在活体内外均有稳定的水平,半衰期20~24 h。在内毒素等细胞因子诱导下,肝、脾、肾、肺的神经内分泌细胞分泌大量细胞因子,使血液中PCT水平迅速升高,既往研究发现[17-18],PCT水平在炎症感染时,2~3 h开始增加,6~8 h体内浓度快速升高,12~48 h到达峰值,2~3 d后恢复正常。故PCT可反应全身炎症的活跃程度,研究中治疗后PCT水平随炎症消失而下降至正常水平,故具有较好的灵敏性和特异性。发热组患儿hs-CRP在粒缺期水平急剧升高,治疗结束后水平大幅下降,提示hs-CRP具有较好的灵敏性,但特异性与PCT相比较差,且具有更长的生物半衰期。hs-CRP在监测感染、抗生素治疗效果、化疗后继发感染中均有广泛的应用价值[19-20]。hs-CRP在正常人体水平低,在感染、损伤后6~12 h迅速升高,48 h达峰值,由于其较长的生物半衰期较小被机体内环境影响,故可以此评价机体感染的炎症程度。本研究中化疗后粒缺期患儿hs-CRP显著高于T0和无发热患儿,且治疗后水平有显著下降,提示随患儿感染的逐步控制,hs-CRP水平也慢慢恢复正常。
本研究结果显示,发热组T1期hs-CRP和PCT水平显著高于T0,T2期患儿hs-CRP和PCT水平显著高于T1和T0,T3期患儿hs-CRP和PCT水平显著低于T2期,T3期hs-CRP水平显著高于T1期,但PCT与T1期比较无显著差异,T4期hs-CRP水平高于T0,PCT水平与T0无显著差异。提示白血病化疗后感染患儿PCT和hs-CRP水平有显著升高,且在治疗后降低,可用于化疗后感染与疾病预后评价。结合ROC分析可见,PCT诊断化疗后感染敏感度、特异度和截断值为63.45、70.19和4.65 ng/mL,hs-CRP分别为90.34、52.17和62.57 mg/L,可见PCT在敏感性上不如hs-CRP,在特异性上优于hs-CRP,既往沈艳红等的研究认为[21]PCT在儿童白血病化疗后预测感染价值优于hs-CRP,这与本研究中结果部分类似,分析原因可能是由于PCT为无激素活性糖蛋白,半衰期可达25~30 h,具有较好的稳定性,细菌感染后,人体单核细胞、巨噬细胞和肠道神经细胞均大量分泌致其水平显著升高,其受到非细菌感染的因素影响相对较小,但该研究中未对两种治疗联合检测对诊断效能价值进行相关探讨,故存在一定局限性,而本研究中经ROC分析可见联合检测后诊断效能显著提高,这有助于临床医师提高化疗后发热患者早期诊断率,有助于病情评估与预后改善。
综上所述,AL患儿粒缺伴发热患儿hs-CRP和PCT水平显著升高,经治疗后可显著下降,PCT具有较高的特异性,hs-CRP具有较好的敏感性,临床医师可以此为参考,通过联合检测hs-CRP和PCT预测化疗后粒缺期患儿发热的诊断价值。

