批分析(多管同测)法超敏检测低浓度乙型肝炎病毒核酸
斯志娟,雷震
(南昌大学附属感染病医院 南昌市第九医院,江西 南昌 330002)
人类非自限性病毒感染性疾病的病因学治疗手段有限,目前,大多依赖核苷(酸)类似物破坏病毒(逆)转录,干扰或终止病毒核酸的合成,达到抗病毒的作用。如HBV[1]、HCV[2]、HIV[3]等。核苷(酸)类似物不能清除病毒,但可通过长期抑制病毒复制,耗尽病毒库的方式,达到清除病毒的目的。核苷(酸)类似物治疗的理想停药时机是体内病毒库被耗尽,这就促使临床对核酸检测灵敏度无限高的期望(检测下限无限地接近于0)[4]。有研究证实[5],抗HBc阳性的隐匿性HBV感染的献血者血液中含有0.15 IU/mL的HBV DNA,即可导致受血者感染。当前临床检测技术采用磁珠法富集核酸[6-7],以提高原始样本扩增量。数字PCR技术[8]采用流体芯片或微滴技术等方式分配成单拷贝靶核酸扩增,通过计数阳性孔数目的方式进行核酸绝对定量检测。我们采用批分析(多管同测)法对低浓度(载量)样本进行核酸扩增检测,以期建立一种新的低浓度(载量)核酸检测方法。
1 材料与方法
1.1 样本来源 我院就诊患者HBV DNA检测后剩余血清约1.5 mL,检测结果约2×103IU/mL。
1.2 仪器功与试剂 SlAN-96S全自动医用PCR分析系统(上海宏石医疗科技有限公司)。乙型肝炎病毒核酸实时荧光定量PCR检测试剂(批号:2021019,圣湘生物科技股份有限公司);核酸释放剂(批号:2021019,圣湘生物科技股份有限公司);细胞保存液(批号:12021003,圣湘生物科技股份有限公司)。
1.3 实验方法
1.3.1 将上述样本分装在离心管中-20±5℃冷冻保存,每管130μL。
1.3.2 梯度浓度样本盘的选择 取一份样品用细胞保存液稀释成1∶10、1∶100、1∶1 000、1∶10 000的梯度浓度样本,用乙型肝炎病毒核酸实时荧光定量PCR检测试剂扩增检测上述梯度浓度样本,各平行检测3管。
取三管均阳性的最低浓度(1∶100)样本,再用细胞保存液稀释成1∶100、1∶200、1:400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800、1∶25 600的梯度浓度样本,然后用乙型肝炎病毒核酸实时荧光定量PCR检测试剂扩增检测该梯度浓度样本,各平行检测10管,选择全部阳性的最低浓度样本为S1(1∶200)、然后依次S2(1∶400)、S3(1∶800)、S4(1∶1 600)、S5(1∶3 200)、S6(1∶6 400)、S7(1∶12 800)形成梯度浓度样本盘。
1.3.3 梯度浓度样本盘的检测 用乙型肝炎病毒核酸实时荧光定量PCR检测试剂检测上述梯度浓度样本盘S1~S7,每批各样本平行测10管,每天检测4~6批,共计检测20批次。
每一批次设定量参考品4个(A:4×107IU/mL、B:4×106IU/mL、C:4×105IU/mL、D:4×104IU/mL)、阳性对照和阴性对照各1个。
1.3.4 质量控制 (1)乙型肝炎病毒(HBV)阴性对照:无Ct值显示;但乙型肝炎病毒(HBV)-内标检测为阳性(Ct≤40);(2)乙型肝炎病毒(HBV)阳性对照:检测浓度介于1.26×105-1.26×106IU/mL;(3)四个乙型肝炎病毒(HBV)定量参考品均检测为阳性,且标准曲线相关系数|r|≥0.98;(4)以上要求需在同一次实验中同时满足,否则,本批次实验无效。
1.3.5 阳性判断标准 检测到典型的S型扩增曲线,且Ct≤40,判断为阳性。
1.3.6 批分析阳性与批分析阴性 批分析阳性,批分析中至少有一管阳性即该批分析阳性。批分析阴性,批分析中无阳性管即该批分析阴性。
1.3.7 1copy/管Ct变异区间确定 上述实验中,选择所有批次检测中无Ct值检测管>20%的各浓度水平阳性管Ct集合,按偏态分布90%CI确定为1copy/管Ct变异区间。
1.4 统计学处理 采用永中Excel进行数据及图表处理。计数资料采用百分率,计量资料采用(±s),精密度采用CV。1copy/管Ct分布区间的确定采用偏态分布90%CI。
2 结果
2.1 乙型肝炎病毒核酸实时荧光定量PCR检测试剂基本信息 乙型肝炎病毒核酸实时荧光定量PCR检测试剂扩增循环参数,见表1。样本释放剂5μL加样本5μL,用移液器吸打3~5次混匀,静置10 min后,加入PCR混合液(乙型肝炎病毒核酸PCR反应液38μL加酶混合液2μL加内标0.2 μL)上机扩增。检测通道FAM;内标通道VIC;参比通道ROX。

表1 乙型肝炎病毒核酸实时荧光定量PCR检测试剂扩增循环参数
2.2 质量控制 各检测批次阴性对照均阴性且内标为阳性(Ct<40),阳性对照结果1.4244~4.5304×105IU/mL,四个乙型肝炎病毒(HBV)定量参考品均检测为阳性,且标准曲线相关系数|r|=0.99684~1。阳性对照、定量参考品测定管Ct统计,见表2。

表2 阳性对照、标准品C t统计
2.3 1copy/管Ct分布区间确定 所有批次检测中无Ct值检测管>20%的各浓度水平(S3~S7)阳性管Ct集合,见图1。以S3~S7阳性管Ct集合为样本,按偏态分布90%CI确定的1copy/管Ct变异区间为38.24~40。

图1 所有批次检测中无Ct值检测管>20%的各浓度水平(S3~S7)阳性管C t集合(升序折线图)
2.4 各浓度各批次阳性测定管数统计 S1~S7单管检测阳性检出率分别为:92%、71%、35%、25.5%、12%、6%、4.5%,批分析阳性检出率分别为:100%、100%、85%、90%、60%、40%、40%。见表3。
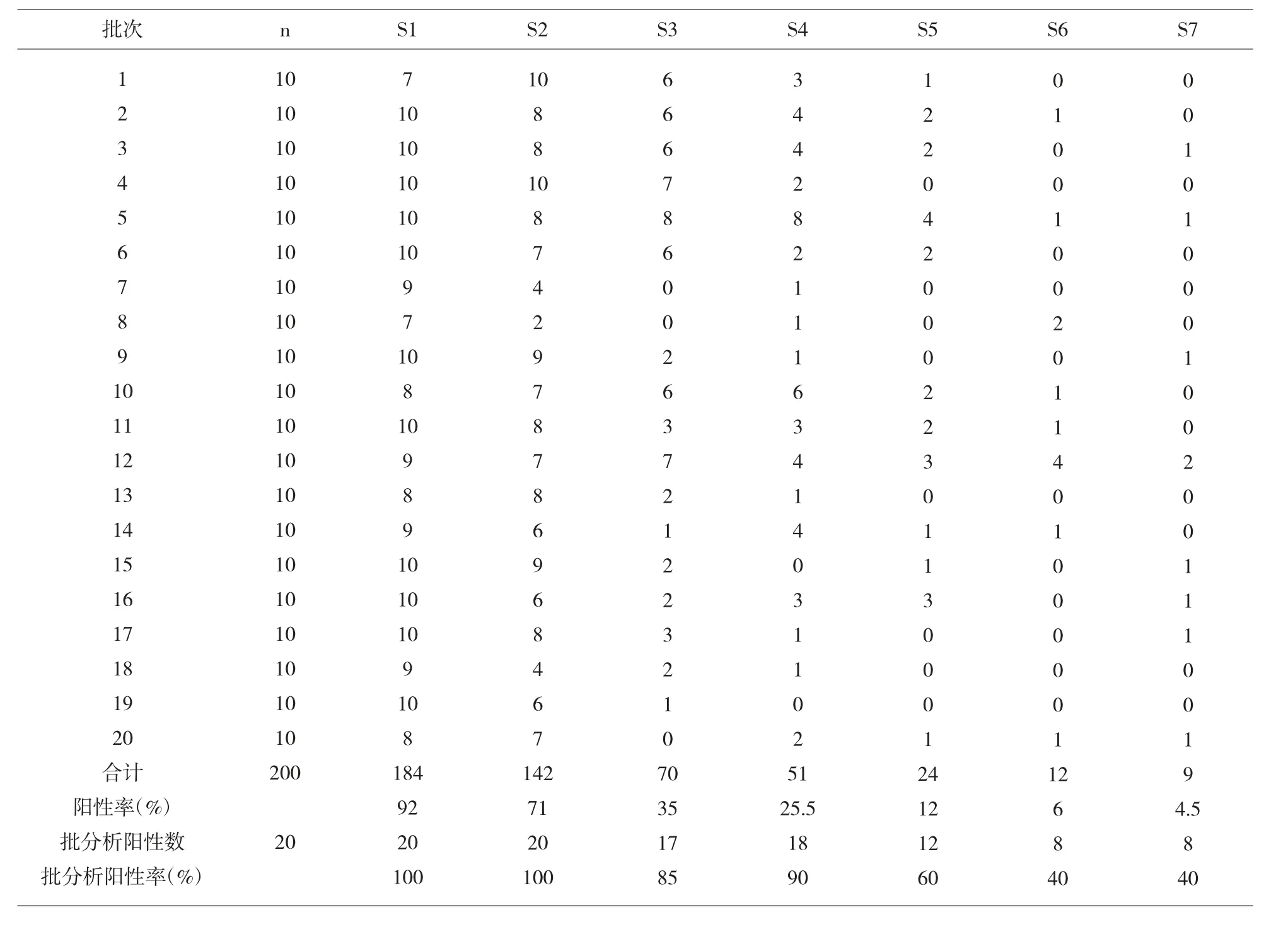
表3 各浓度各批次阳性测定管数统计
3 讨论
本研究中,1 copy/管Ct变异区间指的是每支扩增管中只有1 copy靶核酸时扩增的Ct变异分布范围。此时的Ct变异不表示进入扩增管靶核酸的多寡,而是表达核酸扩增及扩增效率的随机性。因此,在临床检测中,当Ct处于1 copy/管Ct变异区间时,不应用常规的标准曲线法定量,而应当以1copy/管的方法定量,此方法与数字PCR类似[9]。影响核酸扩增效率的因素较多,包括试剂因素、靶核酸因素及仪器因素等。因此,建议1 copy/管Ct变异区间应由各临床实验室实验确定。
在确定1 copy/管Ct变异区间时,应尽量避免或减少将非1 copy/管Ct变异区间的Ct纳入。为此,本研究采用了两种措施(1)以所有批次检测中无Ct值检测管>20%的各浓度水平阳性管Ct集合为样本,(2)选用偏态分布90%CI。本研究显示,选择S3~S7阳性管Ct集合为样本的1 copy/管Ct变异区间为38.24~40。
本研究用常规的方法检测低浓度(载量)核酸样本,当样本浓度低于试剂检测下限时,采用单管检测可能不是每一次都有靶核酸进入扩增体系,若采用批分析(多管同测)法,每增加一管,被检测的样本总量都相应的增加,靶核酸被检出的概率也就相应地增加。结果显示,本研究S1~S7单管检测阳性检出率分别为:92%、71%、35%、25.5%、12%、6%、4.5%,批分析阳性检出率分别为:100%、100%、85%、90%、60%、40%、40%。
低浓度(载量)核酸样本,采用批分析(多管同测)法检测,在不改变单管扩增体系环境的条件下,增加了实际扩增分析的样本总体积,从而提高了分析的灵敏度,具有更高的阳性检出率。批分析检测管数的选择可根据实际需求个性化确定。现有的超敏核酸检测场景,多采用富集核酸的技术制备核酸模板,需要使用专用设备及试剂。本研究方法采用常规核酸检测试剂,无需专用设备,可提高基层检测单位的超敏检测需求的可及性。在已有超敏核酸检测场景的实验室,在此基础上,采用该多管同测扩增检测的技术可达到更高的灵敏度。在有超敏检测需求的患者,如核苷(酸)类似物治疗终点选择时可以采用该研究方法,为治疗终点抉择提供更为灵敏的参数支持。该研究方法主要用于临床低浓度(载量)核酸样本检测,样本无需稀释,只要同时检测多管。
本研究中,所有批次检测中,标准品相关系数|r|在0.99684~1之间波动,单个测定点Ct的CV小于1%,阳性对照Ct的CV小于1%,阴性对照均阴性,表明在常规检测浓度区域(中、高浓度区域),试剂性能稳定,结果重复性好,与相关研究一致[10]。在该浓度区域,单管检测能满足临床需求,无需多管检测。
综上所述,实验室应实验确定各核酸定量项目的1 copy/管Ct变异区间;当Ct处于1 copy/管Ct变异区间时,不应用常规的标准曲线法定量,而应当以1copy/管的方法定量;采用批分析(多管同测)法检测低浓度(载量)核酸样本可提高阳性检出率。当然,该方法还需要在大量的临床检测中验证。另外,批分析(多管同测)法是一种样本处理方法,广泛适用于核酸扩增检测的诸多领域,其在丙型肝炎病毒核酸检测、人类免疫缺陷病毒核酸检测、循环核酸肿瘤标志物检测等有超敏检测需求的各领域,也有待于广泛的临床检测验证。

