改性豆渣膳食纤维的理化性质、结构及其益生活性研究
尹立晨,童群义
(江南大学 食品学院,江苏 无锡,214122)
膳食纤维被称为第七大营养素,根据其溶解性可分为可溶性膳食纤维(soluble dietary fiber,SDF)和不溶性膳食纤维(insoluble dietary fiber,IDF)[1]。与IDF相比,SDF具有更多的功能特性,通常也会提供更好的质地和口感,因此常用于食品加工。豆渣含有丰富的蛋白质、脂肪、膳食纤维等,是天然的膳食纤维来源,其可食性和安全性已被人们认可。但豆渣膳食纤维(okara dietary fiber,ODF)大多是不溶性的,SDF含量低限制了其在食品工业中的应用[2]。因此,需要对ODF进行改性处理以提高其SDF含量,在增强其适口性的同时,强化其功能特性。
目前,ODF改性主要有3种方法,即物理法、化学法和酶法。高速剪切(high-speed shearing,HSS)是一种物理改性方法,它通过强烈的剪切、分散、冲击和湍流作用,使原料在剪切缝中被剪切、压缩和折叠。因此,原料能在短时间内得到良好的微粉化、乳化、混合和均匀化。基于上述优势,HSS已成功应用于食品工业,用于分解果胶、降解壳聚糖和番茄纤维的结构修饰[3-5]。酶处理可使纤维素、半纤维素分子分解成小分子糖或单糖,并且处理工艺条件温和、特异性强、反应时间短、副产物少、纯度高。已有研究表明,相较于纤维素酶或木聚糖酶的单一酶解改性,复合酶处理更能显著地提高SDF的含量[6]。然而,酶处理过程中酶与底物的接触不均匀常会导致酶解改性效果不显著。因此,近年来,也出现了一些联合改性方法。高辰等[7]采用酶解和挤压结合处理ODF,与单独处理相比,2种方法结合处理后的ODF粒度更小,黏度更低,抗氧化能力、吸附胆固醇和阳离子交换能力更高。
膳食纤维虽然难以被人体消化吸收,但可被益生菌部分或全部发酵,促进肠道内有益菌增殖,进而维护肠道健康[8]。王津等[9]研究发现,茶叶膳食纤维可显著增加乳酸菌、双歧杆菌数量,同时显著降低肠杆菌、肠球菌和产气荚膜梭菌的数量。ODF作为一种来源广且安全性高的膳食纤维,关于其促进益生菌生长的研究鲜有报道。因此,本文采用高速剪切、复合酶解、高速剪切协同酶解改性ODF,并比较3种改性方法对ODF理化性质、结构以及益生活性的影响,旨在为提高ODF的益生活性和豆渣资源的综合开发提供理论依据。
1 材料与方法
1.1 材料与试剂
豆渣,上海清美绿色食品有限公司,其基本组成成分如下:水分(8.26±0.31)%、灰分(4.42±0.33)%、脂肪(1.76±0.18)%、蛋白质(14.30±0.49)%、总膳食纤维(total dietary fiber,TDF)(69.88±1.04)%、IDF(67.16±1.38)%、SDF(2.32±0.17)%;木瓜蛋白酶(100 U/mg)、纤维素酶(50 U/mg)、木聚糖酶(50 U/mg),苏州卓鑫生物科技有限公司;玉米油,益海(泰州)粮油工业有限公司;菊粉,淄博益生康缘生物科技有限公司;95%乙醇(分析纯)、葡萄糖(分析纯),国药集团化学试剂有限公司;嗜酸乳杆菌(LactobacillusacidophilusATCC 4356)、乳双歧杆菌(Bifidobacteriumanimalissubsp.LactisATCC 700541),广东省微生物菌种保藏中心。
1.2 仪器与设备
GFX-GF-101-2BS 电热鼓风干燥箱,上海跃进医疗器械厂;AB104-N 电子分析天平、梅特勒FE28K pH计,梅特勒-托利多仪器有限公司;SF-100 不锈钢高速粉碎机,上海船浜制药粉碎设备厂;HH-2k8 恒温水浴锅,巩义市予华仪器有限公司;RJ-LD-50G 低速离心机,无锡市瑞江分析仪器有限公司;致微GI80T 立式自动压力蒸汽灭菌器,厦门致微有限公司;R205B 旋转蒸发仪,上海申顺科技有限公司;T18 数显型分散机套装,广州仪科实验室技术有限公司;SCIENTZ-18 N 冷冻干燥机,宁波新芝生物科技股份有限公司;S3500 激光粒度分析仪,美国Microtrac公司;SU8100 冷场发射扫描电子显微镜,日本株式会社日立高新技术;IS10D2 傅里叶红外光谱仪,美国Nicolet公司;PHASER X射线衍射仪,德国布鲁克AXS有限公司;SW-CJ-1F 超净工作台,苏州净化有限公司;AW500SG 厌氧工作站,英国Electrotek公司;GH-400BC 隔水式恒温培养箱,北京市永光明医疗仪器厂。
1.3 试验方法
1.3.1 ODF的制备
参考张慧霞[10]的方法并稍作修改,称取新鲜豆渣,在60 ℃下烘干,用粉碎机粉碎后过100目筛得到豆渣粉。按料液比1∶20 (g∶mL)加入蒸馏水搅拌均匀,再加入1%木瓜蛋白酶,55 ℃酶解2 h后沸水灭酶5 min,在4 500 r/min下离心15 min,收集沉淀,冷冻干燥,粉碎得到ODF。
1.3.2 ODF的改性
1.3.2.1 高速剪切法
取制备好的ODF,按料液比1∶25(g∶mL)加入蒸馏水搅拌均匀,以15 000 r/min的速率剪切分散15 min。倒入4倍体积的95%(体积分数)乙醇溶液,静置醇沉12 h,在4 000 r/min下离心10 min,收集沉淀,冷冻干燥得到样品,记为H-ODF。
1.3.2.2 复合酶解法
取制备好的ODF,按料液比1∶25(g∶mL)加入蒸馏水搅拌均匀,再加入质量分数1.6%的复合酶[m(纤维素酶)∶m(木聚糖酶)=1∶1],用浓度为0.1 mol/L的HCl溶液调节pH至5.0,55 ℃酶解2 h后沸水灭酶5 min,倒入4倍体积的95%乙醇溶液,静置醇沉12 h,在4 000 r/min下离心10 min,收集沉淀,冷冻干燥得到样品,记为E-ODF。
1.3.2.3 高速剪切协同酶解法
取制备好的ODF,按料液比1∶25(g∶mL)加入蒸馏水搅拌均匀,以15 000 r/min的速率剪切分散15 min,再加入1.6%的复合酶[m(纤维素酶)∶m(木聚糖酶)=1∶1],用浓度为0.1 mol/L的HCl调节pH至5.0,55 ℃酶解2 h后沸水灭酶5 min,倒入4倍体积的95%乙醇溶液,静置醇沉12 h,在4 000 r/min下离心10 min,收集沉淀,冷冻干燥得到样品,记为HE-ODF。
1.3.3 改性豆渣膳食纤维的理化性质
1.3.3.1 持水力(water holding capacity,WHC)测定
参考胡筱等[11]的方法,称取样品1 g于50 mL离心管中,加入25 mL蒸馏水,振荡均匀,室温下静置24 h,4 000 r/min离心20 min,弃去上清液,用滤纸吸干残液,称重。WHC计算如公式(1)所示。
(1)
式中:m0,样品干重,g;m1,离心管质量,g;m2,吸水后样品和离心管质量,g。
1.3.3.2 膨胀力(swelling capacity,SC)测定
参考胡筱等[11]的方法,称取样品1 g于50 mL量筒中,测定干样体积,加入30 mL蒸馏水,搅拌均匀,室温下静置24 h,测定膨胀后体积。SC计算如公式(2)所示。
(2)
式中:m0,样品干重,g;V0,干样体积,mL;V1,膨胀体积,mL。
1.3.3.3 持油力(oil holding capacity,OHC)测定
参考牛希等[12]的方法,称取样品1 g于50 mL离心管中,加入25 mL玉米油,振荡均匀,室温下静置24 h,4 000 r/min离心20 min,弃去上层油,用滤纸吸干残液,称重。OHC计算如公式(3)所示。
(3)
式中:m0,样品干重,g;m1,离心管质量,g;m2,吸油后样品和离心管质量,g。
1.3.4 粒径分析
称取样品10 mg于烧杯中,加入10 mL蒸馏水,超声分散均匀后,设定样品和水的折射率分别为1.470和1.330,用激光粒度仪测定其颗粒的粒径分布状况。
1.3.5 扫描电子显微镜分析
取少量样品,用双面导电胶固定在样品台上,洗耳球轻吹样品表面,然后离子溅射喷金,置于扫描电子显微镜观察台上进行微观结构观察。设置加速电压为3 kV,放大倍数为3 000倍。
1.3.6 傅里叶红外(Fourier transform infrared,FT-IR)光谱分析
称取样品1 mg于玛瑙研钵中,加入100 mg溴化钾晶体,在红外灯照射下轻轻研磨至极细,使用手动压片机压制成薄片,立即在400~4 000 cm-1下进行红外光谱扫描,测定FT-IR光谱曲线。
1.3.7 X-射线衍射分析
取适量样品,磨细后放入样品槽,用表面光滑的玻璃板压实表面,将样品槽插入仪器测定。测定参数为:靶型Cu靶,管电流10 mA,管电压30 kV,步宽0.02°,扫描速率6°/min;扫描范围:5~60°。
1.3.8 改性豆渣膳食纤维的体外发酵
参考张梦云[13]的方法,按质量分数2%分别加入葡萄糖、菊粉、ODF、H-ODF、E-ODF、HE-ODF至MRS培养基振荡溶解,高压灭菌。分别取嗜酸乳杆菌、乳双歧杆菌冻干粉接种于10 mL灭菌的MRS培养基中,培养12 h。再取1 mL活化后的菌液,摇匀,分别接种于10 mL添加不同碳源的液体培养基中,在厌氧条件下37 ℃恒温培养箱中培养72 h,定时取菌液测定活菌数和pH值。
1.4 数据处理和分析
每组实验重复3次,结果以(平均值±标准差)表示,采用SPSS 25.0进行数据分析,采用Origin 2018进行绘图。
2 结果与分析
2.1 改性豆渣膳食纤维的基本成分
由表1可知,改性处理对ODF的水分、灰分、脂肪、蛋白质均无显著性影响。3种改性方法均轻微提高了TDF的含量,而SDF质量分数经改性后则有显著增加(P<0.05),相应的IDF质量分数降低,表明改性处理使得部分IDF转化为SDF。3种改性样品中,HE-ODF组的SDF质量分数最高,显著高于单独采用酶法改性组,由此表明,高速剪切处理可以提高酶对底物的作用效率,使更多的纤维素、半纤维素等不溶性成分水解为可溶性小分子。
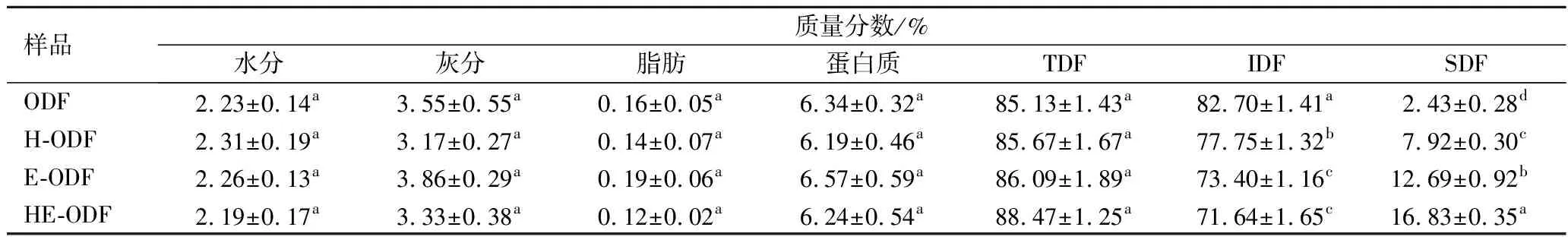
表1 不同方法改性ODF前后的基本成分Table 1 Chemical components of raw and modified okara dietary fiber
2.2 改性豆渣膳食纤维的理化性质
WHC和SC反映了膳食纤维的水合能力,是衡量膳食纤维保水性能的重要指标。由图1可知,经3种方法改性后,ODF的WHC和SC均有不同程度的提高,其中复合酶法改性效果优于高速剪切法,WHC从改性前的(5.49±0.17)g/g分别提高到了(5.95±0.22)和(6.58±0.05)g/g,SC由(6.16±0.22)mL/g分别提高到了(6.51±0.11)和(7.22±0.16)mL/g,而两者协同处理的改性效果最佳,WHC和SC分别为(7.89±0.12)和(7.39±0.19)mL/g。膳食纤维的水合能力通常受纤维的结构和水结合位点的数量影响[14],经高速剪切处理后由于纤维粒径减小,结构变得疏松多孔,释放了更多的水结合位点,因此具有更好的捕获水的能力。而复合酶解则可以打破半纤维素和纤维素之间的β-糖苷键,使得羟基、羧基和氨基等更多的亲水基团暴露出来,因此可以结合更多的水分子。有研究表明,膳食纤维的水合能力与SDF的含量呈正相关[15],上述结果与改性前后膳食纤维的SDF含量测定结果一致,进一步证实了这一结论。
OHC反映了膳食纤维结合油的能力,高OHC值有利于食品在加工过程中保留油脂。由图1可知,高速剪切和酶法改性都能显著提高ODF的OHC,从改性前的(2.13±0.08)g/g分别提高到了(2.47±0.06)和(3.26±0.11)g/g。有研究表明,OHC与纤维颗粒的表面结构、疏水性和总电荷密度有关[16]。高速剪切和复合酶解过程中剪切力和酶的作用使得纤维原本紧密的结构变得疏松,比表面积增大,孔隙增多,因此油滴更容易被吸附。

图1 不同方法改性ODF前后的理化性质Fig.1 Physicochemical properties of raw and modified okara dietary fiber注:不同小写字母表示差异显著(P<0.05)
2.3 改性豆渣膳食纤维的粒径分布
ODF改性前后的粒径分布如图2所示,改性后ODF的粒径分布图的峰均有不同程度的往左偏移,说明3种改性方法均可有效地使ODF的粒径减小。对于未经改性处理的ODF,其粒径主要分布在6.54~837.10 μm,主峰处所对应的粒径为176 μm,其微分分布为8.57%,相对而言粒径较大,分布范围较广;经高速剪切改性后ODF的粒径分布相对集中,峰较窄,所对应的粒径为104.6 μm,其微分分布为9.29%;而经复合酶解改性后的ODF出现了2个峰,对应的粒径分别为73.99和26.16 μm,其微分分布分别为8.95%和5.66%;两者协同改性的ODF峰较未改性向左偏移得最多且分布变宽,说明纤维颗粒被破碎得最为明显且大小越来越均匀。
将ODF改性前后粒径分布数据进行统计处理,结果如表2所示。高速剪切和复合酶解改性后ODF的D[4,3]由170.97 μm分别下降为123.85和68.13 μm;而两者协同处理后,ODF的D[4,3]更是下降到只有27.10 μm,说明高速分散处理破坏了豆渣纤维基质,使其变得不连续且疏松,而纤维素和半纤维素在复合酶的作用下水解成小分子。减小的粒径和增加的表面积促进了酶促水解和结构崩溃。已有研究表明,小粒径和大表面积更易被益生菌发酵利用[17]。因此,通过改性处理,ODF的小颗粒可为益生菌提供更多的吸附表面积,在发酵过程中为益生菌的生长提供碳源,其作为益生元的潜力增大。
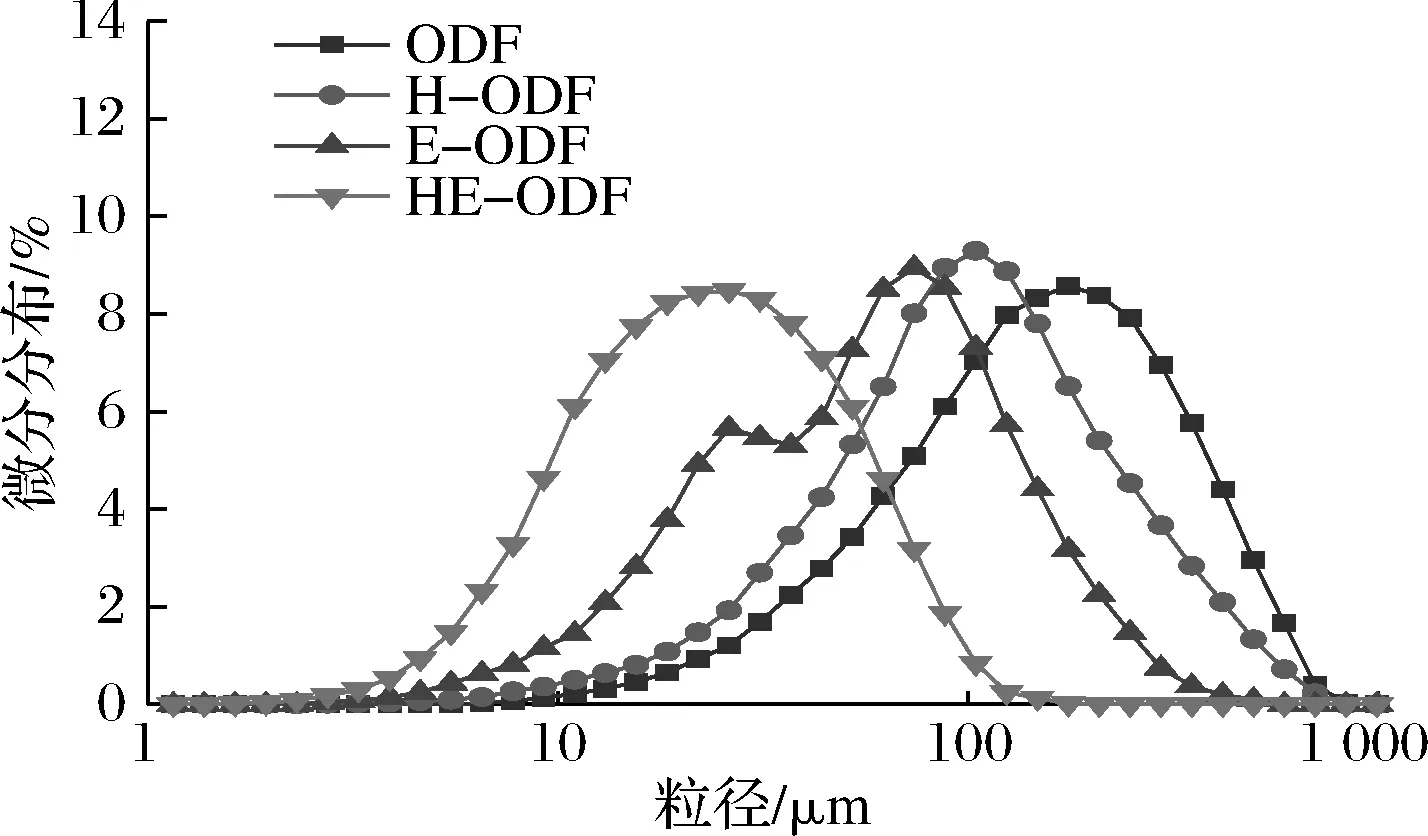
图2 不同方法改性ODF前后的粒径分布Fig.2 Particle size distribution of raw and modified okara dietary fiber
表2 不同方法改性ODF前后的粒径分布

单位:μm
2.4 改性豆渣膳食纤维的微观结构
ODF改性前后放大3 000倍的微观结构如图3所示。未改性的ODF结构紧密,表面光滑无裂缝,并有部分粗颗粒附着,可能是残余的蛋白颗粒[6];H-ODF的结构较为松散,表面褶皱和裂纹增多,由此表明强烈的剪切作用促进了纤维颗粒的破裂,形成了较大的孔隙率;E-ODF的表面结构呈现蜂窝状的多孔性特征,这可能是纤维素和半纤维素的酶解导致纤维网状结构被破坏并显著提高其表面的粗糙程度;HE-ODF的表面结构最不规则且最粗糙,凹陷和褶皱明显,比表面积增大,暴露出了更多的活性基团,同时,纤维分子断裂导致分子质量降低,聚合度减小,这说明剪切后再进行酶解处理可以使酶作用更深入纤维分子内部,使原来排列紧密的纤维素分子结构变得更加疏松,这与YU等[18]改性胡萝卜皮渣不溶性膳食纤维的结构表征结果相似。改性后,HE-ODF的松散结构、大表面积以及多孔性特征为其与水、油脂和益生菌的吸附结合提供了微观结构基础,因而提高了其持水力等理化性质以及益生菌对其发酵利用的能力。

a-ODF;b-H-ODF;c-E-ODF;d-HE-ODF图3 不同方法改性ODF前后的扫描电子显微镜图Fig.3 SEM images of raw and modified okara dietary fiber
2.5 改性豆渣膳食纤维的FT-IR光谱分析
如图4所示,改性前后ODF的FT-IR光谱大致相似,呈现典型的纤维类多糖特征吸收峰,只在一些特征波段存在差异。其中3 434 cm-1附近较强的吸收峰是纤维素、半纤维素的O—H伸缩振动,改性后其强度有所减弱,可能是纤维素分子间的氢键断裂引起[19]。2 927 cm-1处的弱峰是多糖甲基和亚甲基上的C—H伸缩振动。1 646 cm-1处是木质素中苯环的特征吸收峰,1 250和1 050 cm-1处是纤维素和半纤维素的2种C—O伸缩振动峰,经剪切、酶解改性后,所对应的峰强度均有所下降,表明ODF中一部分纤维素、木质素被降解,此结果与YANG等[20]的研究结果一致。此外,673 cm-1附近的小吸收峰减弱甚至消失了,可能是一些不溶性纤维在降解后溶出,离开了原有的ODF结构。

图4 不同方法改性ODF前后的傅里叶红外光谱图Fig.4 FTIR spectra of raw and modified okara dietary fiber
综上,高速剪切和酶解改性处理并未改变ODF的基本化学结构,同时,一些特征峰强度之间的差异表明了改性处理有效地去除了ODF中纤维素、木质素等不溶性成分。
2.6 改性豆渣膳食纤维的X射线衍射
如图5所示,改性前后ODF的X射线衍射图像在形状上相似,均在衍射角16和22°左右处有显著的结晶衍射峰,在34°处有1个弱衍射峰,显示出典型的Ⅰ型纤维素晶体构型。由此说明无论是高速剪切还是复合酶解处理,均未改变ODF的晶体构型。其中,H-ODF较ODF的衍射峰强度减弱且峰宽增加,表明结晶度减小。强烈的剪切作用导致ODF纤维素和半纤维素的晶体结构被破坏,从而引起ODF结晶度的降低。CHEN等[21]也报道了类似的结果,干介质研磨降低了糯米淀粉的粒度和结晶度。而E-ODF较ODF的衍射峰强度增加且峰型变尖锐,表明结晶度增加。纤维素由D-吡喃葡萄糖单元通过β-1,4糖苷键连接而成,具有结晶部分和无定形部分;半纤维素通常与纤维素微纤维相连,具有随机和无定形结构,并且强度很小,很容易被各种半纤维素酶水解[22]。因此可以推断,E-ODF结晶度的增加主要是由于半纤维素和纤维素中的无定形部分水解造成的。
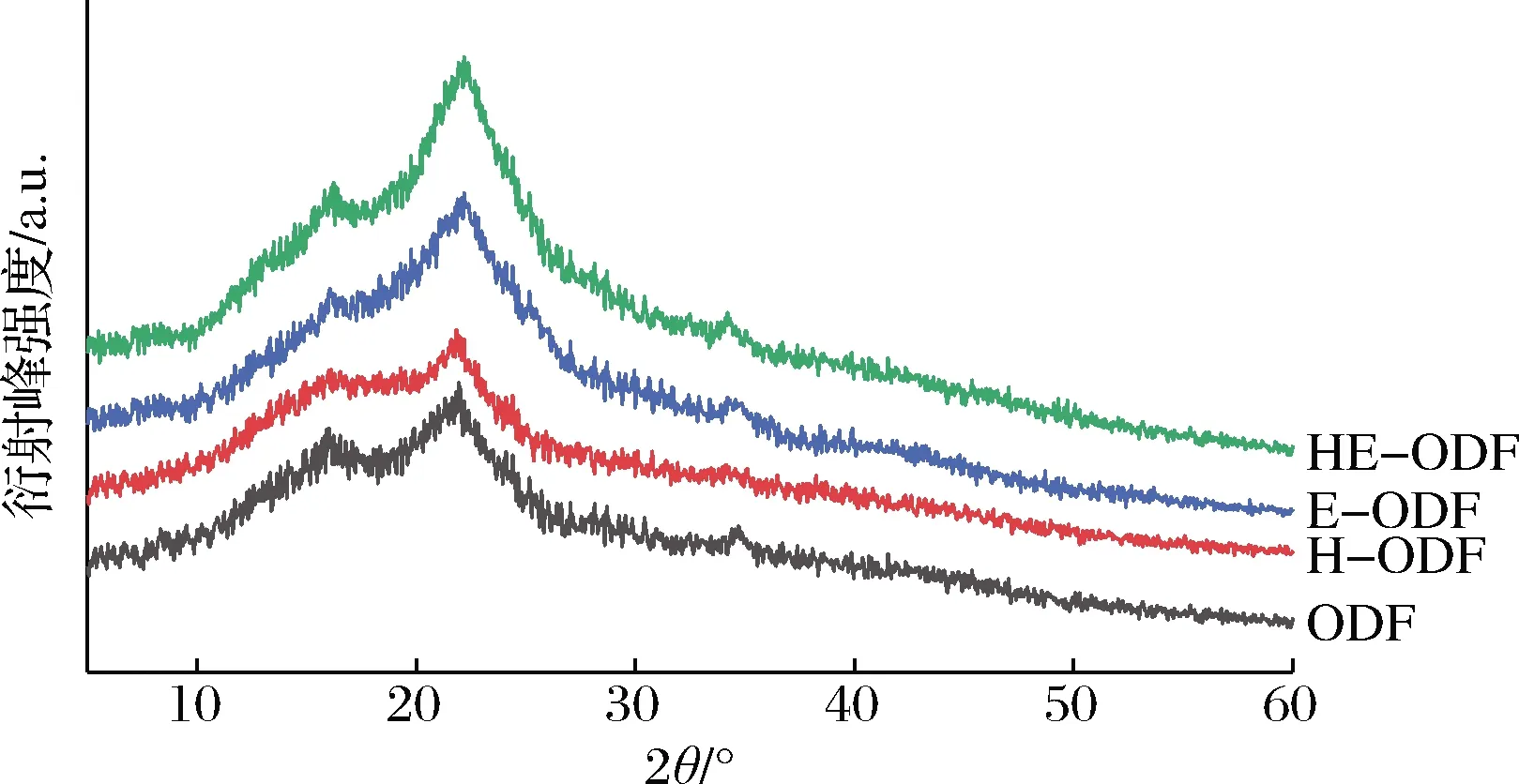
图5 不同方法改性ODF前后的X射线衍射图Fig.5 X-ray diffraction diagram of raw and modified okara dietary fiber
2.7 改性豆渣膳食纤维的体外益生活性
2.7.1 改性豆渣膳食纤维对益生菌生长曲线的影响
由图6-a可知,在以葡萄糖和菊粉为碳源的培养基中,嗜酸乳杆菌在0~24 h和0~36 h生长迅速,之后活菌数显著下降,这是由于葡萄糖和菊粉溶解性高,作为碳源更易被菌利用,但在达到最大生长量后,培养基内碳源的减少和酸度的增加导致菌生长受到抑制,活菌数减少。在以未改性和改性后的ODF为碳源的培养基中,嗜酸乳杆菌在0~36 h的生长初期虽然长势不如葡萄糖和菊粉培养基,但在36~72 h的生长后期仍能保持增长,这表明膳食纤维的碳源供应持久性优于葡萄糖和菊粉。未改性和3种不同改性方法处理的ODF对嗜酸乳杆菌的生长促进作用不同,具体表现为HE-ODF>E-ODF>H-ODF>ODF。这表明,ODF经改性处理后,更易被益生菌利用,其作为益生元的潜力提高。由图6-b可知,乳双歧杆菌在不同碳源中的生长变化情况与嗜酸乳杆菌类似,只是利用效率较嗜酸乳杆菌低一些,这可能是由于不同菌种的酶分泌基因不同导致其对不同碳源的利用能力产生差异[23]。此外,不同菌种对逆环境的耐受能力不同也会导致其对菌种的生长增殖产生影响[24]。
综上可知,ODF相较于葡萄糖和菊粉,可为嗜酸乳杆菌和乳双歧杆菌生长增殖提供更加持久的碳源供应,从而维持活菌数量的稳定。ODF的发酵性能受SDF组分含量、粒径、表面积、结晶度等因素的影响[25]。与ODF相比,H-ODF、E-ODF和HE-ODF表现出更强的促益生菌生长能力,且HE-ODF的能力更强,甚至在72 h后优于菊粉,这可能是因为改性后ODF中可溶性组分含量提高、粒径减小、表面积增大,从而更易被益生菌吸附利用,并在较长的发酵时间内为益生菌的生长增殖持续提供碳源。

a-嗜酸乳杆菌;b-乳双歧杆菌图6 两种益生菌在不同碳源培养基中的生长曲线Fig.6 Growth curve of two probiotics in medium with different carbon sources
2.7.2 改性豆渣膳食纤维对益生菌发酵过程中pH的影响
由图7可知,随着培养时间的增加,2种益生菌在各个培养基中的pH都在不断下降。其中,空白培养基的pH在整个发酵过程中仅有轻微的下降,葡萄糖、菊粉和各ODF培养基的pH在0~12 h急剧下降,12~72 h缓慢下降。由生长曲线可知,0~12 h活菌数迅速增长,产酸量增加导致pH快速降低。12 h后,过酸的环境使得益生菌生长受到抑制,活菌数增长减慢,产酸能力减低,pH下降速度放缓[26]。此外,4种ODF培养基中,未改性的ODF培养基pH下降幅度最小,HE-ODF培养基pH下降幅度最大,这进一步证明了ODF经高速剪切协同酶解改性后更容易被益生菌利用,产生更多的游离酸,从而降低pH,在一定程度上抑制人体肠道中有害菌的生长,维持肠道微环境的平衡。
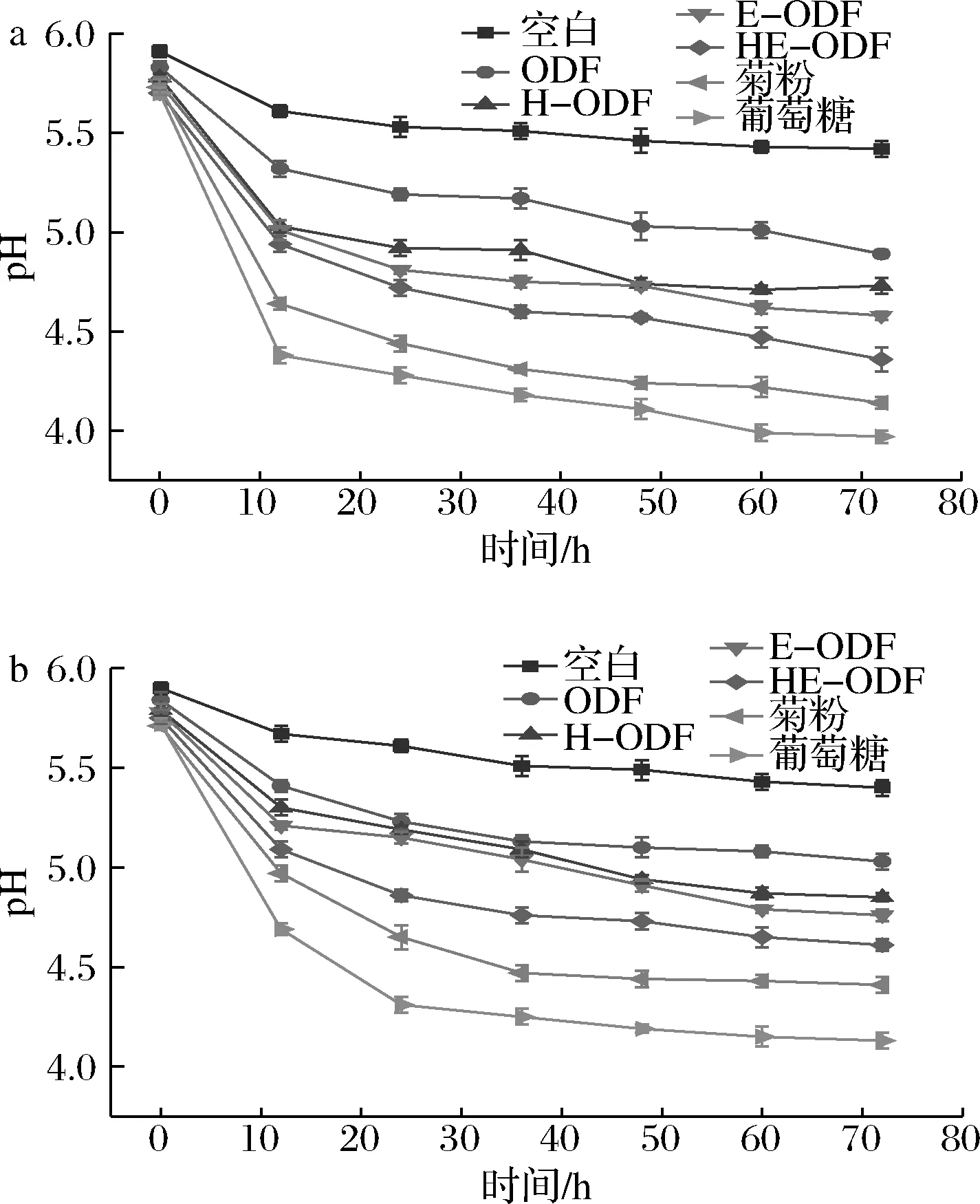
a-嗜酸乳杆菌;b-乳双歧杆菌图7 两种益生菌在不同碳源培养基中pH的变化曲线Fig.7 pH of two probiotics in medium with different carbon sources
3 结论
本文通过高速剪切、复合酶解、高速剪切协同酶解改性ODF,分析了其改性后颗粒结构、理化性质和益生活性的变化。结果表明,3种改性方法均能有效地增加ODF中的可溶性组分含量、减小粒径,同时使其纤维网状结构破坏,褶皱和裂纹增多,暴露出更多的活性基团,进而显著提高其持水性、持油性和膨胀力等理化性质。3种改性方法均能增强ODF对2种益生菌的增殖作用,且对嗜酸乳杆菌的增殖作用较乳双歧杆菌更明显。此外,由于高速剪切协同酶解改性更能细化纤维结构,增加可溶性组分含量,因此其处理的ODF体外益生活性增加最为显著。综上所述,高速剪切协同酶解作为一种优良的ODF改性方法,可为改善ODF理化性质和益生活性提供理论依据。

