短双歧杆菌对Aβ1-42导致的阿尔兹海默症小鼠肠道菌群 及代谢物的影响
朱广素,赵建新,张灏,陈卫,王刚
(江南大学 食品学院,江苏 无锡,214122)
阿尔兹海默症(Alzheimer’s disease,AD)是一种复杂的进行性发展的神经系统疾病,主要症状包括淀粉样蛋白沉积、神经纤维缠结、记忆认知障碍、神经炎症一系列神经退行性病变[1-2]。近十年来,越来越多的研究表明,肠道菌群及其代谢产物通过脑肠轴之间的双向作用,在调节中枢神经系统疾病的脑部功能中发挥重要作用[3-5]。多项临床研究证实轻度认知障碍及AD者肠道菌群结构及组成发生改变[6-8]。此外,有研究阐述了菌群的代谢物,尤其是脂多糖、短链脂肪酸(short-chain fatty acids,SCFAs)、胆汁酸和氨基酸等,能够缓解机体脑神经失调[9-10]。
HWANG等[11]研究发现,给轻度认知障碍的患者膳食补充植物乳杆菌发酵的豆乳,能够调节肠道菌群的紊乱,增加血清中脑源性神经营养因子的含量,从而缓解认知障碍;WANG等[12]发现甘露特钠胶囊能够通过重塑肠道菌群平衡、降低外周相关代谢产物苯丙氨酸/异亮氨酸的积累,减轻脑内神经炎症,进而改善认知障碍,达到治疗AD的效果。益生菌具有调节肠道菌群失调、增强肠道免疫的作用,而精神益生菌是一类摄入后能够给具有神经性疾病的宿主带来精神益处的活体微生物,能够产生及递送神经活性物质作用于脑肠轴,从而发挥有益作用[13]。因此,通过膳食补充益生菌等微生态制剂调节肠道菌群及其代谢产物成为延缓AD进程的新途径[14]。
本研究团队通过采集不同地区不同年龄阶段的人体粪便样品,分离得到了不同来源的短双歧杆菌菌株;采用脑部海马区微注射Aβ1-42蛋白的方法,建立了AD小鼠模型;通过行为学实验筛选得到2株具有改善学习与记忆功能的菌株。基于上述研究结果,为评价不同菌株干预对脑部功能受损的小鼠肠道菌群多样性、物种组成和代谢产物的影响,本研究采用MiSeq二代高通量测序技术,对短双歧杆菌干预后的小鼠肠道菌群的差异进行分析;同时,采用GC-MS,对小鼠粪便中SCFAs(乙酸、丙酸、丁酸)的含量进行测定。
1 材料与方法
1.1 试剂与设备
主要试剂:Aβ1-42蛋白,瑞士Bachem公司;FastDNA Spin Kit for Feces细菌基因组提取试剂盒,美国MP公司;TIANgel Mini Purification Kit胶回收试剂盒,北京天根生化科技有限公司;Quant-iT PicoGreen dsDNA Assay Kit,美国Life Technologies公司;MiSeq Reagent Kit,美国Illumina公司。
主要实验设备:高速冷冻离心机,德国Eppendorf公司;FastPrep-24快速核酸提取仪,美国MP公司;MiSeq测序仪,美国Illumina公司;GC-MS,日本岛津公司;脑立体定位仪,美国Stoelting公司;小动物气体吸入式麻醉机,上海玉研科学仪器有限公司。
1.2 实验菌株
实验用菌株来自于江南大学食品生物技术中心菌种保藏中心(Culture Collection of Food Microorganism,CCFM),菌株具体信息及来源见表1。

表1 菌株信息表Table 1 Strains information
1.3 实验动物
C57BL/6 J雄性小鼠,购于南京大学模式动物研究所,饲养于江南大学实验动物中心[许可证编号为SYXK (SU) 2016—0011]。动物适应1周后,进行脑部微注射手术,术后随机分为4组,每组8只,不限制饮食饮水。饲养环境温度为20~25 ℃,环境湿度为50%~60%,每12 h进行光暗交替。
1.4 实验方法
1.4.1 菌株的培养及菌悬液的制备
将待活化的菌株以2%的接种量接种于含 0.5 g/LL-半胱氨酸盐酸盐的MRS培养基中,置于37 ℃的厌氧工作站中培养20 h。活化2代后,将培养好的菌液在4 ℃下,以8 000×g的转速离心15 min,无菌PBS清洗菌体2遍,调整活菌数为5×1010CFU/mL,用体积分数30%的甘油溶液重悬后,于-80 ℃保藏备用。灌胃前将菌体用等体积无菌PBS缓冲液清洗后,用100 g/L的脱脂乳溶液稀释10倍,每天上午同一时间灌胃1次。
1.4.2 Aβ1-42的溶解及寡聚体的制备
参照JAN等[15]的方法,并按照说明书的要求溶解Aβ1-42:将1 mg Aβ1-42粉末于8 000×g室温离心30 s,加入200 μL 0.1 mol/L 的氨水溶液 (1 mg/mL,pH>9),轻轻振荡溶解至5 μg/μL的工作液,分装保存于-20 ℃冰箱。使用前稀释至2 μg/μL,4 ℃孵育24 h,制备成Aβ寡聚体。
1.4.3 脑部微注射手术方法[16]
小鼠适应1周后,经3%的异氟烷诱导麻醉后,以1%的浓度维持麻醉。将小鼠头顶去毛,用75%酒精消毒后,固定于脑立体定位仪上。暴露头骨,医用棉签取双氧水擦拭颅骨以暴露其前囱的交错十字区,找到前囱位置,做好标记。参照小鼠脑立体定位图谱,于前囱后2.0 mm,中线旁开1.8 mm处,用颅骨钻轻轻打孔。5 μL微量进样器自颅骨表面垂直向下进针2.0 mm,注射样品量为2 μL,进样速度为0.2 μL/min。模型组和益生菌干预组注射寡聚肽Aβ1-42,质量浓度为2 μg/μL,假手术组注射等量无菌PBS。注射后,留针5 min,后缓慢退针。
1.4.4 动物分组与处理条件
动物实验方案见表2。动物实验所涉及的实验操作由江南大学动物实验伦理委员会审批,伦理编号为JN.No20190415c0800618(74)。

表2 动物实验方案Table 2 Protocol of animal experiment
1.4.5 粪便收集及肠道菌群分析
在实验结束前,收集小鼠粪便,按照试剂盒的步骤提取小鼠粪便中细菌基因组。细菌16S rDNA的扩增,扩增产物的纯化、定量及等质量混样,文库构建及上机测序等流程参考先前的研究[17]。
测序完成后,在QIIME平台进行物种分类注释,使用MicrobiomeAnalyst[18]在线网站对数据进行统计和功能分析。
1.5 粪便中SCFAs的测定
用GC-MS检测小鼠粪便中主要的SCFAs(乙酸、丙酸、丁酸)的含量,GC-MS的具体条件参照参考文献[19]。
1.6 数据统计分析
实验数据均用平均值±标准误差(mean±SEM)表示。使用Graphpad Prism 8绘图,并对实验数据进行差异显著性分析。model与control组相比具有显著性用#表示,NMG、MY与model组相比具有显著性用*表示,P<0.05代表具有显著性差异;*或#代表P<0.05,**或##代表P<0.01,***或###代表P<0.001。
2 结果与分析
2.1 小鼠肠道菌群的多样性
2.1.1 α多样性分析
测序共产生3 311 638条高质量的16S rDNA的V3~V4区序列;按照参考序列聚类及97%的相似性划分OTU,共产生221 593个OTU;对所有下机数据进行抽平及标准化后用于后续数据分析。
图1为当前测序量下各组样品的稀释曲线,结果表明,随着测序深度的增加,微生物的种类已接近饱和,故该测序深度已足够满足对粪便中主要细菌分布的探究。所有样品的Shannon指数、Simpson 指数的结果如图2所示。结果表明,model模型组与control对照组相比,α多样性显著降低。灌胃短双歧杆菌NMG与MY均提高了Shannon指数及Simpson指数;其中,NMG组的显著性更高,与control组水平相当,与测序的OTU结果相吻合。

图1 不同组别小鼠肠道菌群的稀释曲线Fig.1 Rarefaction analysis of the gut microbiota in different groups
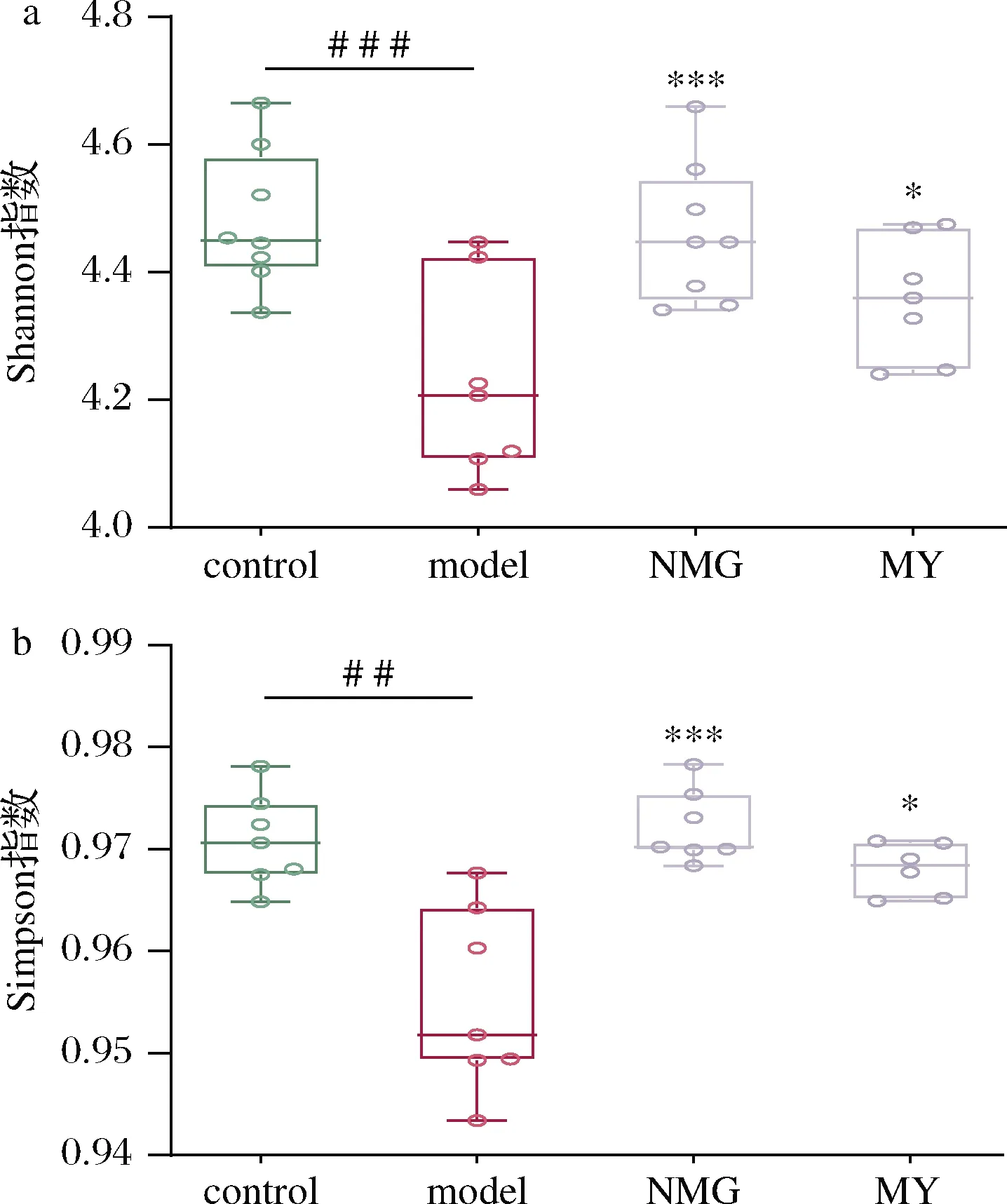
a-Shannon指数;b-Simpson指数图2 短双歧杆菌对代谢综合征小鼠α多样性指数的影响Fig.2 Effects of B.breve on α diversity index in Aβ-injected mice
2.1.2 β多样性分析
基于Bray-Curtis距离对样品进行主坐标分析(principal co-ordinates analysis,PCoA)结果如图3所示。

图3 基于Bray-Curtis距离对样品进行主坐标分析Fig.3 Principal coordinates analysis (PCoA) plots based on Bray-Curtis distance
结果显示,不同颜色代表的组别可以很好的区分,仅PC1和PC2两个坐标轴形成的平面展示了样品间几乎一半的差异,表明不同的干预方式显著改变了小鼠肠道菌群的结构,置换多元方差分析(PERMANOVA)表明各组间存在显著差异(P<0.001)。
PC1可解释样品间所有差异的21.5%,将control组与其他脑部微注射组完全分开,表明PC1反映的条件可能是脑部注射Aβ1-42蛋白的影响;PC2可解释样品间所有差异的18.3%,将短双歧杆菌干预组与model组和control组分开,表明PC2反映的可能是不同干预方式对小鼠菌群结构的影响。
2.2 小鼠肠道菌群结构
2.2.1 短双歧杆菌对小鼠肠道菌群门水平相对丰度的影响
对小鼠粪便的肠道菌群组成进行分析,发现在门水平(图4),主要由Firmicutes、Bacteroidetes、Deferribacteries、Proteobacteria和Actinobacteria组成,其中Bacteroidetes和Firmicutes门的相对丰度最高。
从图5可知,与control组相比,model组Firmicutes和Proteobacteria的相对丰度显著降低,而Bact-eroidetes和Actinobacteria丰度明显升高;而NMG和MY灌胃后能部分逆转菌群的紊乱;同时,2株短双歧杆菌干预显著提高了Tenericutes的相对丰度;此外,TM7在NMG组小鼠肠道中的丰度最高,且与control和model组相比,均具有统计学差异。
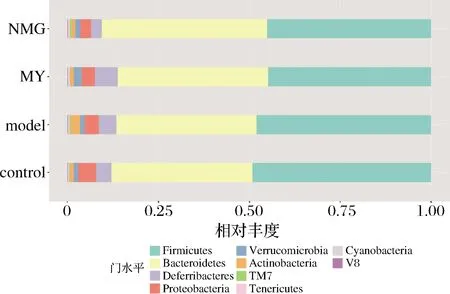
图4 不同组别小鼠肠道菌群在门水平上的组成Fig.4 Composition of gut microbiota in different groups of mice at phylum level
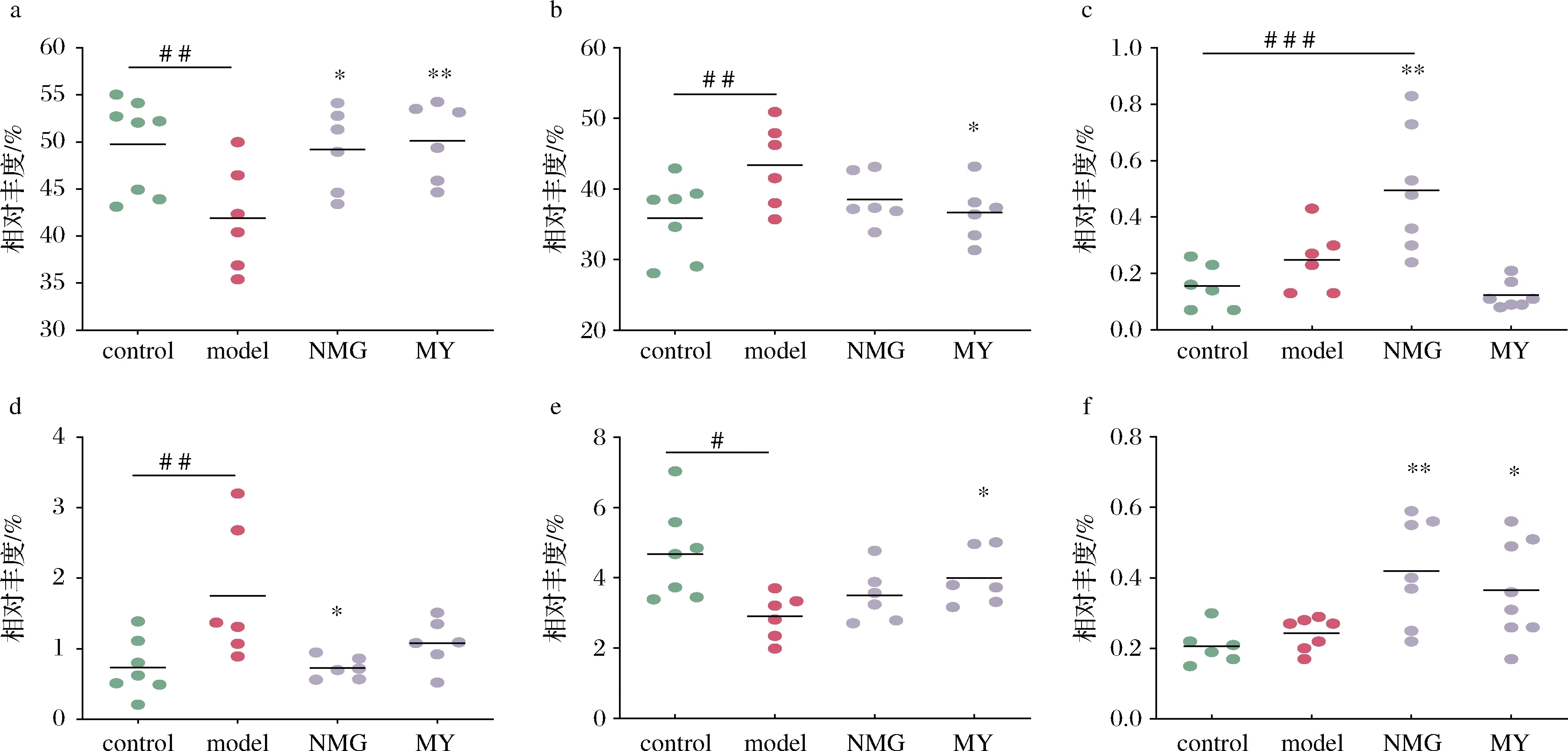
a-Firmicutes;b-Bacteroidetes;c-TM7;d-Actinobacteria;e-Proteobacteria;f-Tenericutes图5 不同组别小鼠菌群主要门的相对丰度的变化Fig.5 Relative abundance of dominant phylum in different groups
2.2.2 短双歧杆菌对小鼠肠道菌群属水平相对丰度的影响
在属水平上,进一步分析小鼠肠道菌群的组成(图6),所有样品中共检测179个属。Firmicutes门作为小鼠肠道中的优势菌群,共包含了76个属。
采用随机森林(random forest)对所有小鼠样品属水平分析(图7),共检出15个特征属,包括Anaeroplasma、Oscillospira、Dehalobacterium、Coprococcus、Rhodococcus、Dorea、Allobaculum、Anaerovorax、Bifidobacterium、Pseudomonas、Mucispirillum、Akkermansia、Adlercreutzia、Roseburia、Lactobacillus,图8所示为特定属的相对丰度的变化。
与control组相比,Aβ1-42注射使小鼠肠道中Oscillospira和Desulfovibrio的含量下降,而Mucispirillum和Coprococcus的丰度显著升高。NMG组小鼠肠道中

图6 不同组别小鼠肠道菌群在属水平上的组成Fig.6 Composition of gut microbiota in different groups of mice at genus level
Allobaculum、Oscillospira和Desulfovibrio的丰度较高,Mucispirillum和Bifidobacterium的丰度较低,与正常组相当;Akkermansia和Coprococcus在MY干预组小鼠肠道中的相对含量明显高于其他组别,且具有统计学差异;Lactobacillus在各组小鼠中的含量无明显变化。短双歧杆菌干预显著提高了小鼠肠道中Allobaculum、Oscillospira和Desulfovibrio的相对丰度,同时降低了小鼠肠道中Mucispirillum的相对丰度。

图7 随机森林鉴定的差异属Fig.7 Significant features identified by random forest classification
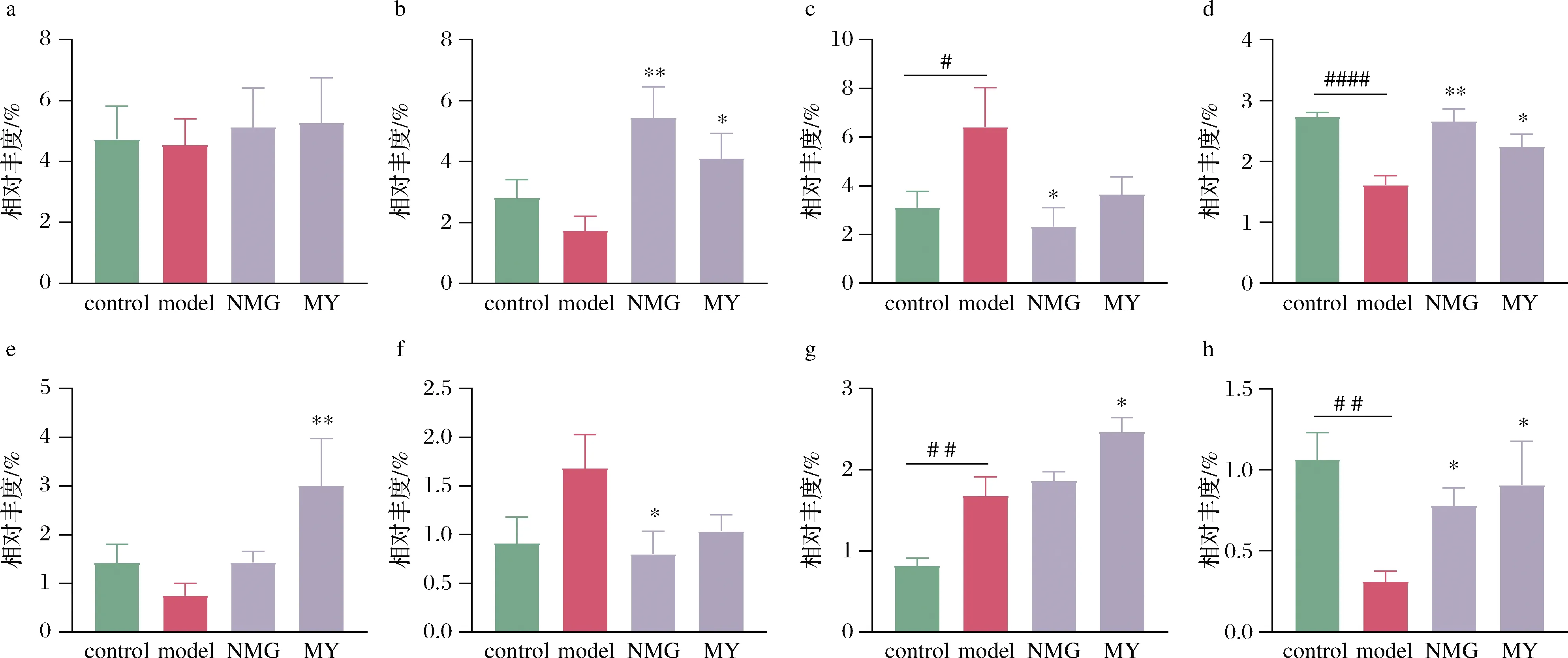
a- Lactobacillus;b- Allobaculum;c- Mucispirillum;d- Oscillopira;e- Akkermansia;f- Bifidobacterium;g-Coprococcus;h-Desulfovibrio图8 不同组别小鼠主要属的相对丰度变化Fig.8 Relative abundance of dominant genus in different groups
2.2.3 短双歧杆菌对小鼠肠道菌群种水平相对丰度的影响
进一步采用采用线性判别分析(linear discriminant analysis effect size,LEfSe)的方法,探究各组菌群组成在种水平上的差异,发现Bifidobacteriumadolescentis、Ruminococcusgnavus、Lactobacillusreuteri、Bifidobacteriumpseudolongum、Mucispirillumschaedleri、Akkermansiamuciniphila等为差异种,图9所示为差异种的相对丰度变化。
与control组相比,model组小鼠肠道中B.adolescentisde的丰度显著降低、B.pseudolongum的丰度显著升高,NMG和MY干预逆转了2种菌丰度的变化;值得注意的是,与model组相比,NMG组小鼠肠道中L.reuteri的丰度明显升高,M.schaedleri的丰度显著降低;此外,A.muciniphilas在MY组小鼠中的含量高于其他组别,model组丰度最低。
2.3 短双歧杆菌对SCFAs的调控
为进一步探讨短双歧杆菌干预对小鼠肠道菌群主要代谢物的影响,对小鼠粪便中SCFAs的含量进行分析,结果如图10所示。与control组相比,Aβ1-42蛋白注射导致小鼠粪便中乙酸和丁酸的含量显著降低;补充NMG和MY均显著提高了粪便中乙酸和丁酸的含量;虽然丙酸含量在control组与model组无显著变化,但补充MY使丙酸含量显著升高,且高于control组。
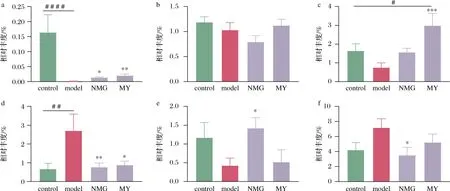
a-Bifidobacterium adolescentis;b-Ruminococcus gnavus;c-Akkermansia muciniphila;d-Bifidobacterium pseudolongum; e-Lactobacillus reuteri;f-Mucispirillum schaedleri图9 不同组别小鼠差异种的相对丰度的变化Fig.9 Relative abundance of specific species in different groups

a-乙酸;b-丙酸;c-丁酸图10 短双歧杆菌对粪便中乙酸、丙酸和丁酸含量的影响Fig.10 Effects of B.breve on levels of fecal acetate,propionate and butyrate
3 讨论
淀粉样蛋白沉积是AD的最核心病理学表征,其在脑部堆积形成斑块会引发一系列的神经炎症,通过脑肠轴之间的双向作用,导致肠道菌群结构发生变化[20-21]。近年来,越来越多的研究表明,肠道菌群紊乱与AD的发展相关,但其在延缓AD进程中发挥的作用仍不明确[22]。本研究通过海马微注射Aβ1-42蛋白建立了AD小鼠模型[23],采用MiSeq高通量测序及GC-MS技术,深入分析了2株人体来源的短双歧杆菌干预对AD小鼠肠道菌群及其代谢物的影响。
对下机数据进行种内多样性分析,发现每组小鼠粪便样品的稀释曲线(丰富度曲线)均已趋于饱和,表明测序深度已基本覆盖到样品中所有的物种。Shannon指数和Simpson指数综合表示菌群多样性和丰富度,补充短双歧杆菌NMG和MY可显著提高小鼠菌群的多样性。主坐标分析结果表明,Aβ1-42蛋白注射显著改变了小鼠的菌群结构,短双歧杆菌干预虽然能够在一定程度上调节肠道菌群的紊乱,但并不能完全逆转。
肠道菌群在其他神经系统疾病(如帕金森综合症)中发挥的作用虽已逐步被阐明,但在AD中,肠道菌群与脑部功能障碍的联系尚不清楚[24]。LIU等[7]通过对轻度认知障碍和AD患者的肠道菌群进行对比,证实了AD发展的不同阶段菌群差异较大;比如,Bacteroidetes在AD发展早期丰度增加,随着认知障碍的加重,其丰度转而降低。同样在本研究中,Bacteroidetes的在model组含量最少,提示模型处于AD的早期阶段。此外,补充NMG能逆转model组升高的Actinobacteria的相对丰度,该变化主要归功于Actinobacteria最丰富的属Bifidobacterium。
在属水平上,LIU等[7]发现Ruminococcus属的相对丰度与AD患者认知评估量表中命名和延迟回忆的评分成正相关;而Bacteroides属的相对丰度与计算力的评分成正相关。本研究进一步在属水平上分析不同样品的物种组成,发现Bifibobacterium属在各组差异中起关键性作用。Bifibobacterium属的多种细菌被用作益生菌,以饮食干预的形式来缓解消化系统疾病、代谢类疾病和神经退行性疾病。TIAN等[24]研究发现补充长双歧杆菌CCFM687可以缓解慢性应激导致的早期抑郁症;临床研究表明饮食补充双歧杆菌可缓解轻度认知障碍和重度痴呆患者的认知障碍[25-26]。先前的研究曾证实了Bifibobacterium在中枢神经系统疾病(包括抑郁症、帕金森综合症和孤独症等)中的丰度显著升高[27],与前人的研究一致,model组小鼠肠道中Bifidobacterium的含量明显升高。
考虑到同属不同种的细菌对同一疾病状态的作用效果存在差异,深入探索短双歧杆菌干预在种水平上对AD小鼠肠道菌群的差异尤为必要。LEfSe分析发现B.adolescentis、R.gnavus、L.reuteri、B.pseudolongum、M.schaedleri、A.muciniphila是组间差异较大的种。BUFFINGTON等[28]研究发现补充罗伊氏乳杆菌可恢复社交行为,改善腹侧被盖区突出可塑性,反转自闭症症状。作为小鼠肠道双歧杆菌中的优势物种,与B.pseudolongum生理功能相关的报道仍较少。TIAN等[27]通过抑郁症小鼠模型,发现B.pseudolongum的丰度与结肠5-HTP的含量呈负相关。本研究表明,补充短双歧杆菌可以提高小鼠肠道中有益菌B.adolescentis、L.reuteri和A.muciniphila的含量。目前,在AD动物模型和临床实验中,暂未见文献报道肠道菌群在种水平上的变化;且肠道菌群在不同分类水平上变化与AD的关系仍局限于现象和关联性阶段,深入探讨特定菌群丰度的变化缓解AD的机制在未来研究中仍是一项大的挑战。
除肠道菌群自身对脑部功能的调节以外,其代谢产物同样对宿主大脑认知和学习功能发挥着重要作用[9]。WANG等[11]通过建立动物模型,发现新型AD治疗药物GV-971通过重塑肠道菌群平衡,降低外周相关代谢产物苯丙氨酸/异亮氨酸的积累,减轻脑内神经炎症,进而改善认知障碍,达到治疗AD的效果;SCFAs调节AD的机制较为复杂,目前已被证实的是SCFAs能够调节血脑屏障的通透性,通过肠脑轴刺激神经递质的产生,继而发挥强大的抗炎作用[29]。本结果显示,Aβ1-42蛋白注射的小鼠粪便中乙酸和丁酸的含量明显降低,而灌胃短双歧杆菌MY使肠道中乙酸、丙酸和丁酸的含量均得到较为显著的升高,与产SCFAs菌株Coprococcusspp.、Akkermansiamuciniphila丰度的增加相一致,从而表明短双歧杆菌MY可能通过对肠道代谢产物SCFAs的调节来改善认知功能。
4 结论
本研究通过对AD小鼠粪便样品进行测序,发现灌胃短双歧杆菌能够提高AD小鼠菌群的多样性,且可在一定程度上调节菌群结构的紊乱,提高大鼠肠道中产SCFAs菌株Coprococcusspp.、L.reuteri和A.muciniphila的相对丰度;短双歧杆菌尤其是MY可有效调控肠道内3种SCFAs的水平,这与其在调节特定菌群丰度的变化的作用相吻合。此外,本研究也为通过膳食补充益生菌来靶向调控菌群-SCFAs-大脑,从而改善大脑认知功能、延缓AD进程提供了新思路。

