2021V1美国国家综合癌症网络胃肠间质瘤诊疗指南更新解读
张鹏 曾祥宇 陶凯雄
胃肠间质瘤(gastrointestinal stromal tumor,GIST)是胃肠道最常见的间叶源性肿瘤。近20年来,随着对GIST生物学行为认识的不断深入,靶向药物的广泛应用,以及分子病理学、影像学及外科手术等的进步,基于多学科诊疗模式下的GIST全程化管理显著改善病人预后[1]。美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)制订的《NCCN肿瘤学临床实践指南》是全球肿瘤临床实践中应用最为广泛的指南之一。2020年10月,NCCN发布了最新版的GIST指南(2021 年第1版),这也是NCCN指南中首部独立的GIST 指南[2]。新版指南内容包括如下部分:(1)GIST 的诊疗流程;(2)GIST的活检原则和危险度分级;(3)GIST的基因分型;(4)GIST的外科治疗原则;(5)晚期GIST的系统性药物治疗。新版指南更新之处涵盖了从诊断到治疗以及随访的GIST病人全程管理。
一、GIST临床诊疗流程
与2020版指南相一致,新版指南中延续既往形式,以5张流程图的形式直观描述GIST的临床诊疗路径。包括基于初始评估的处理、手术有显著风险的 GIST 的处理、GIST接受不同根治程度手术后的处理、不可切除或复发转移性GIST的处理及进展期GIST的处理。
1.GIST初始评估及处理:指南建议疑似GIST 的病人需接受具有肉瘤诊疗经验的多学科综合治疗协作组(multi disciplinary team,MDT) 的评估,以决定进一步诊疗方案。针对直径<2 cm的胃小GIST,如内镜超声(endoscopic ultrasound,EUS)下出现边缘不规则、囊性变、溃疡形成、强回声灶以及异质性等表现,可能提示肿瘤具有更高危险度,建议手术切除;反之可考虑定期随访。
2.手术有显著风险的 GIST 的处理:对于手术切除无显著风险者可直接切除;对于手术切除伴显著风险者,需评估其是否可能从术前治疗中获益,从而决定是直接手术、还是活检后先行术前治疗。此外,新版指南首次将阿伐替尼纳入GIST术前治疗推荐药物,适用于包括D842V突变在内的对伊马替尼不敏感的PDGFRA 第18号外显子突变GIST术前治疗。新版指南强调靶向治疗是手术有显著风险GIST的首选治疗方案,然而,靶向治疗期间若病人发生出血或出现难以耐受的临床症状,需要考虑及时外科手术治疗。
对于潜在可切除而接受伊马替尼术前治疗的病人,可能会在治疗过程中迅速进展为不可切除,必须密切监测。病人术前治疗期间应每8~12周行增强CT或MRI复查,PET/CT扫描不作为常规推荐。但PET/CT有助于病人行靶向治疗2~4周内判断靶向治疗的治疗效果,对于需行密切随访的不可切除或复发转移病人,可选择PET/CT检查。指南建议影像学评估需综合肿瘤大小与密度,术前治疗期间出现进展的病人应由专业肉瘤诊治中心进行评估,同时应注意少数情况下肿瘤体积增大并不一定代表疾病进展。若肿瘤到达最大反应或稳定状态,需由内科医师与外科医师共同评估以决定手术时机;肝转移病人可考虑手术切除或行设射频消融治疗。关于术前停药和术后恢复靶向治疗,伊马替尼停药后即可手术并在术后病人可耐受口服药物治疗后恢复靶向治疗;对于其他酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)药物如舒尼替尼或阿伐替尼则术前需停药1周,术后恢复服药时机应结合病人术后恢复状态进行评估。
3.GIST接受不同根治程度手术后的处理:此部分,指南根据根治性切除、镜下切缘阳性和肉眼可见残留这三种不同的术后病理状态及是否行术前治疗,制定了相对应的诊疗路径。对于未行伊马替尼术前治疗的GIST,完整切除术后应根据病理决定后续治疗,显著复发风险(中度或高度复发风险)GIST应行伊马替尼术后辅助治疗,低复发风险GIST可选择随访观察;对于行伊马替尼术前治疗的GIST,完整切除术后应继续服用伊马替尼辅助治疗[3]。此外,2021版指南新增行阿伐替尼术前治疗GIST的术后辅助治疗策略,因尚无高质量研究表明此类病人可从术后辅助治疗中获益,完整切除术后可选择随访观察。镜下(R1切除)或肉眼可见残留(R2切除)的病例,无论是否接受过术前治疗,术后均应接受伊马替尼或阿伐替尼(若肿瘤为PDGFRA基因D842V突变)治疗,同时通过影像学评估有无再手术机会。最新一项纳入6 248例病人的Meta分析表明,R1切除病人与R0切除病人预后无明显差异,因此对于R1切除病人可能无需行追加手术[4]。
此外,指南推荐具有显著复发风险的GIST根治性切除后5年内应每3~6个月进行健康查体及影像学检查,5年后可改为每年1次检查;非根治性手术病例建议每3~6个月进行健康查体及影像学检查。对于直径<2 cm且无高核分裂象的GIST,可选择更低频率的复查随访策略。
4.不可切除或复发转移性GIST的处理:不可切除或复发转移GIST的治疗流程与潜在可切除GIST的术前治疗基本一致,具体为通过影像学基线评估后开始靶向药物治疗。此类病人靶向治疗过程中如果影像学检查提示疾病缓解或稳定,经过临床评估存在手术机会则应选择手术切除,反之则继续行靶向治疗。指南提出,对于行伊马替尼或舒尼替尼治疗可获得影像学缓解或局限性进展的转移灶,积极行完整切除术可能使病人获益。
5.进展期GIST的处理:对于靶向治疗期间局限性进展GIST可选择以下治疗方案:(1)维持同等剂量TKI的同时,可考虑手术治疗,射频消融或化疗栓塞,针对少数骨转移病人可选择姑息性放疗(2B类证据)。(2)在病人可耐受的前提下伊马替尼加量。(3)换用舒尼替尼治疗(1类证据)。靶向治疗期间广泛进展病人,在全身状态允许的前提下(PS评分0~2分)可选择以下治疗:在病人耐受前提下行伊马替尼加量;换用舒尼替尼(1类证据);若舒尼替尼治疗后进展可选用瑞戈非尼(1类证据)。(4)指南新增对瑞戈非尼进展病人可选用瑞派替尼治疗(1类证据)。(5)PDGFRA D842V突变病人广泛进展后可考虑行达沙替尼治疗,若为对伊马替尼敏感的其他PDGFRA 18外显子突变病人可选用伊马替尼治疗。
指南建议若经上述治疗后肿瘤仍持续进展者可考虑入组临床研究,或选用其他有限数据证实有效的靶向药物,也可考虑重复活检行基因检测以寻求潜在治疗靶点或选择最佳支持治疗。指南同时指出,疾病进展病人终止靶向药物治疗可能会加速疾病进展,因此,即使疾病进展也不应终止靶向治疗,而应选择既往治疗有效且能耐受的靶向药物姑息治疗。指南强调,选择既往治疗有效且能耐受的靶向药物姑息治疗应作为最佳支持治疗的一部分,以控制临床症状。
二、GIST的活检原则和危险度分级
1.GIST的活检原则:GIST是否应活检应结合肿瘤大小和类型综合考量。GIST活检推荐经原发部位行EUS引导下细针穿刺活检;经皮穿刺活检存在种植播散的风险,因此一般仅适用于局限性进展或转移GIST的活检。GIST术前治疗前应获得明确病理诊断,免疫组织化学检测(包括CD117、DOG-1和CD34)及KIT和PDGFRA基因突变检测有助于协助GIST诊断。对于复杂或具有特殊组织病理学特征的病例,建议转诊至GIST诊断和治疗方面具有专业知识和经验的中心进行评估。
2.GIST危险度分级:肿瘤大小和核分裂象被用来预测GIST的恶性潜能,然而单凭病理特征很难预测GIST的生物学行为,因此,肿瘤部位已纳入危险度分层的考量。指南提出绝大多数胃GIST具有相对惰性的生物学行为,小肠GIST恶性程度整体上高于胃GIST;直肠GIST发病率高于结肠,结直肠GIST倾向于具有更高侵袭性生物学行为。与既往版本一致,2021版NCCN指南将GIST的危险度分层分别按胃和非胃GIST以表格的方式进行了展示,见表1和表2[5-6]。

表1 胃GIST潜在恶性生物学行为评估
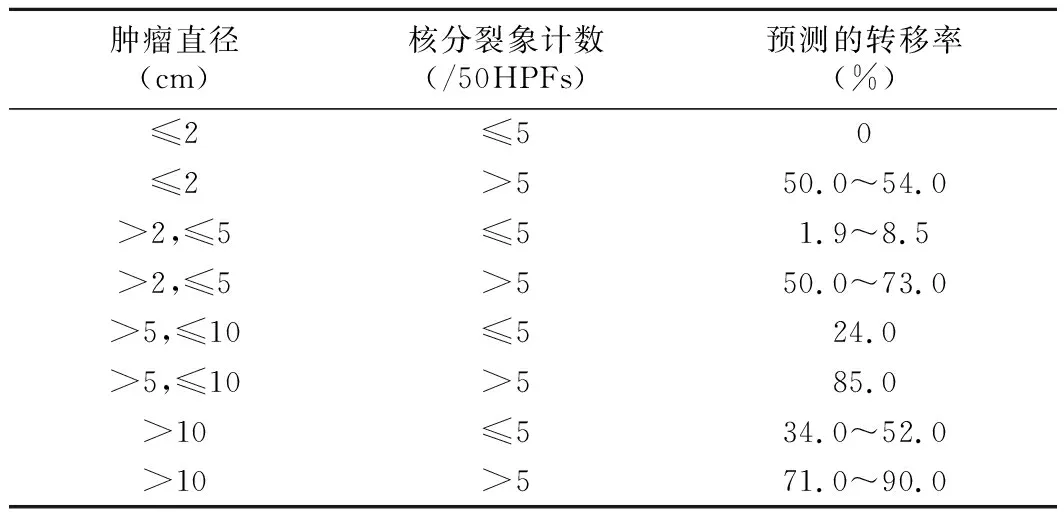
表2 非胃GIST潜在恶性生物学行为评估
三、GIST的基因分型
KIT或PDGFRA突变可导致酪氨酸激酶持续激活,两类基因特定区域的突变与TKI活性密切相关。GIST病人靶向治疗前应常规行KIT和PDGFRA基因突变检测,以判断病人靶向治疗疗效。GIST中KIT基因突变率约占80%,PDGFRA基因突变率占5%~10%,另有10%~15%的GIST缺乏上述基因突变,其中大部分由琥珀酸脱氢酶(succinate dehydrogenase,SDH)基因突变或表观静默引起[7]。对于 KIT 和PDGFRA基因野生型GIST,需考虑行SDHB免疫组化染色或行二代基因测序(next generation sequencing,NGS),检测位点应包括BRAF、K/N-RAS、 NF1、NTRK和FGFR 融合等突变,以寻求潜在靶向治疗位点[8]。
约90%的KIT外显子11突变病人可从伊马替尼治疗中获益,约50%的KIT外显子9突变病人可从伊马替尼治疗中获益,且KIT外显子9突变晚期病人选择高剂量(800 mg/d)伊马替尼治疗可增加药物的有效性。PDGFRA基因突变一般对伊马替尼治疗有反应(D842V突变除外),D842V突变GIST对阿伐替尼反应佳。KIT或PDGFRA基因突变GIST继发性耐药往往由继发性突变导致;伊马替尼治疗失败或无法耐受病人可选用舒尼替尼,瑞戈非尼适用于伊马替尼及舒尼替尼治疗失败病人。对伊马替尼、舒尼替尼、瑞戈非尼、瑞派替尼及阿伐替尼均耐药的GIST病人,指南建议参与临床实验。
对于缺乏KIT及PDGFRA基因突变GIST病人,少部分对伊马替尼治疗有反应。SDH 突变的 GIST一般发生于胃,多见于年轻病人,易发生淋巴结或远处转移,生长缓慢,通常对伊马替尼不敏感,舒尼替尼或瑞戈非尼对其有一定疗效。同时,对于携带NF1或SDH突变病人应转诊遗传门诊进行胚系检测。SDH突变的病人有患副神经节瘤的风险,建议在手术前进行血清/尿液儿茶酚胺检测。
四、GIST手术原则
原发(可切除)GIST 的手术原则:完整切除肿瘤并获得阴性切缘;扩大切除一般不常规推荐,大多数情况下节段性切除或楔形切除即可获得满意切缘;一般不考虑行淋巴结清扫,若为SDH缺陷型GIST或术中发现有肿大淋巴结可行淋巴结清扫;GIST质脆易碎,术中应避免肿瘤破裂;若术后病理切缘阳性,一般不考虑再次手术;原发GIST手术应尽量保留脏器功能,避免行多脏器联合切除,否则应行MDT讨论术前治疗的可行性。对于适宜部位的GIST,有经验的医师可选择腹腔镜手术切除,腹腔镜手术遵循开放手术的肿瘤学原则,包括保留假包膜完整性及避免肿瘤破裂等,标本应置入标本袋中取出以防止肿瘤种植播散。
五、晚期GIST的系统性药物治疗
当前,GIST一线治疗药物为伊马替尼和阿伐替尼(包括D842V突变型在内的对伊马替尼不敏感PDGFRA 18外显子突变GIST),二线治疗药物为舒尼替尼,三线治疗药物为瑞戈非尼,四线治疗药物为瑞派替尼[9-12]。此外,新版指南将晚期GIST“特定情况下可能有效药物”重新定义为“获批准治疗失败后的其他选择”,通过引用相应循证医学证据,把阿伐替尼(avapritinib)、卡博替尼(cabozantinib)、达沙替尼(dasatinib)、依维莫司(everolimus)+TKI、拉罗替尼(larotrectinib)、恩曲替尼(entrectinib)、尼洛替尼(nilotinib)、帕唑帕尼(pazopanib)和索拉非尼(sorafenib)纳入四线治疗失败特定GIST突变位点病人的备选药物列表[13-18]。
新版指南以高效解决临床问题为切入点,重视临床可操作性及实践性,首次确立了阿伐替尼在PDGFRA外显子18突变型(包括D842V突变)GIST术前治疗价值,明确了瑞派替尼四线治疗地位。同时,在晚期GIST治疗失败备选药物中新增卡博替尼和拉罗替尼两个针对NF1或 NTRK 基因融合突变靶向药物;此外,全篇多处增加分子检测相关表述,表明GIST治疗日趋精准。相信随着基因 检测的普及,临床诊治方案的改善,临床和基础研究的开展,GIST的个体化精准化诊疗将成为主流治疗模式。

