奶酪中乳酸菌的分离筛选及其对小清蛋白的降解性能初步评价
李晓晨,王进,徐晨晨,肖叶,李燕,2,3,卢瑛,2,3*,李晓晖,2,3*
1(上海海洋大学 食品学院,上海,201306)2(上海水产品及加工及贮藏工程技术研究中心,上海,201306)3(农业部水产品贮藏保鲜质量安全风险评估实验室,上海,201306)
奶酪作为发酵型乳制品蕴藏丰富具有益生特性的乳酸菌。据报道[1]微生物发酵法能够降解食物中的过敏原,并且利用不同的菌种(乳酸菌、酵母菌、芽孢杆菌)对食物蛋白进行发酵,其过敏原降解的程度也有所不同。FRIAS等[2]利用植物乳杆菌发酵豆粕48 h,SDS-PAGE结果显示豆粕中的致敏蛋白被全部降解,ELISA结果显示免疫球蛋白E结合能力降低了96%以上。肖叶等[3]利用植物乳杆菌水解对虾中的原肌球蛋白得到了类似的结果。此外,酪蛋白或脱脂牛乳经乳酸菌发酵后能够使β-酪蛋白[4]、β-乳球蛋白[5]显著降解,且免疫活性下降。根据上述应用研究发现乳酸菌能够降低牛乳,大豆,虾类过敏原的免疫活性,具有效果显著、安全性高、特异性强和应用价值高等优势,但利用乳酸菌消减鱼类过敏原鲜有研究。
鱼类是引起食物过敏的常见水产品之一,其中淡水鱼相比海水鱼更易致敏[6]。据显示,人们对鱼类产生过敏反应主要是由小清蛋白(parvalbumin,PV)引起的[7]。其分子质量约为10~14 kDa,具有极高的热稳定性。KUBOTA等[8]研究表明使用140 ℃ 以上的高温处理鱼组织,才能使PV的免疫活性下降。
因此,本研究通过分离奶酪中的乳酸菌,利用脱脂牛乳平板透明圈法作为产蛋白酶乳酸菌的初步筛选标准,并对菌株进行16S rDNA测序鉴定。通过提取草鱼中的PV与筛选的乳酸菌进行孵育,评价孵育过程中PV含量和免疫活性的变化,筛选有效降低PV免疫活性的乳酸菌,以期为乳酸菌发酵鱼肉开发低致敏性鱼肉制品提供参考。
1 材料与方法
1.1 材料与试剂
奶酪,新疆乌鲁木齐王家梁农贸市场;新鲜草鱼,上海市浦东新区芦潮港。
MRS培养基,青岛海博生物有限公司;预染和非预染蛋白质标记物、BCA蛋白定量试剂盒,北京天根生化科技有限公司;小清蛋白单克隆抗体EG8,实验室自制;R-250考马斯亮蓝染色液、2×上样缓冲液、十二烷基硫酸钠、Tris分析纯,上海生工生物工程有限公司;聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF膜)(0.45 μm),美国Millipore公司;脱脂奶粉,美国BD公司;DAB显色液(D0426-50SET),美国Sigma公司。
1.2 仪器与设备
GHP-9080隔水式恒温培养箱,上海一恒科学仪器有限公司;YXQ-LS-100S11立式压力蒸气灭菌器,上海博讯实业有限公司;SW-CJ-ZF可调式垂直单向洁净工作台,上海天恒医疗器械有限公司;JA1003电子天平,常州市宏恒电子仪器厂;ZQWY-200振荡培养箱,上海知楚仪器有限公司;高速冷冻离心机,日本日立公司;电泳仪,美国伯乐公司;TS-8脱色摇床,江苏海门其林贝尔仪器制造有限公司;Synergy2多功能酶标仪,德国 Hermle 公司。
1.3 实验方法
1.3.1 乳酸菌的分离筛选
无菌条件称取25.0 g奶酪放入含225 mL生理盐水的无菌均质袋中,用拍击式均质器制成样品匀液,进行10倍梯度稀释并涂布MRS固体培养基,37 ℃厌氧培养48 h[9]。观察菌落生长情况(颜色、形状、隆起、边缘等),挑取特征菌落于MRS平板划线获得单菌落纯培养物。通过过氧化氢酶反应、生理生化鉴定筛选目的菌。
1.3.2 产蛋白酶乳酸菌的筛选
参照胡玲萍等[10]的方法略作修改,将菌株接种于MRS肉汤培养基置于37 ℃培养24 h,菌液离心(8 000 r/min,10 min)取50 μL上清液添加至脱脂牛乳琼脂平板孔内,37 ℃放置过夜,观察平板上产生的透明圈并测量记录。每个菌株进行3个平行实验。
1.3.3 16S rDNA基因的PCR扩增
参考郭艳荣等[11]的方法,将MRS培养18 h菌液离心收集菌体(8 000 r/min,15 min),用DNA快速抽提试剂盒提取DNA,使用16S rDNA 通用引物进行PCR扩增。
1.3.4 PCR扩增结果和系统发育树的构建
将PCR产物送至上海生工生物工程有限公司进行测序。采用BioEdit 7.0软件拼接序列,于NCBI数据库的GenBank中与已知菌株的16S rDNA基因序列进行比对[11-12]寻找同源性最高的菌种。使用MEGA 7.0软件中的邻接法对8株乳酸菌作系统发育进化树[13]。
1.3.5 草鱼PV的提取与富集
参照ZHANG等[14]的方法略作修改,新鲜草鱼取白色肌肉200 g,加入5倍体积的抽提液进行匀浆,离心(4 ℃,10 000 r/min,20 min)取上清液加入三氯乙酸(trichloroacetic acid solution,TCA)溶液,冰浴搅拌10 min,调节pH至5.2,继续搅拌1 h。离心取上清液再次加入TCA溶液,搅拌10 min,离心(4 ℃,12 000 r/min,20 min)收集沉淀并加入少量去离子水溶解,调节pH至中性。所得溶液透析24 h后进行冷冻干燥。采用SDS-PAGE和蛋白免疫印迹(Western blot)对提取的PV进行验证。
1.3.5.1 SDS-PAGE
参照ZHANG等[14]的方法,浓缩胶和分离胶浓度分别为4%和14%,样品上样量为8 μL。
1.3.5.2 Western blot
参照SONG等[15]的方法略作修改。用半干式碳板转印仪将蛋白条带转印至PVDF膜上,条件为恒流180 mA,20 min。用封闭液覆盖于PVDF膜,室温封闭1 h。用含有0.05% 吐温-20磷酸缓冲液(phosphate buffered saline-tween 20,PBST)洗涤。单克隆抗体EG8(体积比1∶10 000)作为一抗,室温孵育1 h,PBST洗涤。HRP-羊抗小鼠IgG(体积比1∶2 500)作为二抗,室温孵育1 h,PBST洗涤。DAB显色液显色后拍照保存。
1.3.6 乳酸菌和PV溶液的孵育反应
参照PESCUMA等[16]的方法略作修改,将8株乳酸菌分别接入MRS液体培养基活化2次,菌液10 000 r/min离心,用PBS洗涤菌体3次,将菌体悬浮于PBS,浓度为1×108CFU/mL。按体积比1∶1加入2 mg/mL PV蛋白溶液于恒温摇床37 ℃,200 r/min孵育24 h。对照为未加菌体的PV溶液。孵育结束后离心(8 000 r/min,10 min)收集上清液,采用SDS-PAGE分析PV含量的变化。
1.3.7 孵育时间对PV含量和免疫活性的影响
菌株活化及处理参照1.3.6方法进行。孵育时间梯度设为18、20、22、24、26、36 h。孵育后离心收集上清液用SDS-PAGE分析PV含量的变化,采用竞争性ELISA评价PV免疫活性的变化。
1.3.8 竞争性ELISA
参照丁婕等[17]的方法。PV用碳酸盐缓冲液(pH 9.6)稀释至5 μg/mL,4 ℃包被过夜,PBST洗涤3次,每次15 s。加入封闭液于37 ℃封闭2 h,PBST洗涤。每孔加入预先与EG8孵育1 h的样品100 μL,37 ℃孵育1 h,PBST洗涤。加入HRP-羊抗小鼠免疫球蛋白G(体积比1∶2 500)100 μL,37 ℃ 孵育 1 h,洗涤后加入邻苯二胺底物显色液100 μL,显色后加入2 mol/L硫酸终止反应,用酶标仪测定450 nm处的吸光度值(OD值)。以碳酸盐缓冲液(pH 9.6)作为阴性对照,以抗体稀释液稀释的EG8作为阳性对照,每个样品3个平行。样品中PV免疫活性的消减率的计算如公式(1)和公式(2)所示:
(1)

(2)
式中:阳性OD450为阳性对照孔的OD值;样品OD450为样品孔的OD值;阴性OD450为阴性对照孔的 OD值。
1.4 数据处理与分析
实验结果采用平均值±标准偏差表示,由SPSS Statistics 19.0软件进行显著性分析,由Origin 2018 64 Bit软件进行制图。
2 结果与分析
2.1 分离菌的形态特征、生理生化特性和产蛋白酶能力
通过形态学观察和部分生理生化试验,从奶酪中分离筛选出45株分离株,进一步利用透明圈法筛选得到8株符合乳酸菌特征的产蛋白酶菌株,编号标记为A-5~B-19,其菌落形态特征及部分生理生化特性如表1所示,产透明圈大小见表2。

表1 菌株的形态特征及生理生化特性Table 1 Morphological and biochemical characteristics of the strain

表2 菌株产透明圈大小情况Table 2 The size of the clear zone produced by the strains
2.2 PCR扩增结果与系统发育树的构建
提取8株分离株的DNA并进行PCR扩增,经1.0%琼脂糖凝胶电泳检测如图1所示,8株待测菌株在约1 500 bp处条带清晰明亮,无杂带,表明PCR扩增成功,能满足后续菌株16S rDNA序列的测定。

1~8-A-5~B-19;9-阴性对照图1 16S rDNA PCR 扩增后的琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of 16S rDNA amplification products
测序结果通过NCBI中的BLAST进行序列相似性比对,将8株分离株鉴定为乳酸菌的2个属,3个种。利用MEGA 7.0软件进行系统发育关系研究和系统进化树构建,结果见图2。Lactobacillusplantarum、Lactobacillusbrevis、Lactobacilluscasei、Enterococcusfaecium各自聚为一类。其中A-5、A-9、B-14和B-17与LactobacillusplantarumIDCC 3502,LactobacillusplantarumMG5211在同一分支,且同源性为100%,故将其鉴定为Lactobacillusplantarum;B-2和A-16与LactobacilluscaseiM8,LactobacilluscaseiMT.ZH493聚为一类,且序列同源性达100%,因此将其鉴定为Lactobacilluscasei;B-6,B-19和EnterococcusfaeciumIDCC 2103同源性达到100%,故鉴定其为Enterococcusfaecium。

图2 菌株的系统发育树Fig.2 Phylogenetic tree of strains
2.3 PV的提取与富集
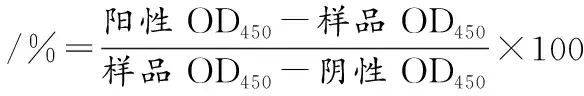
草鱼肌肉提取液和TCA处理样品的电泳分析结果如图3所示。SDS-PAGE的14.4 kDa附近有2个蛋白质条带(图3-a),其分子质量与报道的PV分子质量接近[7,18]。此外,免疫印迹结果显示11 kDa附近的条带与EG8单抗有特异性反应,因EG8单抗对鱼类过敏原PV有特异性反应[19],故该条带被鉴定为草鱼的PV。对比TCA处理前后的电泳条带,发现第2次TCA处理后的样品条带(图3-a)显著变粗,表明2次TCA处理可以有效富集草鱼中的PV,且含量较多,纯度较高。
M-蛋白Marker;1-粗蛋白上清液;2-粗蛋白沉淀;3-1次TCA沉淀;4-2次TCA沉淀透析后样品a-SDS-PAGE;b-Western blot图3 草鱼PV提取过程样品的SDS-PAGE和Western blotFig.3 SDS-PAGE and Western blot of PV extract samples of Ctenopharyngodon idella
2.4 乳酸菌对草鱼PV的降解性能分析
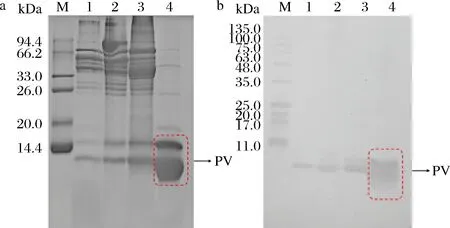
图4中1~8依次为菌株A-5~B-19与PV孵育24 h的样品条带。由图4可知,LactobacilluscaseiB-2和LactobacillusplantarumB-17孵育PV 24 h后,PV条带发生了明显的变化。经LactobacilluscaseiB-2孵育后位于14.4 kDa左右的条带消失,而在14.4 kDa下方出现了新的条带,颜色变浅且出现多个条带,最下方的条带与对照样品相比明显变细,表明PV经这2株乳酸菌处理后发生了部分降解。经菌株LactobacillusplantarumB-17孵育后的PV条带颜色显著变浅,说明PV含量明显减少。其他菌株对PV条带无较大影响,因此挑选LactobacilluscaseiB-2和LactobacillusplantarumB-17进一步研究孵育时间对PV含量和免疫活性的影响。

M-蛋白Marker;C-PV对照;1~8-菌株A-5~B-19孵育PV样品图4 PV孵育24 h的 SDS-PAGEFig.4 SDS-PAGE of PV incubation for 24 h
2.5 孵育时间对降低PV含量和免疫活性的影响
LactobacilluscaseiB-2和LactobacillusplantarumB-17对PV溶液不同孵育时间的电泳分析结果如图5所示,这2株菌孵育36 h的PV条带相对于对照样品几乎不可见,表明此时PV蛋白质基本被全部降解了。而LactobacilluscaseiB-2与PV孵育的18~24 h间PV含量无明显变化,26 h时14.4 kDa上方的条带消失,而在下方出现新条带,位于12 kDa左右的条带明显变窄,颜色变浅,可见PV出现了部分降解。
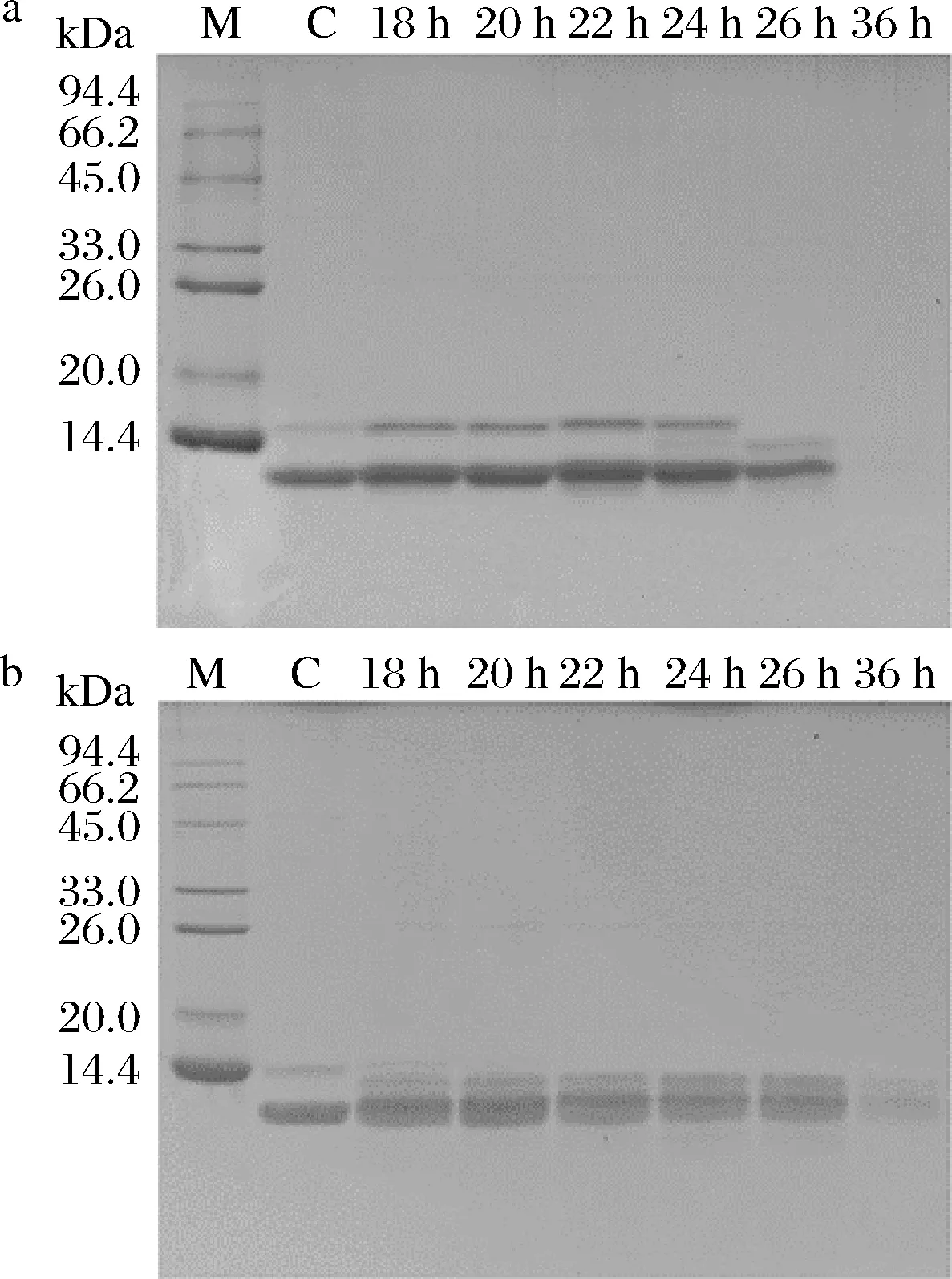
M-蛋白Marker;C-PV对照a-B-2;b-B-17图5 孵育PV后的含量变化Fig.5 Changes in the content of PV after incubation
LactobacilluscaseiB-2和LactobacillusplantarumB-17孵育PV后,通过计算消减率表示不同时间段PV免疫活性的变化情况。消减率越高说明对PV免疫活性的消减效果越好,反之亦然。结果如图6所示,随着反应时间的延长,消减率逐步增加。反应36 h 时,LactobacilluscaseiB-2和LactobacillusplantarumB-17对PV免疫活性消减率最高,分别为96.5% 和84.8%。

图6 B-2、B-17孵育PV的免疫活性变化Fig.6 changes of PV Antigenicity treated by B-2 and B-17 strains注:组间不同小写字母代表存在显著性差异(P<0.05)
3 结论与讨论
据报道乳酸菌有1个高效的蛋白水解系统,由1个细胞膜蛋白酶(启动蛋白质降解)、1个转运系统和几个胞内肽酶组成[20-21],且不同乳酸菌菌株对不同种类的过敏原蛋白具有不同的水解效果[22]。本研究从奶酪中筛选获得8株产蛋白酶的乳酸菌,其产透明圈大小显示了一定的差异性,说明具有不同的分解牛乳蛋白的能力,透明圈越大,分解牛乳蛋白的能力则越强,产生的蛋白酶活性越高。其中LactobacilluscaseiB-2和LactobacillusplantarumB-17产透明圈平均值为5.83、5.16 mm,与PV溶液孵育36 h使PV显著降解,且免疫活性分别降低96.5% 和84.8%。虽然EnterococcusfaecalisB-6,LactobacillusplantarumA-5 显示了相似甚至更好的产蛋白酶能力,但对PV几乎无影响。相关研究[23]发现L.delbrueckiisubsp.bulgaricus92059水解β-酪蛋白24 h时蛋白完全降解,而L.helveticus92201对β-酪蛋白的水解效果并不明显。说明不同的乳酸菌菌株对致敏蛋白的降解效果不同,在本研究中也得到了类似的结果。LAW等[24]研究指出乳酸菌产生的蛋白酶将乳蛋白裂解成多肽,多肽酶将多肽裂解成更小的多肽和氨基酸,从而抗原表位可能被裂解。因此,我们推测孵育过程中PV发生降解是由于LactobacilluscaseiB-2和LactobacillusplantarumB-17产生蛋白酶将PV水解为多肽,进而引起PV免疫活性下降。
目前,乳酸菌发酵法降解食物中的过敏原多研究报道于牛乳和大豆制品,在降解过敏原的同时还能产生风味物质,赢得广大消费者的青睐。因此,利用乳酸菌发酵鱼肉制品具有良好的应用前景,以期在降解过敏原的同时提升产品风味和口感。本研究筛选到的LactobacilluscaseiB-2和LactobacillusplantarumB-17 能够显著降低PV的免疫活性,从而显示出了降低PV致敏性的潜力,今后可进一步探究不同发酵条件对鱼肉品质和风味的影响,将乳酸菌发酵应用于低致敏性鱼类制品的开发。

