噻二唑类农药在猕猴桃上的残留分析方法
王全胜, 张 亮, 付 岩, 凌淑萍, 吴银良
(宁波市农产品质量检测中心,浙江 宁波 315040)
噻唑类衍生物是一类重要的化合物,在医药和生物领域都有着极其广泛的应用。其中,噻二唑类衍生物具有较好的生物活性,研发了一系列噻二唑类农药[1]。常见的有噻唑锌 (式1a)、噻菌铜(式1b) 和噻森铜 (式1c) ,其作用机理均为通过噻唑基团与金属离子的协同作用杀死病原菌。目前,这3 种农药在芋头、猕猴桃、铁皮石斛等近30 种作物上登记,用于防治软腐病、白粉病等病害[2]。中国尚未规定噻森铜的最大残留限量 (MRL) ,但已规定噻菌铜和噻唑锌在部分作物上的MRL 值(如噻唑锌在柑、橘、橙上的MRL 和噻菌铜在番茄上的MRL 均为0.5 mg/kg)[3],且二者均以2-氨基-5-巯基-1,3,4-噻二唑(AMT,式1d)为待测残留物。为有效监控噻二唑类农药的残留风险,开发高效、普适、可靠的残留分析方法不可或缺。
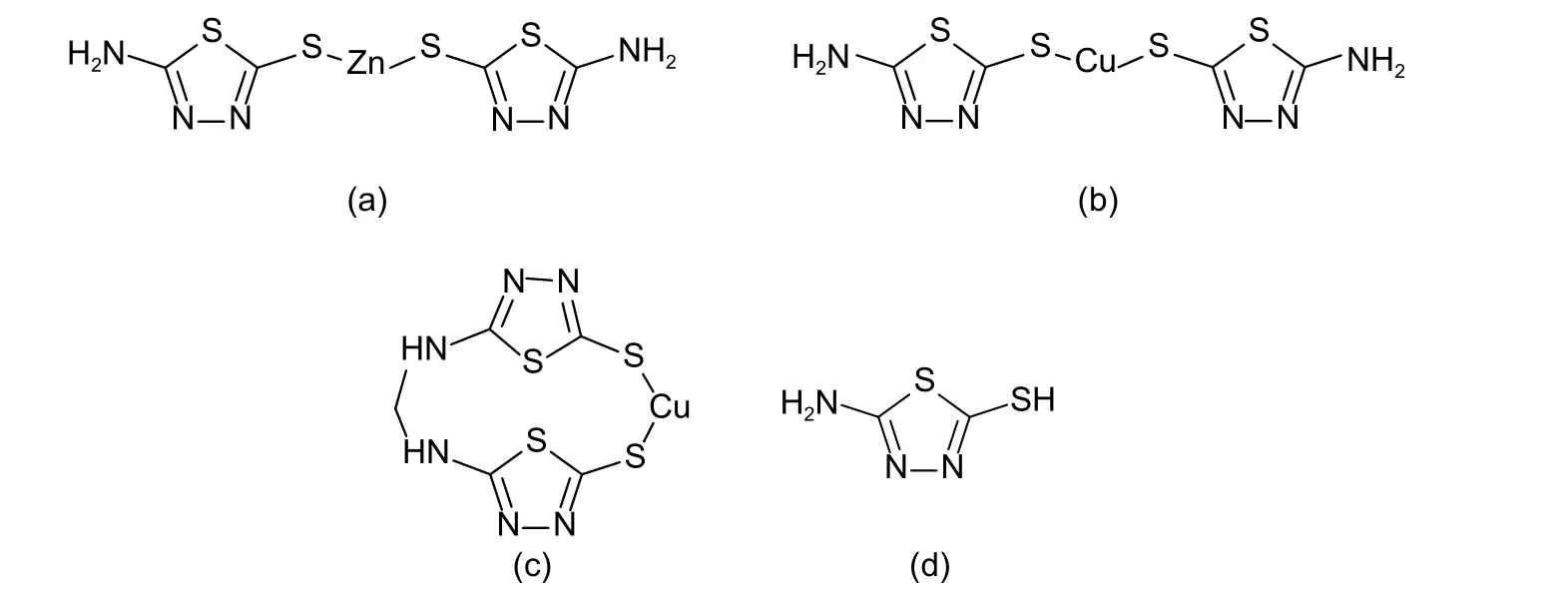
图式 1 噻唑锌(a)、噻菌铜(b)、噻森铜(c)和噻二唑(d)的化学结构式Scheme 1 Chemical structure of thiazole zinc (a), thiediazole copper (b), thiosen copper (c) and AMT (d)
目前,有关噻唑锌、噻菌铜和噻森铜的残留分析方法研究相对较少,分析手段多为液相色谱法 (LC) ,偶有液相色谱-二极管阵列检测器结合质谱选择离子监测模式(SIM)检测,尚未见超高效液相色谱-串联质谱法的相关报道。当前此3 种农药的前处理方法大同小异,基本原理均是先将其与硫化钠溶液反应转化为噻二唑,再用乙腈提取、硫酸调节pH 值、乙酸乙酯液液分配净化、浓缩后经液相色谱检测。赵华等[4]采用硫化钠溶液分解、乙酸乙酯液液分配净化、液相色谱分析,测定了噻唑锌在水、土壤及猕猴桃中的残留;毛江胜等[5]采用硫化钠溶液分解、层析柱吸附、液相色谱分析,测定了噻菌铜在西瓜上的残留;梁赤周[6]等采用硫化钠溶液分解、乙酸乙酯液液分配净化、液相色谱分析,测定了噻森铜在铁皮石斛上的残留。采用液相色谱检测对样品净化要求较高且灵敏度相对较低,上述前处理过程则较为耗时,同时会产生硫化氢气体并需要使用大量有机溶剂,方法的安全性、环保性和高效性均需进一步提高。因此,本研究建立了用氢氧化钠替代硫化钠碱解、用盐酸调节pH 值、采用改良QuEChERS 法分析施用3 种噻二唑类农药后猕猴桃中噻二唑残留的UPLC-MS/MS 方法。旨在为噻唑锌、噻菌铜、噻森铜的残留风险监测提供技术支持,并对其他噻二唑类农药的分析方法开发提供借鉴。
1 材料与方法
1.1 供试材料
98.5%噻唑锌(thiazole zinc, THIA)标准品,浙江新农股份有限公司;95%噻菌铜(thiediazole copper, THIE)标准品,浙江龙湾化工有限公司;92%噻森铜(thiosen copper, THIO)标准品,浙江东风化工有限公司;98.0% 噻二唑(2-amino-5-mercapto-1,3,4-thiadiazole,AMT)标准品,德国CNW 公司;色谱纯乙腈,德国Merk 公司;分析纯硫化钠、氢氧化钠、氯化钠、无水硫酸镁、硫酸、盐酸和乙酸,中国国药集团化学试剂有限公司;PSA(40 ~ 63 μm),上海安谱公司;C18(50 μm),北京艾杰尔公司;石墨化碳黑(GCB),美国Agilent 公司。
Xevo TQ-S 超高效液相色谱-串联质谱仪(UPLC-MS/MS),配备Acquity UPLC BEH C18色谱柱(2.1 mm × 100 mm, 1.7 μm),美国Waters 公司;KS4000ic 恒温振荡器及GENIUS3 旋涡混合器,德国IKA 公司;3K15 高速离心机,德国Sigma 公司。
供试猕猴桃Actinidia chinensisPlanch 品种为红阳。
1.2 试验方法
1.2.1 样品提取与净化 称取5.00 g 样品于50 mL离心管中,加入25.0 mL 0.1 mol/L 的氢氧化钠溶液,于350 r/min、40 ℃下振荡20 min 后,用1 mol/L 盐酸溶液调节pH 值至2 ~ 3,加入20.0 mL乙腈继续振荡提取15 min,加入8 g 氯化钠后剧烈振荡1 min 后,以9500 r/min 离心3 min。吸取1.0 mL 上清液于装有50 mg C18和50 mg GCB 的塑料离心管中,漩涡振摇1 min 后再于9500 r/min下离心3 min。吸取0.50 mL 上清液,于室温下用氮气吹至近干,用V(乙腈) :V(0.1%乙酸溶液) =1 : 9 定容至1.0 mL,过0.22 μm 滤膜后供UPLCMS/MS 测定。
1.2.2 标准溶液配制 噻唑锌、噻菌铜、噻森铜和噻二唑标准储备液:分别称取10 mg (精确至0.01 mg) 4 种供试标准品于4 个25.00 mL 容量瓶中,前三者用体积分数为1%的乙酸溶液溶解并分别定容,噻二唑用乙腈溶解并定容至25.00 mL,超声混匀得到4 种化合物的标准储备液。
噻唑锌、噻菌铜、噻森铜和噻二唑标准中间液:用体积分数为1%的乙酸溶液分别稀释噻唑锌、噻菌铜和噻森铜标准储备液,配制成质量浓度为0.04、0.2、0.4、2、4、20 和50 mg/L 的系列标准中间液。用乙腈稀释噻二唑标准储备液,配制质量浓度为1、10 和50 mg/L 的噻二唑系列标准中间液。
噻唑锌、噻菌铜、噻森铜和噻二唑基质匹配标准工作液:分别吸取1.0 mL 质量浓度为0.04、0.2、0.4、2、4 和20 mg/L 的噻唑锌系列标准中间液于6 个50 mL 离心管中,各加入5.0 mL 纯水混匀,按1.2.1 节样品提取净化步骤处理,进行至氮气吹干步骤后,用空白样品定容后的溶液定容至1.0 mL,分别得到质量浓度为0.001、0.005、0.01、0.05、0.1 和0.5 mg/L 的噻唑锌或噻菌铜、噻森铜系列基质匹配标准工作液。另直接用该定容溶液梯度稀释,配制相同质量浓度的噻二唑系列基质标准工作液。
1.2.3 检测条件 色谱条件:流动相A 为0.1%(体积分数) 乙酸溶液,B 相为乙腈,流速为0.25 mL/min,梯度洗脱:0 ~ 0.5 min,90% A;>0.5 ~1 min,A 相渐变至20%;>1 ~ 3 min,20% A;>3 ~3.1 min,A 相渐变至90%;3.1 ~ 5 min,90% A。色谱柱柱温为35 ℃;进样体积为10.0 μL。
质谱条件:检测噻唑锌、噻菌铜和噻森铜转化后的产物噻二唑。采用电喷雾离子源正离子扫描 (ESI+) ,多重反应监测 (MRM) 模式 (表1) ,毛细管电压为2.50 kV,雾化气流速为1000 L/h,锥孔气流速为50 L/h,离子源温度为150 ℃;雾化气温度为500 ℃。

表1 多重反应监测条件Table 1 Condition of MRM
1.3 数据处理
基质匹配外标法定量。对于含某一特定已知化合物的样品,根据文献[4]及本试验验证,噻二唑类农药质量浓度与其转化后的噻二唑质量浓度间呈良好的线性关系,故可基于该已知噻二唑类农药基质匹配标准溶液直接计算其残留量 (以母体化合物表示) ;对于含混合 (或未知) 化合物的样品,需基于噻二唑基质匹配标准溶液计算残留量,此时残留量为噻二唑类农药总残留量 (以噻二唑表示) ,可按公式 (1) 计算。
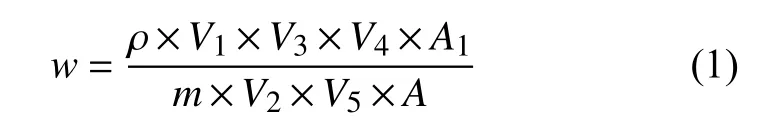
其中,w为样品中待测物的残留量,mg/kg;ρ为标样中待测物的质量浓度,mg/L;V1、V2和V3分别为提取体积、分取体积和定容体积,mL;V4、V5分别为标准品溶液和样品溶液的进样体积,μL;A、A1分别为标准品和样品中待测物的峰面积;m为样品质量,g。
2 结果与分析
2.1 转化条件的优化
由于噻唑锌、噻菌铜和噻森铜在水及各类常见溶剂中溶解度极小,无法直接检测,因此本研究先将其转化为噻二唑再进行分析。与传统方法不同的是本研究采用氢氧化钠溶液进行碱解、盐酸溶液调节pH 值。
虽然转化率的高低并不影响分析方法的建立[4],但转化生成的噻二唑的绝对量会影响方法检出限,因此本研究选取质量浓度为2.0 mg/L 的噻二唑类农药标准溶液,对其转化条件进行了优化。结果表明 (图1) :不同氢氧化钠浓度 (0.1、0.25和0.5 mol/L) 下噻唑锌、噻菌铜和噻森铜生成噻二唑的转化率有所不同,在0.1 mol/L 下转化率最高,平均转化率分别为55%、42%和37%。相同氢氧化钠浓度、不同体积 (10、20 和30 mL) 下,30 mL 时转化率略高,但考虑到实际操作的方便性和节约原则,最终体积定为25 mL。此外,对碱解反应的温度 (30、40 和50 ℃) 和反应时间(20、30 和40 min) 进行研究的结果表明,30 ℃下转化率相对较低,40、50 ℃下转化率差别较小,而反应时间的延长并未明显提高转化率,故最终确定于40 ℃下反应20 min。此外,虽然同步进行的传统转化方法[4](硫化钠反应) 下噻唑锌、噻菌铜和噻森铜的转化率 (46%、60%和75%) 较本研究方法的转化率 (39%、48%和60%) 高10%左右,但由于本研究采用的UPLC-MS/MS 检测具有更高的灵敏度,因此可以保证在低转化率下仍可进行准确的定性定量分析。

图1 不同反应条件下噻二唑类农药的转化率 (n = 3)Fig. 1 Reaction conversion of THIA, THIE and THIO under different reaction conditions (n = 3)
研究中还发现,相同条件下,噻森铜、噻菌铜和噻唑锌的转化率分别为39%、48%和60%,呈现依次增大的趋势。陈实等[7]研究表明,铜与大环配体在溶液中的配位稳定性高于相应锌离子的配位稳定性,据此推测噻菌铜较噻唑锌可能更加稳定,而由于噻森铜形成了相对更稳定的环状结构,因此噻森铜的稳定性最大。这可能是噻森铜、噻菌铜和噻唑锌转化率呈现依次增大趋势的原因之一。
2.2 样品提取与净化条件的优化
对转化后噻二唑的提取净化条件进行研究发现:不同乙腈提取体积 (15、20、25 和30 mL) 和不同振荡时间 (15、25 和35 min) 下的提取回收率均高于80%,综合考虑后确定提取体积为20 mL、振荡时间为15 min。对净化吸附剂种类 (PSA、C18和GCB) 及用量 (50、100、150、200 和250 mg)进行研究的结果表明 (图2) :PSA 净化后回收率明显降低,C18净化对回收率的影响较小,而当GCB 用量增大时,回收率也会明显降低,因此最终确定使用50 mg C18和50 mg GCB 进行净化。

图2 不同净化吸附剂对猕猴桃中噻二唑回收率的影响 (n=3)Fig. 2 Effect of different amounts of cleanup sorbents on the recoveries of AMT in kiwi fruit (n=3)
与传统方法[4]相比,本方法单个样品的分析时间节约65%以上,大大缩短了样品分析时间,提高了分析效率。同时,本研究前处理过程中仅产生了可用于后续盐析分层的氯化钠,无有毒硫化氢气体的产生且不需要使用大量乙酸乙酯净化,这使得方法更加安全、节约、环保。
2.3 方法线性关系
分别研究了噻二唑在ESI+和ESI−下的碎裂情况,结果表明,噻二唑在ESI+下质核比 (m/z) 为43.2 和75.2 的两个离子碎片响应较高,进一步对仪器毛细管电压、锥孔电压等参数进行优化,使离子响应达到最高。分别对乙腈-0.1%甲酸溶液和乙腈-0.1%乙酸溶液流动相体系进行了研究,噻二唑在后者体系下峰形尖锐、响应更高。与已知文献中的液相色谱分析相比,UPLC-MS/MS 检测不但降低了样品前处理中对净化效果的要求、缩短了样品检测时间,而且检测灵敏度得到进一步提升。
噻二唑类农药均含有易产生基质效应的-NH-基团[8],对其在猕猴桃中的基质效应进行了初步研究。结果表明,噻唑锌、噻菌铜、噻森铜和噻二唑在猕猴桃基质中的基质效应 (Me,以基质标曲斜率与溶剂标曲斜率之比表示)[9]为0.5 ~ 0.7,Me<0.9 表明存在较明显的基质效应,故采用基质匹配外标法定量。对1.2.2 节中配制的基质匹配标准工作液进样检测,结果表明:在0.001 ~ 0.5 mg/L质量浓度范围内,基质匹配标准工作液的浓度与响应值间均呈良好的线性关系 (表2) 。
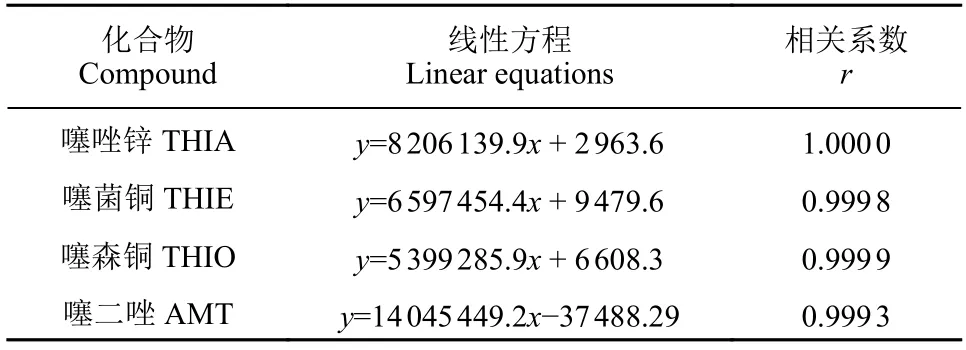
表2 噻二唑类农药在猕猴桃中的线性回归方程(0.001~0.5 mg/L)Table 2 The linear equations of thiadiazole derived pesticides in kiwi fruit (0.001-0.5 mg/L)
2.4 方法的准确度与精密度
分别向空白猕猴桃样品中添加噻唑锌、噻菌铜、噻森铜和噻二唑标准溶液,添加水平均为0.01、0.1 和1 mg/kg,每个水平重复5 次,共重复3 个批次。结果表明,在0.01 ~ 1 mg/kg 添加水平下,噻唑锌、噻菌铜、噻森铜和噻二唑在猕猴桃中的平均回收率分别为82% ~ 92%、82% ~ 93%、81% ~ 91% 和85% ~ 91%,批内相对标准偏差(RSD) 分别为1.1% ~ 9.3%、2.2% ~ 8.1%、1.0% ~8.8%和2.5% ~ 7.5%,批间RSD 分别为3.9% ~7.5%、4.8% ~ 6.2%、4.1% ~ 6.1%和4.3% ~ 6.0%,方法定量限均为0.01 mg/kg。结果满足农药残留分析要求[10],且灵敏度较现有文献方法[11-13]更高。谱图及回收率结果分别如图3、图4 所示。

图3 噻唑锌、噻菌铜、噻森铜和噻二唑在猕猴桃中的添加回收试验MRM 谱图Fig. 3 MRM chromatograms of THIA, THIE, THIO and AMT in recovery tests in kiwi fruit

图4 噻唑锌、噻菌铜、噻森铜和噻二唑在猕猴桃中的添加回收率 (n=15)Fig. 4 Recoveries of THIA, THIE, THIO and AMT in kiwi fruit (n=15)
2.5 方法应用
为验证该分析方法的实际应用效果及可靠性,分别以本研究方法和文献中的传统方法[4](即采用0.1 mol/L 硫化钠溶液反应、乙腈提取、硫酸溶液调节pH 值、乙酸乙酯液液萃取) 对采集的猕猴桃试验样品进行检测。结果表明:两种方法测得的噻二唑类农药在猕猴桃上的残留量 (以噻二唑表示) 分别为0.23 mg/kg 和0.28 mg/kg,检测结果较为一致,表明方法可靠。
3 结论
通过对仪器检测条件、转化条件和提取净化方法的优化,建立了猕猴桃上施用噻唑锌、噻菌铜和噻森铜3 种噻二唑类农药后噻二唑残留量的超高效液相色谱-串联质谱分析方法。样品经氢氧化钠碱解反应、盐酸溶液调节pH 值、QuEChERS法提取净化即可满足分析要求,在0.01 ~ 1 mg/kg添加范围内,在猕猴桃中的平均回收率81% ~93%,RSD 最大为9.3%。方法高效、安全、环保、普适,可满足其残留风险监控的需要。

