冲击波对糖尿病慢性创面微环境下HaCat 细胞增殖及迁移的影响
康靖汶,盛炜,瓮长水,李美蓉,罗芸,张丽
1解放军总医院第二医学中心 康复医学科,北京 100853;2 解放军总医院第二医学中心 国家老年疾病临床医学研究中心,北京 100853;3 解放军医学院,北京 100853;4 解放军总医院第一医学中心 组织再生与创面修复科,北京 100853;5 解放军总医院医学创新研究部,北京 100853;6 解放军总医院第二医学中心 老年医学研究所,北京 100853
随着社会和经济的快速发展,糖尿病已经成为造成体表慢性创面的首要原因[1]。慢性创面治疗困难,花费巨大,严重影响患者健康状态、降低其生活质量,正在成为社会和家庭的重要负担。积极探索新型治疗方法,提高慢性创面愈合率,具有重要的临床、经济及社会价值[1]。体外冲击波疗法(extracorporeal shock wave therapy,ESWT)已在骨肌疾病临床治疗领域广泛应用[2],但在创面治疗中的应用尚属较新领域[3]。临床研究初步证实,ESWT 可促进糖尿病足创面、压力性溃疡等慢性创面愈合[4-5],但其机制有待深入研究。在创面愈合过程中,皮肤基底层表皮细胞的增殖和迁移功能对创面的成功上皮化具有重要作用[1]。本研究拟观察冲击波(shock wave,SW)对离体条件下糖尿病慢性创面(chronic diabetic wound,CDW)微环境中HaCat 细胞(人表皮角质形成细胞)增殖和迁移能力的影响,尝试从细胞水平探讨ESWT 促进CDW 愈合的作用机制。
材料与方法
1 实验细胞 人表皮角质形成细胞(human keratinocyte cell line,HaCat;细胞编号:3111C0001 CCC000373),购于中国医学科学院基础医学研究所细胞资源中心。
2 主要试剂与仪器 MEM-EBSS(minimum essential medium eagles with earle’s balanced salts)培养基,美国Sigma-Aldrich 有限公司;胎牛血清(fetal bovine serum,FBS),美国Gibco 公司;青霉素/链霉素液,中国南京凯基生物科技发展有限公司;胰蛋白酶(0.25% Trypsin-EDTA),中国南京拜睿生物科技有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS),中国北京索莱宝生物科技有限公司;葡萄糖溶液,美国Gibco 公司;细胞计数试剂盒(CCK-8),中国北京索莱宝生物科技有限公司;丝裂霉素C,美国Sigma-Aldrich 有限公司;96 孔细胞培养板及6 孔细胞培养板,美国Corning公司。
Dolor-Clast 型放散式体外冲击波治疗设备,瑞士EMS 公司;SW-CJ-1FD 型超净工作台,江苏苏州净化设备有限公司;HF151 型CO2细胞培养箱,上海力申科学仪器有限公司;XD-RFL 型生物相差倒置显微镜,宁波舜宇仪器有限公司;80-2型台式低速离心机,上海医疗器械股份有限公司医疗设备厂。
3 细胞分组 细胞分为5组,其干预方法如下。1)对照组:用葡萄糖浓度5 mmol/L 的MEM-EBSS培养基,模拟正常HaCat 细胞;2) CDW 组:通过高糖低氧孵育条件模拟糖尿病慢性创面微环境,建立糖尿病慢性创面细胞模型;3) SW1 组:针对糖尿病慢性创面细胞模型,进行冲击波干预,能流密度(energy flux density,ED) 0.05 mJ/mm2,500脉冲,频率8 Hz/s;4) SW2 组:针对糖尿病慢性创面细胞模型,进行冲击波干预,ED 0.10 mJ/mm2,500 脉冲,频率同上;5) SW3 组:针对糖尿病慢性创面细胞模型,进行冲击波干预,ED 0.10 mJ/mm2,1 000 脉冲,频率同上。
4 HaCat 细胞培养 HaCat 细胞培养于含10%胎牛血清、5 mmol/L 葡萄糖、100 U/mL 青霉素、100 U/mL 链霉素的MEM 培养基中,在恒温培养箱中以5% CO2、37℃以及饱和湿度条件下松盖培养,每2~ 3 d 换液1次,80% 铺满时进行消化、传代,直至第3 代(P3)。
5 细胞模型建立 HaCat 细胞培养于含10%胎牛血清、25 mmol/L 葡萄糖、100 U/mL 青霉素、100 U/mL 链霉素的MEM 培养基中,低氧状态采用混合缺氧气体预充方式(1% O2,5% CO2,94%N2),利用简易输液袋将培养好的HaCat 细胞培育瓶或培育板放入其中,用封口机密封后真空泵抽空袋内空气,随后将混合缺氧气体灌入袋中,保证输液袋内为含1% O2的缺氧气体,随后将输液袋放入5% CO2、37℃恒温培养箱中继续孵育相应时间[6-7]。
6 冲击波干预方法 取对数生长期的HaCat 细胞,胰酶消化、离心,调整为适宜的细胞浓度,采用放散式冲击波治疗设备,将36 mm 冲击波探头采用环氧乙烷进行灭菌消毒后,在严格无菌的条件下,根据各组不同干预参数,对HaCat 细胞悬液进行冲击波干预[8]。
7 HaCat 增殖能力测定 采用CCK-8 试剂盒检测HaCat 细胞增殖能力。方法如下:取对数生长期的HaCat 细胞,胰酶消化、离心,调整细胞浓度为l × 104/mL,进行ESWT 干预;将ESWT 干预后的HaCat 细胞悬液200 µL 加入到96 孔细胞培养板中,每孔2 000 个细胞,每组设8 个复孔;在37℃、5% CO2培养箱中培养24 h,在每孔加入CCK-8 溶液10 µL,在细胞培养箱内孵育3 h;采用全自动酶标仪在450 nm 测定吸光度(optical density,OD),其细胞增殖能力与吸光度成正比。检测时间为ESWT 干预后1 d、2 d、4 d、6 d、8 d。
8 HaCat 迁移能力测定 采用细胞划痕试验,方法如下:取对数生长期的HaCat 细胞,胰酶消化、离心,调整细胞浓度为5 × 105/mL,进行ESWT 干预;于6 孔板加入ESWT 干预后的细胞混悬液,每孔1.5 mL,于37℃、5% CO2培养箱中孵育12 h;PBS 清洗,加入含20 µg/mL 丝裂霉素C 的1640 培养基1.5 mL,继续于CO2培养箱中孵育12 h;取出6 孔板,用50 µL Tip 头比着直尺,垂直于孔板底部在单层贴壁细胞上划出划痕;PBS 清洗2次,去除脱落的细胞;加入MEM 培养基,于CO2培养箱中孵育,分别于0 h、12 h、24 h 用倒置相差显微镜观察细胞迁移情况,记录划痕宽度,拍照取样。每组设6 个复孔。用Image J 软件测量各时间点愈合划痕面积,并计算划痕愈合率,公式如下:
细胞划痕愈合率=(1-划痕面积/最初划痕面积) × 100%。
9 统计学方法 使用SPSS23.0 统计学软件进行统计分析。本研究数据主要为多组、多时间点观测的计量资料,均满足正态性分布,以表示。采用两因素重复测量方差分析+两组间比较LSD-t检验+组内两时点比较差值t检验。统计检验水准α=0.05,均为双侧检验。其中差值t检验属多次比较,按Bonferroni 校正法进行检验水准调整,α'=0.05/n,n 为多次比较的次数。
结果
1 不同干预条件对HaCat 细胞形态的影响 通过倒置相差显微镜观察,可见对照组HaCat 细胞呈梭形或多边形外观,胞液透明,排列紧凑,边界清楚;CDW 组HaCat 细胞形态未见异常,胞内可见密集、高亮折光点;不同剂量SW 组HaCat 细胞形态均未见异常,胞液清亮透明,与对照组比较无明显差异。见图1。

图1 倒置相差显微镜下不同干预组HaCat 细胞形态Fig.1 Morphological changes of HaCat cells in different groups under inverted phase contrast microscope
2 ESWT 干预对HaCat 细胞增殖活性的影响CCK-8 试验结果列示于下。经两因素重复测量方差分析,整体组间、组内(时间)及交互作用,差异均有统计学意义(P<0.05)。两两精细比较并结合主要数据分析:
1) ESWT 干预对HaCat 细胞增殖活性的影响:孵育1 d时,各组HaCat 细胞增殖活性无统计学差异(P>0.05);孵育2 d时,SW2 组细胞增殖活性增加明显,其OD450值:SW2 组>SW1 组>对照组>SW3 组>CDW 组(P<0.05);孵育4 d时,各组细胞增殖活性均有增加,以SW2 组最为明显,其OD450值:SW2 组>对照组>SW1 组>CDW 组>SW3 组(P<0.05);孵育6 d时,SW2 组和SW1 组细胞增殖活性增长明显,OD450值:SW2 组>SW1 组>SW3 组>对照组>CDW 组(P<0.05);孵育8 d时,各组细胞增殖活性显著下降,但仍以ESWT 干预组更强(P<0.05),提示不同处理对细胞增殖活性的影响显著。见表1。
2)不同孵育时间HaCat 细胞增殖活性的变化:HaCat 细胞增殖活性呈现出早期增加、后期下降的趋势,具体表现:干预后2 d,除CDW 组外,各组细胞增殖活性开始增加,之后增殖速度明显加快,在干预后6 d 达到增殖高峰,在干预后8 d 增殖活性显著下降,其OD450值:Day6>Day4>Day8>Day2>Day1,Day2 及其后各时点与Day1 比较差异有统计学意义(P<0.01),各组表现为相似的变化趋势和特征,尤以ESWT 干预组最明显。见表1。
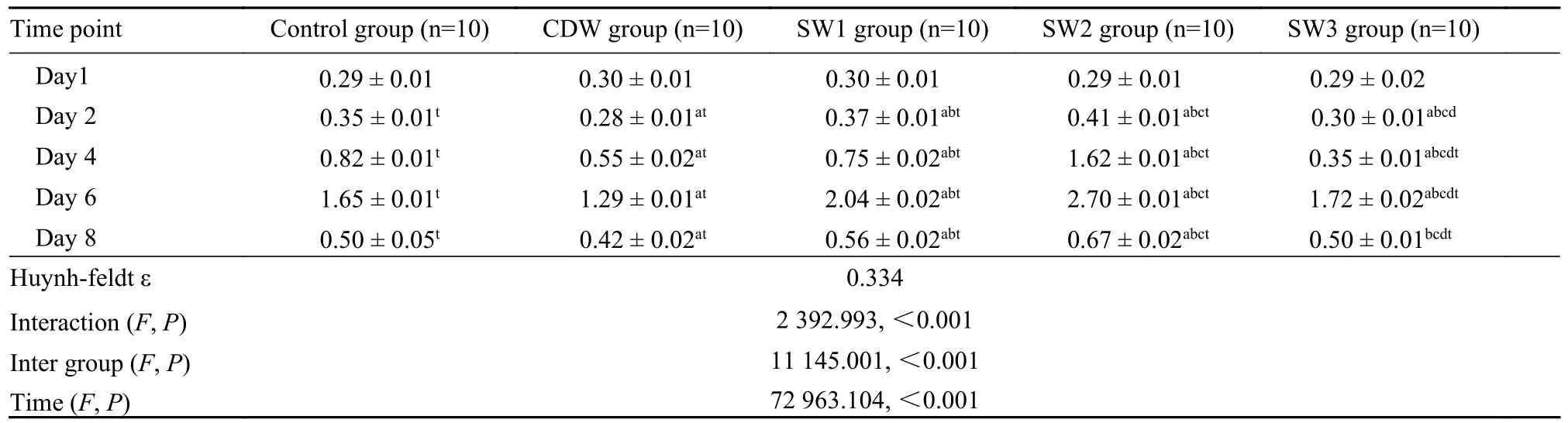
表1 各组HaCat 细胞增殖活性(OD450)Tab.1 Proliferation ability of HaCat cells in different groups by CCK-8 (OD450)
综合来看,不同剂量的ESWT 干预及孵育时间均对HaCat 细胞的增殖活性具有显著影响。3 冲击波干预对HaCat 细胞迁移能力的影响 冲击波干预对HaCat 细胞迁移能力的影响列示于下。亦经两因素重复测量方差分析,整体组间、组内(时间) 及交互作用,差异均有统计学意义(P<0.05)。两两精细比较并结合主要数据分析:各组HaCat 细胞划痕愈合率均随时间延长逐渐增加;划痕12 h 及24 h时,各组划痕愈合率:SW2 组>SW1 组>SW3 组>对照组>CDW 组(P<0.05)。见图2、表2。

表2 不同干预组HaCat 细胞划痕愈合率(%,n=6)Tab.2 Healing rate of HaCat cells in different groups by scratch assay (%,n=6)

图2 倒置相差显微镜下不同干预组HaCat 细胞迁移能力Fig.2 Migration ability of HaCat cells in different groups by scratch assay under inverted phase contrast microscope
讨论
慢性创面是一大类长期不愈或难愈的组织损伤,国际创面愈合学会将其定义为无法通过正常有序而及时的修复过程,达到解剖和功能上完整状态的创面[1]。
创面愈合是一个复杂而有序的生物学过程,涉及多种修复细胞、炎症细胞、炎症介质、细胞因子和细胞外介质等的共同参与,其中任何环节出现异常,都可能导致创面的延迟愈合或不愈合[9]。在此过程中,基底层表皮细胞不断增殖并向上迁移,并最终形成创面再上皮化,这是实现创面成功修复的关键步骤,因此表皮细胞的活性及功能对创面的愈合过程甚为重要[1,3]。而在糖尿病高糖微环境中,多种细胞的增殖能力受到抑制[10-11],创面局部表皮细胞也会数量减少、活性下降,创面再上皮化的进程受阻,从而延迟创面的愈合[12-13]。因此,重新激活糖尿病慢性创面微环境中表皮细胞的活性和功能,对加速糖尿病慢性创面的愈合具有重要意义。
本研究中选用的HaCat 细胞来自于正常人皮肤的永生化表皮细胞,具有增殖能力强、细胞培养条件简单等优点;根据文件检索[6]和前期预实验,选择高糖低氧孵育条件模拟糖尿病慢性创面局部微环境,其方法简便可行,HaCat 细胞形态未见显著改变,但细胞的增殖和迁移功能受到明显抑制,较为客观地反映了糖尿病慢性创面中表皮细胞的功能状态和生物学特征,保障了本研究的顺利实施。
ESWT 是利用冲击波的机械能量进行疾病治疗与康复的新型物理疗法[14],具有非侵入、安全、有效的特点,在难愈性骨折、骨不连、肌腱末端病等肌肉-骨骼系统损伤或疾病的治疗中广泛应用[14-15]。近年来,ESWT 治疗领域不断拓展,在年龄相关性退行性病变的治疗(如肌少症、骨质疏松症等)、创伤修复、再生医学领域也显示出独特优势[4,16-17]。现有临床证据初步证实,作为一种新型慢性创面的辅助治疗方法,ESWT 具有良好的临床应用前景[4-5],但其作用机制尚不明确。相关研究表明,冲击波的机械能量可能促进新生血管的形成和微循环改善[18-19]、调节局部炎症反应、刺激碱性成纤维细胞生长因子、基质细胞衍生因子、内皮生长因子等生长因子的表达[18,20]、诱导干细胞的增殖和多向分化等一系列生物反应[21],被认为是ESWT 促进慢性创面愈合效果的重要机制[22-23]。
细胞学研究证实,冲击波的机械能量可以刺激成纤维细胞[24-26]、成骨细胞、肌腱细胞、间质祖细胞[22]、骨髓干细胞、脂肪干细胞[22]、肌腱干细胞[27]等的增殖、迁移和(或)分化过程。目前尚无冲击波应用于表皮HaCat 细胞的相关研究。
本研究观察了不同剂量冲击波对糖尿病慢性创面微环境中人表皮HaCat 细胞形态以及增殖和迁移能力的影响,结果发现,与对照组相比,CDW 组HaCat 细胞的增殖和迁移能力均受到明显抑制,而冲击波作用后,HaCat 细胞的增殖和迁移能力显著增强,其增殖效应在干预后6 d 达到高峰。上述结果提示冲击波对HaCat 细胞的生物学效应,这可能是ESWT 促进慢性创面愈合的重要作用机制之一。在临床研究中,我们也观察到ESWT 治疗后,慢性创面再上皮化速度明显加快,佐证了ESWT 治疗机制可能与创面周围组织中表皮细胞的功能增强有关[5]。通过细胞实验与临床研究的结果相互印证,将为ESWT 在创面修复和再生医学领域的应用提供理论依据。
能流密度是反映冲击波能量的重要参数,描述单位面积冲击波能量的集中度[2]。根据2019年中国研究型医院学会冲击波医学专业委员会制定的《中国骨肌疾病体外冲击波疗法指南》[2]:按能量等级,将冲击波划分为低、中、高3 个能级:低能量范围为0.06~ 0.11 mJ/mm2,中能量范围为0.12~ 0.25 mJ/mm2,高能量范围为0.26~0.39 mJ/mm2。据此标准,本研究中所选择的冲击波能流密度均为低能量范围,具体输出剂量:SW3 组(0.10 mJ/mm2,1 000 脉冲)>SW2 组(0.10 mJ/mm2,500 脉冲)>SW1 组(0.05 mJ/mm2,500 脉冲);而进一步比较不同剂量冲击波对HaCat 细胞的生物学效应,结果发现SW2 组细胞的增殖和迁移能力增强最为明显,SW1 组次之,SW3 组低于前两组,提示在较低剂量冲击波作用时,对细胞促增殖效应更加明显,其中0.10 mJ/mm2、500 脉冲的干预剂量效果最佳;而在较高剂量的冲击波作用时,对细胞的促增殖效应相对减弱。该结果与既往基础和临床研究的结果一致,即过高能量的冲击波作用时,局部组织可能出现损伤性或抑制性反应[19]。上述剂量-效应关系将对ESWT 临床应用于慢性创面具有指导作用。
需要注意的是,创面愈合过程非常复杂,涉及到多种细胞类型和生物学过程,除表皮细胞的功能外,成纤维细胞、内皮细胞的增殖活性和功能、新生血管以及基质合成等生物学过程的参与亦非常重要。而本研究中,仅涉及冲击波对表皮细胞的作用和特点,而对其他细胞及生物学过程的效应研究还有待开展;另一方面,在分子生物学水平上,冲击波促进慢性创面愈合的信号通路和作用机制也有待更为深入的研究。

