利妥昔单抗治疗复发性原发性干燥综合征相关性干眼的疗效观察Δ
冉建川,龙正勤,任佑凡,冯新程,瞿 媛,何洪海,姚 林,尚林川,黄 丽(重庆大学附属黔江医院眼科,重庆409000)
原发性干燥综合征(primary Sjögren syndrome,pSS)是一种慢性炎症性自身免疫性疾病,可导致泪膜渗透压增加和眼表炎症,引起严重不适和视力障碍[1-3]。目前,pSS 的治疗以对症支持治疗为主,虽可在短期内控制pSS 病情,但是停药后又会复发[4-6]。研究结果显示,pSS 发病与B 细胞活化增加、免疫复合物形成和自身抗体产生有关[7]。利妥昔单抗是一种嵌合抗CD20 单克隆抗体,主要通过抗体依赖性细胞毒性或吞噬作用引起B 细胞耗竭,并可提高调节性T 细胞数量和增强其功能,在各种自身免疫性疾病治疗中有显著的临床疗效[8-9]。目前,利妥昔单抗在国外已被用于pSS 的治疗,且被证实可改善pSS 患者泪腺和唾液腺功能[10-11]。但国内相关报道十分少见。鉴于此,本研究拟探讨利妥昔单抗治疗复发性pSS 相关性干眼的疗效,旨在为临床治疗提供参考。
1 资料与方法
1.1 资料来源
本研究已经通过我院伦理委员会批准(PZ26152)。前瞻性选择2015 年1 月至2021 年8 月我院收治的81 例(162 眼)pSS 相关性干眼患者。纳入标准:(1)符合pSS 相关诊断标准[12],具备1 项或以上口腔症状(口干持续3 个月以上,成年后腮腺反复或持续肿大,吞咽食物需用水帮助)、1 项或以上眼部症状(眼干持续3 个月以上,反复砂子进眼或砂磨感,每日使用人工泪液3 次或以上)和眼部体征1 项或以上阳性[Schirmer Ⅰ试验阳性,角膜染色试验阳性(Bijsterveld 计分法≥4 分)],组织学病理检查显示下唇腺淋巴细胞灶≥l 灶(4 mm2组织内至少有5O 个淋巴细胞聚集于唇腺间质者为1灶),涎腺检查1 项或以上阳性(涎腺流率≤1.5 mL/15 min,腮腺造影阳性,涎腺同位素检查阳性),抗SSA 或抗SSB 抗体阳性;(2)符合《干眼临床诊疗专家共识(2013 年)》[13],具备典型眼睛异物感、灼热、酸痛,对光敏感性增加等干眼症状,眼部体征1 项或以上阳性;(3)接受糖皮质激素、免疫抑制剂等治疗后复发再次住院;(4)年龄18 周岁以上的成年患者,知情同意本研究内容,签署同意书。排除标准:系统性红斑狼疮、类风湿关节炎、局限性和进行性系统性硬化症、自身免疫性肝炎和甲状腺炎引起的继发性干燥综合征患者,排除其他类型pSS 对研究结果的影响;合并其他自身免疫性疾病者,排除其他类型自身免疫性疾病对研究结果的影响;妊娠期、哺乳期女性患者,排除特殊生理时期对研究结果的影响;随访失联者。采用随机数字表法将患者分为两组,观察组(40 例,80 眼)、对照组(41 例,82 眼)患者基线资料的均衡性良好,见表1。

表1 两组患者基线资料比较Tab 1 Comparison of baseline information between two groups
1.2 方法
(1)对照组患者入组后均接受局部和全身药物治疗,参考《干眼临床诊疗专家共识(2013 年)》[13]中的治疗原则和方法,晨起口服醋酸泼尼松片(规格:5 mg)0.3~0.5 mg/(kg·d),口服硫酸羟氯喹片(规格:100 mg)1 次100 mg,1 日1~3 次,注射用环磷酰胺(规格:0.1 g)1.2 g+5%葡萄糖注射液250 mL 静脉滴注,3~4 周治疗1 次,共治疗3~6 次,全身用药频率及用药时间根据干眼严重程度适当增减。局部治疗:轻度干眼采用羟糖甘滴眼液(规格:5 mL ∶羟丙甲纤维素291 015 mg,右旋糖酐705 mg 和甘油10 mg)1~2 滴滴眼,1 日4 次,中重度干眼采用羟糖甘滴眼液(规格同上)2~3 滴滴眼,1 日4 次,并增加重组牛碱性成纤维细胞生长因子眼用凝胶(规格:5 g)涂抹双眼,1 日3 次,根据病情和症状适当增加或按需使用。局部和全身治疗均持续8 周。
(2)观察组患者在对照组的基础上加用利妥昔单抗注射液(规格:500 mg/50 mL)375 mg/m2+5%葡萄糖注射液250 mL 静脉滴注治疗,每周治疗1 次,共治疗8 周。
1.3 观察指标
(1)干眼症状:治疗前、治疗后(治疗4 周结束后)采用标准干眼症状评估(SPEED)问卷[15],从眼部干涩感、异物感、疼痛、烧灼感或流泪4 个维度进行评分,分别从发生频率(0 分代表无;1 分代表偶尔;2 分代表经常;3 分代表总是)、严重程度(0 分代表无或代表轻度;1 分代表有不舒服,但不影响生活;2 分代表很不舒服,影响生活;3 分代表难以忍受),各维度得分相加为总分,满分0~24 分。(2)泪膜破裂时间:治疗前后采用荧光素钠眼科检测试纸条(试纸条57.0 mm×7.0 mm,含荧光素钠部分17.0 mm×5.0 mm,每条含荧光素1.0~1.5 mg,北京若水合科技有限公司)前段圆形部分浸入患者下睑结膜,嘱缓慢眨眼3~4 次,计算自最后1 次瞬目至泪膜出现第1 个黑斑的时间,>10 s 为正常。(3)Schirmer Ⅰ泪液分泌实验:治疗前后于安静和暗光环境中进行,不进行眼球表面麻醉,采用40 mm×5 mm 带毫米刻度的泪液检测滤纸(刻度范围0~30 mm,whatman41# 滤纸,前端标有荧光素钠标识线以观察湿长度,北京若水合科技有限公司)置入眼下结膜囊中外1/3 处,5 min 后取出滤纸,记录滤纸浸湿的长度,>10 mm 为正常。(4)角膜荧光素染色:治疗前后采用荧光素钠眼科检测试纸条前段圆形部分浸入患者下睑结膜,裂隙灯下观察角膜4 个象限染色程度并评分(0 分代表无染色;1 分代表<5 个着色点;2 分代表>5 个着色点但无融合;3 分代表着色点融合,呈块状或丝状),4 个象限评分相加为总分,总分0~12 分[14]。(5)观察两组患者药物相关不良反应,包括感染、血细胞减少、皮疹和胃肠道反应等。(6)停药后保持随访,观察停药期间pSS 相关性干眼复发情况,以再次出现干眼或干眼症状较治疗后加重为复发。
1.4 统计学方法
采用SPSS 25.0 软件进行数据分析,采用Shapiro-Wilk 检验进行正态性检验,计量资料以表示,两组间比较,采用独立样本t检验;治疗前后比较,采用配对t检验。偏态计量资料以M(Q1,Q3)表示,组间比较采用Wilcoxon 秩和检验。以例(%)表示计数资料,组间比较采用χ2检验或校正χ2检验。检验水准α=0.05。
2 结果
2.1 两组患者治疗前后SPEED 评分比较
两组患者治疗后SPEED 各维度评分和总分均较治疗前明显降低(P<0.01),观察组患者治疗后SPEED 各维度评分和总分均低于对照组(P<0.01),差异均有统计学意义,见表2。
表2 两组患者治疗前后SPEED 评分比较(,分)Tab 2 Comparison of SPEED scores between two groups before and after treatment (,points)
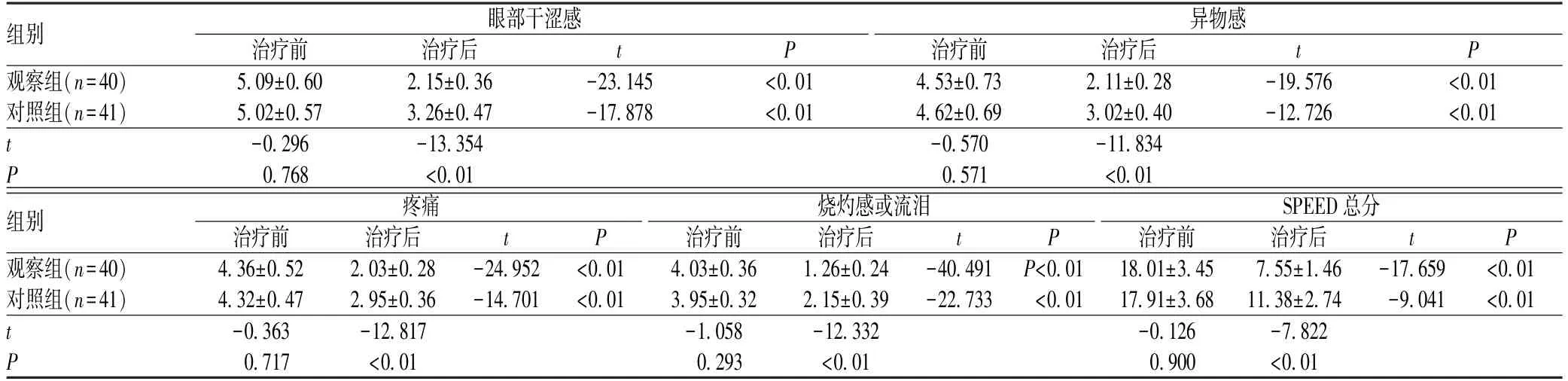
表2 两组患者治疗前后SPEED 评分比较(,分)Tab 2 Comparison of SPEED scores between two groups before and after treatment (,points)
2.2 两组患者治疗前后泪膜破裂时间比较
两组患者治疗后的泪膜破裂时间较治疗前延长(P<0.01),观察组患者治疗后的泪膜破裂时间长于对照组(P<0.01),差异均有统计学意义,见表3。
表3 两组患者治疗前后泪膜破裂时间比较(,s)Tab 3 Comparison of rupture time of tear film between two groups before and after treatment (,s)
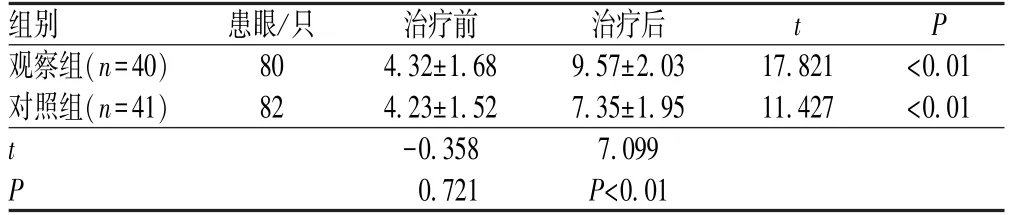
表3 两组患者治疗前后泪膜破裂时间比较(,s)Tab 3 Comparison of rupture time of tear film between two groups before and after treatment (,s)
2.3 两组患者治疗前后Schirmer Ⅰ泪液分泌实验结果比较
两组患者治疗后的Schirmer Ⅰ泪液分泌浸湿滤纸长度较治疗前增加(P<0.01),观察组患者治疗后的Schirmer Ⅰ泪液分泌浸湿滤纸长度大于对照组(P<0.01),差异均有统计学意义,见表4。
表4 两组患者治疗前后Schirmer Ⅰ泪液分泌实验结果比较(,mm)Tab 4 Comparison of Schirmer Ⅰ tear secretion test results between two groups before and after treatment (,mm)

表4 两组患者治疗前后Schirmer Ⅰ泪液分泌实验结果比较(,mm)Tab 4 Comparison of Schirmer Ⅰ tear secretion test results between two groups before and after treatment (,mm)
2.4 两组患者治疗前后角膜荧光素染色评分比较
两组患者治疗后的角膜荧光素染色评分较治疗前降低(P<0.01),观察组患者治疗后的角膜荧光素染色评分低于对照组(P<0.01),差异均有统计学意义,见表5。
表5 两组患者治疗前后角膜荧光素染色评分比较(,分)Tab 5 Comparison of scores of corneal fluorescein staining between two groups before and after treatment (,points)

表5 两组患者治疗前后角膜荧光素染色评分比较(,分)Tab 5 Comparison of scores of corneal fluorescein staining between two groups before and after treatment (,points)
2.5 两组患者不良反应和复发情况比较
观察组患者治疗期间出现1 例感染,1 例皮疹,2 例胃肠道反应;对照组患者出现1 例感染,1 例胃肠道反应,停药后均好转。观察组、对照组患者不良反应发生率比较(10.00%vs.4.88%),差异无统计学意义(P>0.05)。中位随访35(12~60)个月,对照组复发10 例,观察组复发2 例,观察组患者的复发率低于对照组(5.00%vs.24.39%),差异有统计学意义(P<0.05),见表6。

表6 两组患者不良反应发生情况和复发情况比较[例(%)]Tab 6 Comparison of incidences of adverse drug reactions and recurrence between two groups [cases (%)]
3 讨论
利妥昔单抗是人/鼠嵌合糖基化免疫球蛋白,对B 淋巴细胞跨膜蛋白CD20 具有特异性亲和力,通过特异性结合 CD20抗原诱导B 细胞死亡,达到消耗外周血和淋巴组织中强效B细胞的作用,利妥昔单抗给药2 周后淋巴结活检样本中的B 细胞数量可出现明显下降,且对B 细胞耗竭可一直维持到治疗后近6 个月[16]。利妥昔单抗已被用于治疗患有各种表达CD20 的淋巴恶性肿瘤(包括惰性和侵袭性B 细胞非霍奇金淋巴瘤)患者,且被证实有明确的疗效和良好的安全性,还可治疗狼疮性肾炎以及多发性硬化症[17-19]。利妥昔单抗也可用于眼科疾病的治疗,Ng 等[20]采用利妥昔单抗治疗难治性非感染性葡萄膜炎和巩膜炎,可显著抑制眼内炎症。2016 年美国pSS治疗指南中推荐利妥昔单抗用于治疗pSS 干燥性角结膜炎、口干以及全身症状者[21];在pSS 的治疗中,利妥昔单抗也被证实可刺激唾液和泪液分泌[22-23]。
本研究将利妥昔单抗用于治疗复发性pSS 相关性干眼,结果显示,治疗后,观察组患者的SPEED 评分、角膜荧光素染色评分较治疗前降低,且低于对照组;泪膜破裂时间延长,Schirmer Ⅰ泪液分泌浸湿滤纸长度增加,且大于对照组;通过随访发现,观察组患者的复发率低于对照组,表现出客观的短期和长期疗效,说明利妥昔单抗可促使泪腺分泌,改善pSS 相关性干眼症状,并可降低pSS 相关性干眼的复发率。pSS 相关性干眼发病与B 细胞活化有关,B 细胞可产生针对自身抗原的特异性抗体,这些抗体与相应抗原反应形成免疫复合物,通过补体和Fc 受体途径进一步刺激炎症细胞浸润。受累腺体内B细胞过度激活介导的大量炎症细胞浸润进一步破坏腺体组织,加之自身抗体的产生阻断上皮细胞副交感神经信号传导,最终导致泪腺分泌量减少[7]。因此,B 细胞被认为是pSS 最有希望的治疗靶点[24]。抑制B 细胞活化可能使pSS 相关性干眼患者获益。CD20 是B 细胞向成熟淋巴细胞分化过程中表达的抗原,参与B 细胞生长和分化调节,表达于前B 细胞和成熟B 细胞,但在B 细胞分化为浆细胞后消失,CD20 是消耗B 细胞的理想靶点。利妥昔单抗可特异性结合CD20 抗原,通过抗体依赖性细胞毒性、抗体依赖性细胞吞噬作用、补体依赖性细胞毒性途径诱导B 细胞死亡[18];继而抑制B 细胞过度活化诱导的炎症反应和自身抗体产生,减轻泪腺腺体组织损伤,恢复泪腺上皮细胞神经信号传导,最终促使泪腺分泌,改善患者干眼症状。利妥昔单抗介导补体依赖性细胞毒性途径可能通过以下2 种途径实现:(1)Fc 部分通过与自然杀伤细胞、粒细胞和巨噬细胞表面膜结合Fcγ 受体相互作用激活效应细胞释放细胞毒性颗粒酶,介导抗体依赖性细胞毒性途径[17];(2)利妥昔单抗还可与补体C1q 结合,固定补体蛋白到抗体表面,介导补体依赖性细胞毒性途径[25]。本研究中,观察组与对照组患者不良反应发生率的差异无统计学意义(P>0.05),表明利妥昔单抗治疗pSS 相关性干眼不增加不良反应风险,具有一定的安全性,适合复发性pSS 相关性干眼的治疗。
综上所述,利妥昔单抗治疗复发性pSS 相关性干眼患者,可显著促使泪腺分泌,改善干眼症状,降低复发风险,安全性可靠,优于常规糖皮质激素和免疫抑制剂治疗。但本研究样本量有限,可能导致统计学偏倚,尚待进一步扩大样本量加以证实。

