大腹园蛛重组嵌合蛛丝蛋白:一种高分子量的生物材料
贾秋品,孟 清
(东华大学 生物科学与技术研究所,上海 201620)
蜘蛛丝近年来一直是生物医学和材料学等领域的研究热点[1-2],这不仅是由于其媲美甚至超越已知天然和人造材料的机械性能,即超高的强度、延展性和韧性[3],还因其优异的生物相容性和生物可降解性[4]。圆网蜘蛛体内不同形态的丝腺可分泌多达7种不同的蛛丝蛋白,由它们组成的蛛丝纤维具有不同特性并在蜘蛛生长觅食和繁衍过程中承担不同的职责[5]。例如,由葡萄状腺分泌的葡萄状腺丝蛋白(AcSp)可组成高延展性和拉伸强度的葡萄状腺丝,用于包裹猎物和构成卵囊的柔软内层[6]。
蜘蛛丝的功能各异,但不同的蛛丝蛋白结构均由三部分组成,即非重复的N端结构域(NT)、中间的重复结构域(Rep)和非重复的C端结构域(CT)[7]。其中,NT和CT序列长度大多为130 bp左右,且在不同蜘蛛来源的蛛丝蛋白间具有高序列保守性[8],这两个结构域对蛛丝蛋白在腺体内的高浓度储存和丝纤维组装过程的启动起着重要的作用[9];而占据蛛丝蛋白组成90%以上的Rep结构域则具有较低序列保守性[10],不同的蛛丝蛋白由不同长度的重复模块单元组成,且重复次数甚至可以达到上百次[5],这些不同重复模块的组合决定了不同蜘蛛丝独特的材料学性能[10]。例如,AcSp蛋白的重复区所含有的重复模块长度通常超过200个氨基酸,这些模块中富含A2、S2-5以及高比例的Gly、Ala、Ser[6,8],而缺乏在主壶腹腺丝蛋白(MaSp)和次壶腹腺丝蛋白(MiSp)中常见的较短重复模块如polyGA、polyA、GGXn和GPGGXn等[11]。这种重复区组成的差异导致由AcSp蛋白组成的葡萄状腺丝拉伸强度低于主次壶腹腺丝,但延展性远高于后两者[12-13]。
研究人员为得到高性能的人造蛛丝材料,设计并生产了多种重组蛛丝蛋白。这些重组蛋白通常只含有一个或多个重复模块,或者在重复模块外加上N端和/或C端结构域[14-16];此外,这些重组蛛丝蛋白的产量通常很低,无法满足大规模应用的需求;蛋白的分子质量低,和天然蛛丝蛋白质的分子质量200~400 ku相比差距太大[3,17-18];且大多数重组蛋白溶解度偏低,远远达不到天然蛛丝蛋白在蜘蛛腺体内的超高储存质量浓度(300~500 mg/mL)[19]。这些都可能是导致由重组蛛丝蛋白生产的蛛丝纤维性能尚不及天然蛛丝的主要原因。因此,有必要生产具有高溶解性且蛋白分子质量高的新型重组蛛丝蛋白,从而为获得高性能的蛛丝纤维创造可能。
构建含有3个结构域的重组嵌合蛛丝蛋白iN7RC,其组成成分包括来自MiSp非重复的末端结构域NT和CT,以及来自AcSp重复区的7个重复模块R,并且这些蛛丝基因均源于大腹园蛛(Araneusventricosus)。通过大肠杆菌原核表达系统成功表达分子质量高达162.5 ku的重组蛛丝蛋白,通过尿素纯化的方法得到高纯度蛋白,接下来使用圆二色谱(CD)分析蛋白溶液在不同pH值条件下的二级结构组成,通过手工牵拉的方法制备重组蛛丝纤维,并对丝纤维的机械性能进行测试和表征。
1 材料和方法
1.1 材料和试剂
质粒DNA提取、PCR产物回收、胶回收试剂、SDS-PAGE/DNA凝胶电泳试剂和化学试剂药品等均购自生工生物工程(上海)股份有限公司;质粒载体pT7来自瑞典合作实验室;基因克隆和蛋白表达使用的大肠杆菌感受态细胞均来自天根生化科技(北京)有限公司;TaqDNA聚合酶购自南京诺唯赞生物科技公司,其他PCR反应试剂购自美国NEB公司;酶切和连接反应相关试剂购自美国Thermo Fisher Scientific公司;DNA引物合成和基因测序均在生工生物工程(上海)股份有限公司完成。
1.2 克隆构建
重组蛛丝蛋白的3个结构组分均源自大腹园蛛Araneusventricosus的蛛丝基因,其中末端结构域NT和CT来自次壶腹腺蛛丝MiSp(GeneBank No.JX513956)[18],重复区Rep来自葡萄状腺丝AcSp(GeneBank No.MG021196)[8]。在前期构建得到的iN1RC基因序列[20]基础上[构建过程中的PCR结果见图1(a)~(d)],通过已报道的“head-to-tail”首尾相连的基因构建策略[21],借助NheI/SpeI 2种同尾酶和HindIII普通限制性内切酶来完成质粒中重组模块R的多次添加[部分酶切结果见图1(e)和(f)],以最终获得含有7个重复模块R的iN7RC质粒(克隆构建示意图见图2)。克隆构建筛选过程均在大肠杆菌E.coliDH5α菌株中进行,筛得的阳性克隆通过核苷酸基因测序鉴定iN7RC基因序列的正确性。

图1 克隆构建中的PCR扩增和酶切结果
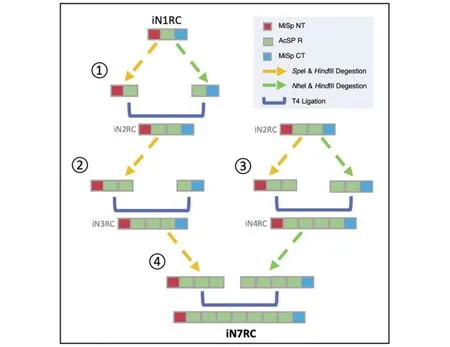
图2 iN7RC的克隆构建策略示意图
1.3 重组蛋白的表达和纯化
将含有正确基因序列的质粒转化到大肠杆菌E.coliBL21(DE3)表达菌株中,在37 ℃和180 r/min条件下和含有70 μg/mL卡那霉素的LB培养基中过夜培养。将10 mL含有表达菌株的过夜培养物接种至1 L含有相同浓度卡那霉素的LB培养基中,在30 ℃和180 r/min条件下扩大培养至OD600为0.8~1.0时,加入终浓度为0.3 mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG),在20 ℃和220 r/min条件下过夜培养诱导蛋白表达。通过离心(4 500 r/min,20 min,4 ℃)收集菌体,用20 mmol/L pH 8.0的Tris缓冲液重悬细胞,并在-20 ℃冻存以待纯化。
使用高压细胞破碎仪JN-3000(JNBIO,中国)破碎解冻后的细胞和培养基的混合物,将细胞裂解物离心(4 500 r/min,20 min,4 ℃),收集含有目的蛋白的不溶包涵体沉淀。用含有2 mol/L尿素pH 8.0的20 mmol/L Tris缓冲液清洗收集到的沉淀,即在冰水浴中以50 r/min匀速旋转的水平振荡仪上孵育3 h;通过离心(4 500 r/min,20 min,4 ℃)弃掉上清液,将得到的沉淀再次重悬于含有6 mol/L 尿素pH 8.0的20 mmol/L Tris缓冲液中,同上条件孵育1 h以溶解目的蛋白;然后再次离心(4 500 r/min,20 min,4 ℃)收集含有目的蛋白的上清液,在20 mmol/L pH 8.0的Tris缓冲液中透析,得到不含尿素的可溶重组蛛丝蛋白溶液。检测蛋白质在280 nm处的吸光度,以确定蛋白质的得率和纯化得到的蛋白质浓度,使用SDS-PAGE测定蛋白质的纯度并对蛋白大小进行鉴定。
1.4 蛋白可溶性鉴定
使用浓缩离心管(Millpore,美国)在4 000 r/min和 4 ℃条件下以20 min时间间隔反复离心浓缩重组蛛丝蛋白iN7RC直到出现不溶沉淀为止,再通过超高速离心去除沉淀,取5 μL蛋白浓缩液稀释200 倍到1 mL,使用分光光度计(HiTACh,日本)测量A280(蛋白在280 nm处吸光度值)以计算浓缩后的蛋白浓度,即蛋白的溶解度。
1.5 圆二色谱(CD)分析
将纯化后的目的蛋白稀释到pH值分别为7.5、6.5和5.5的20 mmol/L 磷酸缓冲液中,至终质量浓度为~0.5 mg/mL。在25 ℃下,通过CD光谱仪(Applied Photophysics Ltd.,英国),扫描波长190~260 nm,收集光谱信号。具体参数设置:光程为0.1 cm,扫描步长为0.5 nm,响应时间为1 s,带宽为1 nm,扫描3次。CD光谱取3次扫描的平均值。
1.6 蛛丝纤维制作方法
按照参考文献[20]中的方法进行手动牵丝。在室温条件下,取20~100 μL质量浓度为1 mg/mL的蛋白溶液(溶剂为20 mmol/L pH 8.0 Tris 缓冲液)到干净的玻璃载玻片上,使用镊子在6 mm/s左右的均匀速度下牵出丝纤维,并平直固定在1 cm × 1 cm的纸质框架上。
1.7 纤维表面形态表征
将干燥的丝纤维样品黏附在样品座导电胶上,喷金45 s,然后将样品放入扫描电子显微镜(Phenom-World BV,荷兰)的样品槽中,调整放大倍数,显微观察,并在室温10 kV的加速电压下拍照。
1.8 纤维机械性能测试
通过倒置相差显微镜(Leica Microsystems,德国)在400×放大倍数下对纤维样品拍照。纤维直径测量方法:在纤维样品图片中根据标尺大小测量和计算3个位置的纤维直径的平均值,即为纤维直径。
选取粗细均匀、无结节的纤维样品使用Agilent T150 UTM纳米传感拉伸仪(Agilent Technologies,美国),在20 ℃和50%左右湿度条件下对丝纤维进行机械性能测试。样品长度为1 cm,在每秒0.2% 拉伸量的速度下匀速拉伸直到丝纤维断裂。使用Agilent NanoSuite软件记录并计算丝纤维的断裂拉伸强度,弹性拉伸、杨氏模量和韧性等性能参数。
1.9 蛋白序列分析
使用ExPASy网站(www.expasy.org)的在线工具对蛋白序列以及其亲疏水性进行分析和预测。
2 结果与讨论
2.1 重组蛛丝蛋白的表达和纯化
在大肠杆菌BL21菌株中重组嵌合蛛丝蛋白iN7RC以包涵体的形式成功表达,经过尿素洗涤纯化和透析得到目的蛋白。通过SDS-PAGE电泳对诱导前后的大肠杆菌总蛋白样品以及纯化后的目的蛋白进行分析,结果如图3所示。其中,诱导后的总蛋白(泳道2)与诱导前的总蛋白(泳道 1)相比,在160 ku以上有明显的新条带。离心收集诱导后的菌体进行破碎,通过SDS-PAGE电泳分析显示目的蛋白位于不溶包涵体中,针对包涵体蛋白使用尿素进行纯化,即使用含有低浓度2 mol/L 尿素的缓冲液对包涵体进行洗涤,去除杂质蛋白,再使用含有高浓度6 mol/L尿素的缓冲液对剩余的目的蛋白进行溶解,再通过透析的方法将高浓度的尿素除去,得到纯度高于90%的目的蛋白(如图3泳道3)。

M为蛋白标记物;1、2分别为IPTG诱导前和诱导后的总蛋白;3为尿素纯化后的iN7RC蛋白。
使用分光光度计对蛋白进行吸光度测量,计算得到每升培养基中iN7RC重组蛛丝蛋白的产量为34 mg/L,并测定iN7RC蛋白在低浓度Tris缓冲液中的溶解度高达67 mg/mL。众所周知,在大肠杆菌中原核系统中表达异源蛋白的难度与蛋白分子质量呈正相关,即异源蛋白分子质量越大,表达量越低,再加上蛛丝蛋白基因本身的高GC含量和不稳定性[5],在大肠杆菌中表达高分子质量的重组蛛丝蛋白难度更高。本研究中,在大肠杆菌中表达蛋白分子质量高达162.5 ku的重组蛛丝蛋白,得到34 mg/L的表达量与之前已报道的研究相比属于较高水平,例如,同样含有蛛丝蛋白3个结构域的重组蛛丝蛋白NTW4CT[16],虽然分子质量仅有103.8 ku,其大肠杆菌中的产量为35 mg/L;只含有重复模块和CT重组蛛丝蛋白Sfl3CT[22],蛋白质分子质量仅为94 ku,其大肠杆菌中的产量仅有2.5~3 mg/L。
通过ExPASy网站分析蛋白质序列中各氨基酸的亲疏水性(如图4),其中,纵坐标的得分正值表示疏水性,负值表示亲水性,分值越高即表示该位置的氨基酸的亲疏水性越高。预测结果显示NT区域亲水性较高,Rep区(7R)亲水和疏水区域交错分布,CT区疏水性较前两者高。目前对天然蛛丝蛋白的研究表明,蛛丝蛋白在腺体内高浓度储存的原因在于蛋白的氨基酸序列,包括末端非重复区域对pH值的不同响应[15, 23],以及蛋白溶液状态下的折叠状态,使其可以以表面亲水、疏水区包埋在内的微球结构很好地在水溶液中储存而不会产生聚集。所以本研究中iN7RC蛋白氨基酸序列中,虽CT表现出较高疏水性,但由于蛋白序列的绝大部分区域亲疏水性均匀,这很可能是蛋白表达量和后续蛋白可溶性仍保持相对较高水平的主要原因。

图4 iN7RC蛋白序列的亲疏水性预测
2.2 重组蛛丝蛋白的二级结构分析
通过圆二色谱(CD)研究重组蛛丝蛋白iN7RC的溶液状态在不同pH值下的二级结构组成情况。根据CD光谱曲线显示(图5),在pH 7.5条件下的光谱曲线在193 nm附近有一个正峰,在208 nm和222 nm处有两个负峰,这种典型的光谱曲线表明蛋白溶液在pH 7.5条件下的二级结构组成中α-helix占据主导地位[24]。当pH值为6.5和5.5时,蛋白溶液的光谱曲线显示α-helix结构的3个特征峰的峰值显著降低。这些结果表明,随着pH值的降低,在组成重组蛛丝蛋白iN7RC二级结构组分中α-helix的主导地位逐渐减弱,有部分α-helix结构在低pH条件下转变为其他结构。蛋白质二级结构中α-helix结构组分的减少是与天然蛛丝蛋白成丝过程中对逐渐降低的pH值响应结果是一致的[5]。
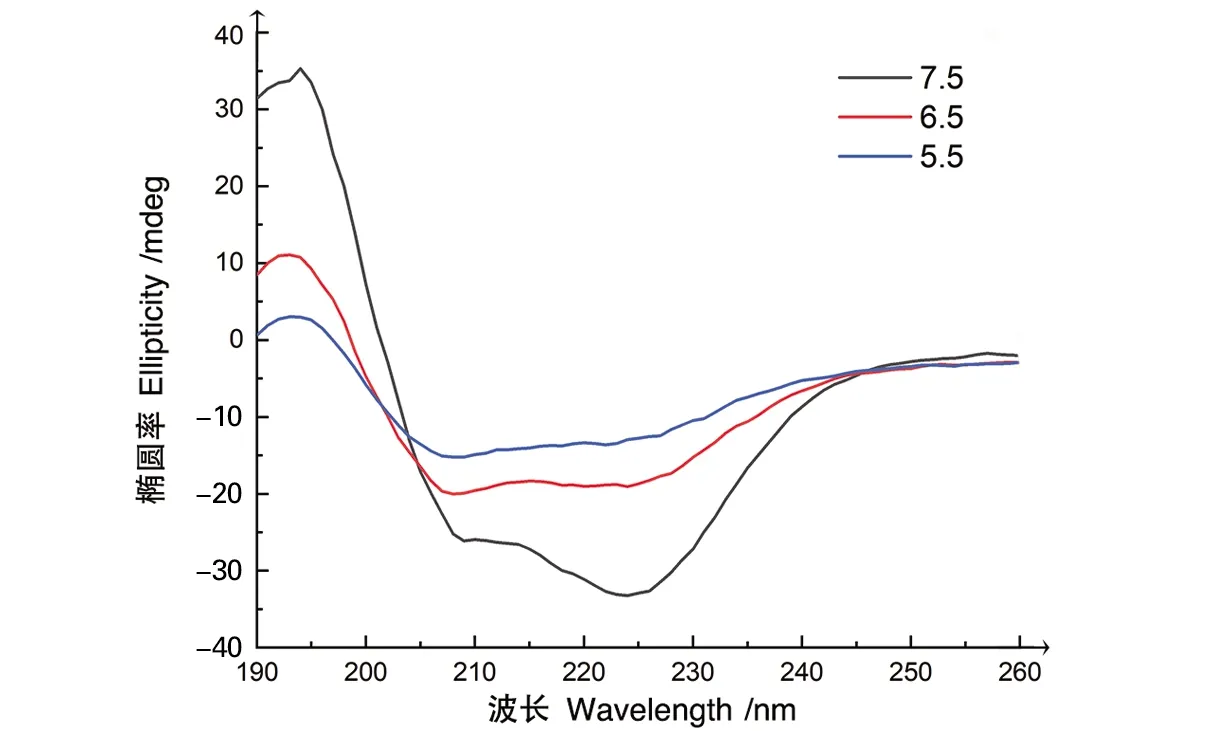
图5 iN7RC蛋白溶液在不同pH下的圆二色谱图
结果表明,含有天然蛛丝蛋白3个典型结构域的重组蛛丝蛋白,在应对pH值变化的应答中,有和天然蛛丝类似的结构转变过程,但具体的转变结果和其中的二级结构,如α-helix、β-sheet和random coil等的组成占比变化,还有待后续实验进一步验证。
2.3 重组蛛丝纤维的形态和性能表征
通过手工牵拉的方法从质量浓度为1 mg/mL的iN7RC蛋白溶液(溶剂为20 mmol/L pH 8.0 Tris缓冲液)中成功拉出蛛丝纤维,制作长度为1 cm的丝纤维样品,使用倒置相差显微镜对纤维样品进行拍照测量直径,选取粗细均匀、无结节或粘连、直径相差较小的丝纤维用于后续纤维性能测试。使用扫描电子显微(SEM)对蛛丝纤维的表面形态进行观察和表征,如图6所示,iN7RC重组蛛丝蛋白形成的蛛丝纤维具有与天然蛛丝相似的光滑表面,但其2 μm左右的直径与天然蛛丝相比较大[12]。

丝纤维直径为ø 2.11 μm;放大倍数(a)为5 000×;(b)为10 000×;(c)为20 000×。
使用纳米拉伸仪对纤维进行机械性能测试得到iN7RC丝纤维样品的应力-应变曲线(图7),其中,应力(stress)为纤维拉伸强度,应变(strain)为纤维的可延展性[20]。iN7RC蛛丝纤维性能曲线显示出丝纤维的两个典型应力-应变阶段,即随着机械性能测试拉力的持续作用,丝纤维最初显示弹性形变直至屈服点后,发生不可逆的塑形形变,这与天然蛛丝的应力-应变特性是相似的[15]。虽然,蛛丝纤维的总体性能取决于多条纤维的平均机械性能,但值得注意的是,在单个纤维样品性能测试结果中,iN7RC蛛丝纤维的拉伸强度最高可达480 MPa,延展性最高可达测量起始长度的147.5%。

图7 iN7RC丝纤维的应力-应变曲线
选取8条iN7RC丝纤维的机械性能测试数据进行平均,得出iN7RC丝纤维的总体机械性能数据,并与iN1RC以及天然AcSp和MiSp蛛丝性能比对,结果如表1所示,iN7RC丝纤维的平均拉伸强度为344.7 MPa±81.3 MPa,与之前研究中的iN1RC丝纤维(187 MPa±81 MPa)相比增加了近一倍[20],为天然AcSp蛛丝纤维拉伸强度(687 MPa±56 MPa)的一半[1,12];iN7RC丝纤维的平均延展性为38%±0.7%,虽仍不及AcSp蛛丝纤维的一半[12],但已达到了天然MiSp蛛丝纤维(22%±7%)的1.7倍[25];iN7RC丝纤维的韧性平均为101.7 MJ/m3±27.8 MJ/m3,几乎是iN1RC的5倍,但由于其拉伸强度和延展性均与天然AcSp蛋白有不小的差距,因此其韧性还未能达到天然AcSp的水平;此外,iN7RC丝纤维的杨氏模量(7.4±2.6)GPa和iN1RC(6.9±3.2)GPa相比较没有明显的提升,但这个结果是可以推测到的。因为iN1RC虽然只含有一个重复区,其丝纤维的杨氏模量已达到了天然蛛丝纤维(9.8±3.8)GPa的70%,而天然丝纤维中有14个重复[8],所以iN7RC丝纤维的杨氏模量没有显著提升是可以预见的。
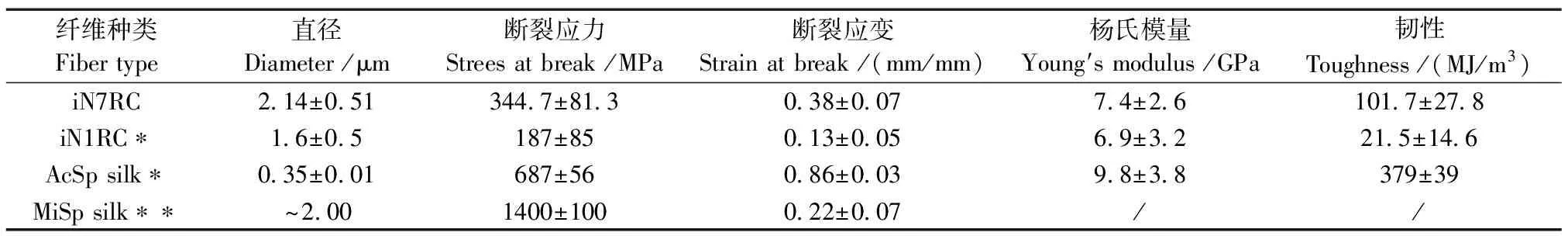
表1 iN7RC丝纤维与其他人工和天然蛛丝纤维的机械性能比较
本研究中设计表达的嵌合重组蛛丝蛋白iN7RC,其基因序列由来自MiSp和AcSp两种蛛丝蛋白基因的拼接组成。通过以上比较可以发现,IN7RC丝纤维结合了MiSp蛛丝纤维高拉伸强度和AcSp蛛丝纤维高延展性的优点。通过两种蛛丝基因的嵌合重组蛛丝蛋白所制备的iN7RC纤维,来自MiSp的末端非重复序列因为AcSp序列的加入,丝纤维的延展性较天然MiSp蛛丝纤维有了显著的提升;来自AcSp的7个重复单元因为MiSp序列的加入,虽然丝纤维的拉伸强度还未达到天然AcSp蛛丝纤维的水平,但已经达到天然AcSp蛛丝纤维的一半,鉴于其远低于天然AcSp的蛋白分子质量,而组成蛋白的分子质量与丝纤维的性能有很大的正相关性[21],从这个方面来看,iN7RC丝纤维的拉伸强度较天然来说确实是有提高的。此外,从表1可以看到这些丝纤维的直径不尽相同,其中,iN7RC丝纤维的直径最大,而丝纤维直径与丝纤维的机械性能的各方面都有密切关联[20],这也是造成丝纤维延展性高而拉伸强度和韧性均未达到天然蛛丝水平的部分可能原因。在今后研究中考虑尝试其他纺丝方法,如静电纺丝等,改变蛛丝纤维性质,优化蛛丝纤维的机械性能。
3 结论
选取大腹园蛛的两种蛛丝基因,将AcSp重复区结构域的7个重复模块R与MiSp非末端重复结构域NT和CT拼接构建蛋白分子质量高达162.5 ku的嵌合重组蛛丝蛋白iN7RC。在原核表达系统大肠杆菌细胞中以包涵体的形式表达,通过尿素纯化和透析方法得到纯度高于90%的重组蛋白,蛋白产量高达34 mg/L,高于已知高分子质量的重组蛛丝蛋白,并且其溶解度可以达到67 mg/mL。此外,通过手工牵拉的方法得到的结合AcSp蛛丝高延展性和MiSp纤维高拉伸强度的高性能重组蛛丝纤维,其中,其拉伸强度为天然AcSp蛛丝的50%,延展性为天然MiSp蛛丝的1.7倍。综上,高产表达并具有高纯度高溶解度的重组嵌合蛛丝蛋白iN7RC及其高性能的重组蛛丝纤维,为生物医学和材料学等领域提供了潜在的生物材料。

