长链非编码RNA KUCG1通过MAGEA11调节PTEN/AKT/mTOR途径促进ccRCC舒尼替尼的耐药性①
汪浩洋 毛正发 邹元章 卢俅董迪 姚勤 陈兵海
(江苏大学附属医院,镇江 212001)
近年肾癌发病率逐年递增,且肾癌发病率与年龄增长密切相关[1]。2018年全球肾癌病死人数超过175 000例[2]。肾透明细胞癌(clear cell carcinoma of kidney,ccRCC)占 成 人 肾 细 胞 癌70%以 上[3]。ccRCC对放化疗均不敏感,手术治疗是其主要治疗方式,但ccRCC缺乏早期临床特征,导致部分患者就诊时已失去根治性手术的机会[4]。即使切除肿瘤,仍有20%~30%患者出现复发或远处转移[5]。
分子靶向药物的出现给肿瘤治疗提供了新的视角[6]。舒尼替尼是一种血管内皮生长因子受体(VEGFR)靶向抑制剂,可通过抑制血管生成而抑制肿瘤细胞生长,明显改善晚期肾癌患者预后[7-8]。但长期使用舒尼替尼会诱导肿瘤耐药,加上部分患者先天性耐药,限制了该药物的应用[9]。肿瘤旁路信号激活可导致舒尼替尼耐药,但耐药机制尚不明确[10]。因此,揭示舒尼替尼耐药的潜在机制并逆转耐药性迫在眉睫。
随着基因测序技术发展,发现了数以万计的长链非编码RNA(long non-coding RNA,lncRNA)。研究显示,lncRNA在调控细胞功能、疾病和肿瘤发生发展过程中发挥重要作用[11-12]。但lncRNA影响舒尼替尼耐药的分子机制鲜有报道。
KUCG1是新近发现的lncRNA,又名LINC00850,最初由TRAN等[13]在杜氏肌营养不良患者中发现,KUCG1下调可能与精神发育迟滞相关。但目前尚无相关文献阐释KUCG1的具体功能。而KUCG1表达、临床意义和对舒尼替尼耐药性的影响尚无相关研究。本研究通过体外试验研究KUCG1对ccRCC细胞增殖、侵袭及凋亡的影响,研究KUCG1对ccRCC细胞舒尼替尼耐药性的作用,并探讨其可能分子机制。
1 材料与方法
1.1 材料769-P和786-O肾癌细胞株购自ATCC;293-T细胞株购自汉恒生物科技有限公司(上海);RNA提取试剂盒购自超研生物科技有限公司(上海);逆转录试剂盒、qPCR试剂盒购自诺维赞生物科技有限公司(南京);凋亡试剂盒购自福麦斯生物技术有限公司(南京);酶标仪(Multiskan GO)购自Thermo公司;流式细胞分析仪购自美国BD公司。
1.2 方法
1.2.1 细胞培养769-P和786-O肾癌细胞培养于RPMI1640培 养基,293-T细胞 培养 于DMEM培养基,所有培养基均含10%胎牛血清(FBS)、100 U/ml青霉素、100µg/ml链霉素,培养条件:37℃、5%CO2。
1.2.2 qPCR检测提取细胞总RNA,逆转录为cDNA,qPCR试剂盒检测基因表达,以2µl cDNA作为qPCR反应模板,以GAPDH为内参,KUCG1正向引物序列:5'-TGCCTTCATCCCATTGTCCT-3',反向引 物 序 列:5'-AGACATGGCACCACTGATGA-3';MAGEA11正向引物序列:5'-ATGCTGGGGAGTGT‑CATCAA-3',反向引物序列:5'-ATGCAGTTCCCCTCCATGAA-3';GAPDH正向引物序列:5'-GAGTCAACGGATTTGGTCGT-3',反向引物序列:5'-TTGATTTTGGAGGGATCTCG-3'。2-ΔΔCt法计算,实验重复3次。
1.2.3 慢病毒感染慢病毒感染试验参考文献[14]。采用REV、GAG、VAVG 3种质粒构建慢病毒系统,包装CRISPR/Cpf1-KUCG1基因序列的质粒后感染293-T细胞获取病毒液。病毒液感染肾癌769-P和786-O细 胞,构 建 稳 定 低 表 达KUCG1的769-P和786-O肾癌细胞株KUCG1(-)-1、KUCG1(-)-2。感染后培养24 h更换为含10%FBS的完全培养基。
1.2.4 细胞转染采用吉玛制药技术有限公司(上海)的siRNA转染试剂向稳定低表达KUCG1的769-P和786-O肾癌细胞转染siRNA-MAGEA11和阴性对照(NC),转染6 h后更换为含10%FBS的完全培养基。siRNA-MAGEA11正向引物序列:5'-GCACUACUUUCCUGAGAUATT-3',反向引物序列:5'-UAUCUCAGGAAAGUAGUCCTT-3';NC正向引物序列:5'-UUCUCCGAACGUGUCACGUTT-3',反向引物序列:5'-ACGUGACACGUUCGGAGAATT-3'。
1.2.5 CCK-8将细胞接种至96孔板,100µl/孔,密度为5 000个/孔。孵育4 h,加入舒尼替尼(10µmol/L)分别处理769-P和786-O细胞72 h和120 h,每48 h更换1次培养基。加入CCK-8试剂37℃孵育2 h,酶标仪测量各孔450 nm处吸光度值。实验重复3次。
1.2.6 侵袭实验将细胞悬浮于500 µl不含FBS的培养基,添加至小室上室(5 000个/室)。将500µl含10%FBS的完全培养基添加至小室下室,37℃孵育24 h,棉签擦拭过滤器上侧,冷甲醇固定过滤器,0.1%结晶紫染色30 min。随机选择多个区域进行细胞计数和拍照。
1.2.7 流式细胞术分析细胞凋亡采用凋亡试剂盒分析细胞凋亡,冷的PBS洗涤细胞,采用250µl结合缓冲液重新悬浮(1×106个/ml)。取100 µl加入2.5 µl Annexin V/Alexa Flour 488和5 µl碘化丙啶避光孵育15 min,流式细胞仪测量样品荧光强度,FlowJo_V10软件分析数据。
1.2.8 Western blot收集细胞,加入含磷酸化酶抑制剂和PMSF的RIPA裂解液冰上裂解30 min,4℃、13 000 r/min离心10 min,取上清,采用蛋白标准曲线测定蛋白浓度,-80℃储存。SDS-PAGE凝胶电泳分离蛋白,转至PVDF膜,3%BSA封闭1 h,加入一抗4℃孵育过夜。TBST洗涤3次,加入二抗孵育2 h,TBST洗涤3次,化学发光成像仪获取图像,Image J软件分析条带灰度,以GAPDH为内参。
1.3 统计学分析采用SPSS18.0软件进行统计学分析,数据采用方差分析(ANOVA),以±s表示。GraphPad Prism8软件绘图,P<0.05为差异具有统计学意义。
2 结果
2.1 KUCG1表达下调与ccRCC舒尼替尼耐药相关本研究建立一个包括244个lncRNA的gRNA文库,采用CRISPR/cas9技术将244个lncRNA gRNA文库感染769-P细胞,得到下调244个lncRNA的769-P细胞文库,舒尼替尼(10µmol/L)作用6 d后得到舒尼替尼耐药的769-P细胞,对244个lncRNA进行qPCR检测,结果显示,与未处理的769-P细胞相比,处理后细胞KUCG1表达明显下降(P=0.004,图1A、B、D)。推测KUCG1与肾癌细胞舒尼替尼耐药有关,其位于染色体Xq28区域,长度为54 092个核苷酸(图1C)。TCGA数据库中发现,与正常组织相比,肾癌组织中KUCG1表达明显下调(图1E)。
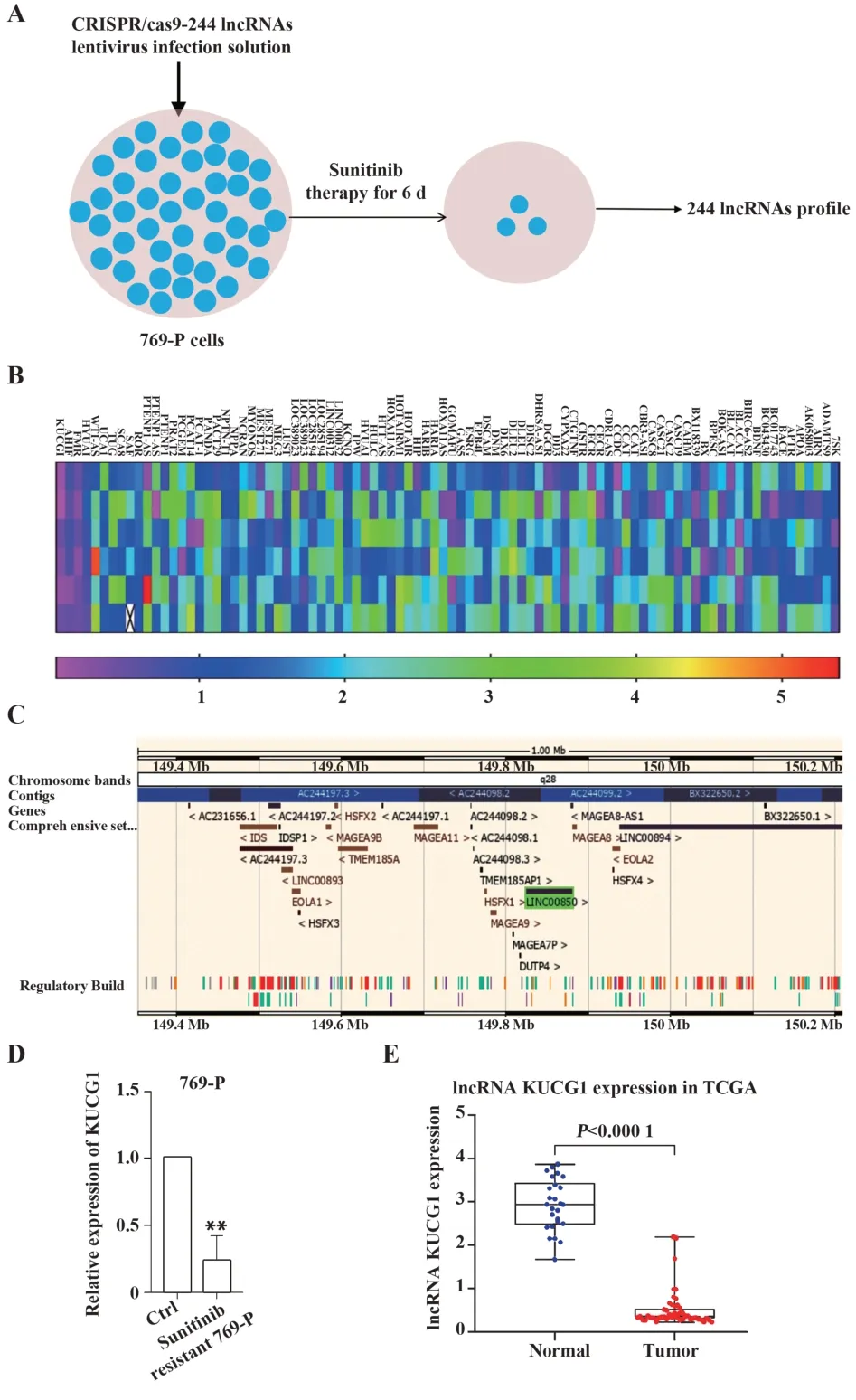
图1 KUCG1(LINC00850)与舒尼替尼耐药有关Fig.1 KUCG1(LINC00850)is related to sunitinib resis⁃tance
2.2 KUCG1表达下调诱导ccRCC对舒尼替尼的耐药性为研究KUCG1对ccRCC细胞舒尼替尼耐药性的影响,以769-P和786-O ccRCC细胞建立稳定低表达KUCG1的细胞株(图2A),CCK-8结果显示,舒尼替尼以时间依赖的方式抑制肾癌细胞活力,而KUCG1低表达显著提高两种细胞对舒尼替尼的耐药性,提高769-P和786-O细胞生存能力(图2B)。舒尼替尼处理48 h后,对照组比KUCG1下调组出现明显形态学改变,包括细胞极性消失、细胞膜收缩、细胞质空泡化(图2C)。提示KUCG1下调可促进肿瘤细胞增殖和生长,降低肿瘤细胞对舒尼替尼的敏感性。
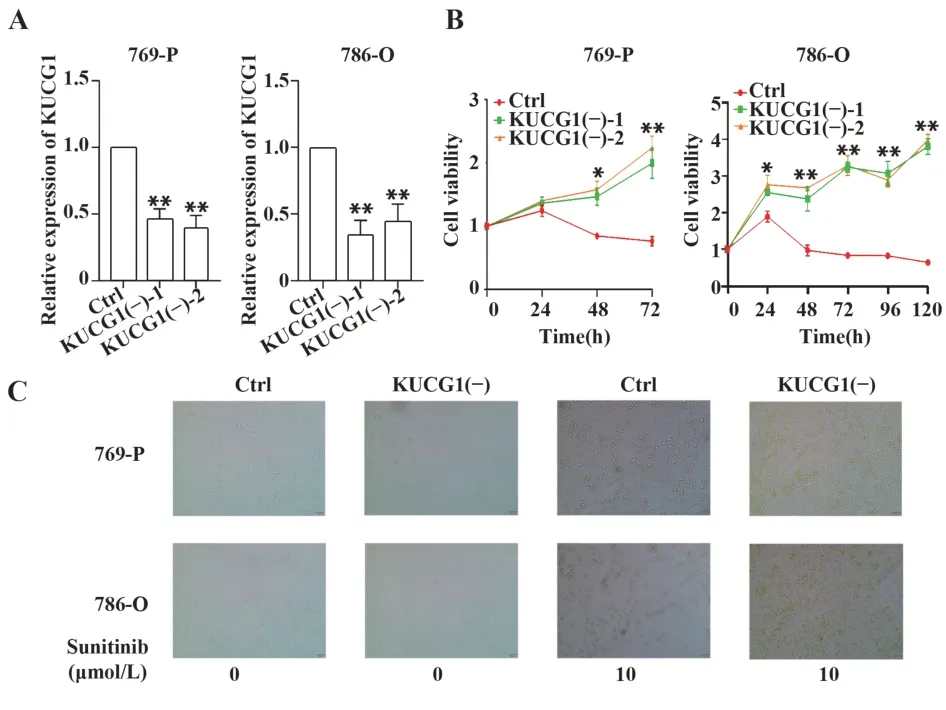
图2 KUCG1表达下调诱导ccRCC细胞舒尼替尼耐药性(×400)Fig.2 Down-regulation of KUCG1 expression induced sunitinib resistance in ccRCC cells(×400)
2.3 KUCG1表达下调促进肾癌细胞侵袭,抑制其凋亡侵袭实验结果显示,KUCG1下调,肾癌细胞侵袭细胞数明显多于对照组(图3A),提示KUCG1表达下调促进肿瘤细胞侵袭。采用流式细胞仪分析KUCG1下调对ccRCCs细胞凋亡的影响,结果显示,KUCG1下调,肾癌细胞凋亡率明显下降(图3B),提示KUCG1下调可抑制肾癌细胞凋亡。
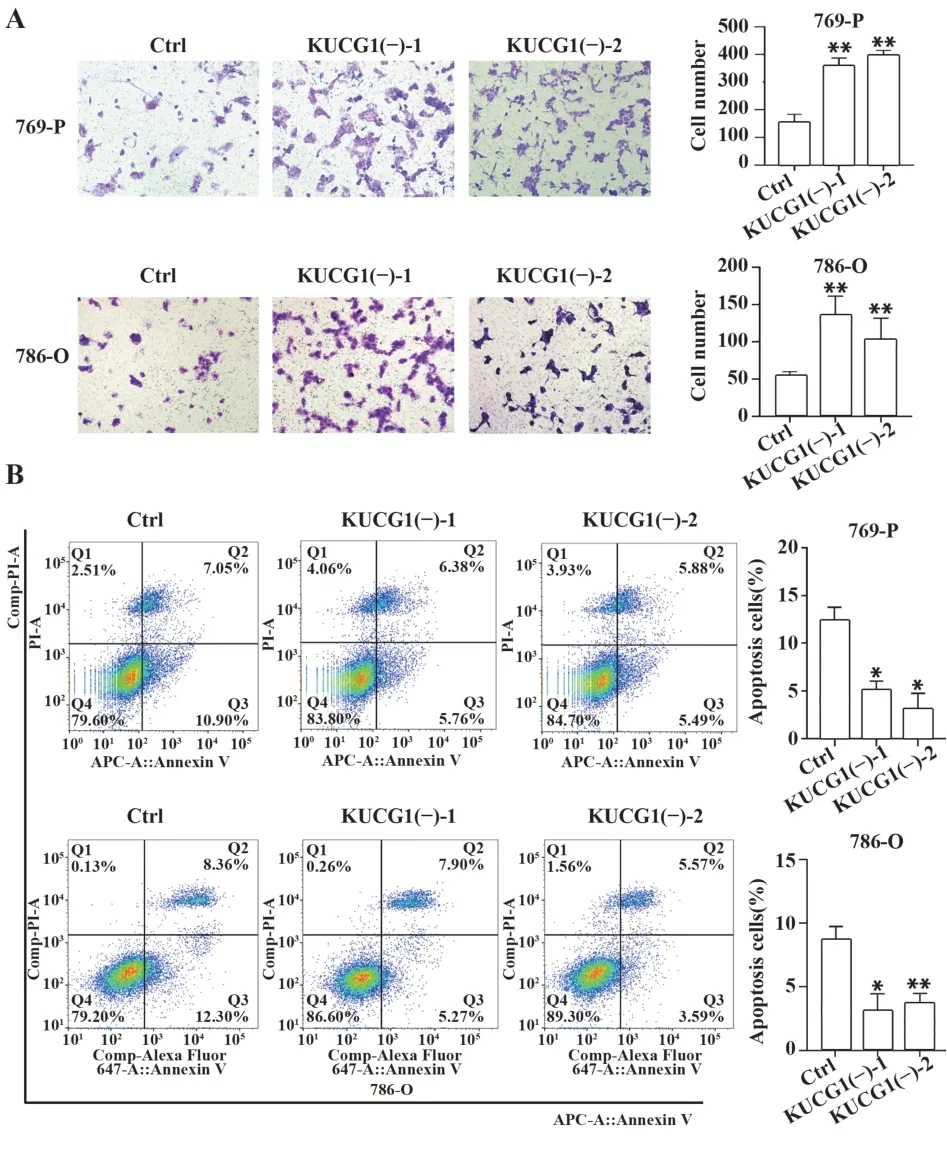
图3 KUCG1表达下调增强肾癌细胞侵袭及抗凋亡能力(×400)Fig.3 Down-expression of KUCG1 enhanced invasion and anti-apoptosis ability of renal carcinoma cells(×400)
2.4 KUCG1表 达 下 调 可 调 节PTEN/AKT/mTOR信号通路Western blot检测KUCG1下调对PTEN/AKT/mTOR信号通路相关蛋白表达的影响,结果显示,KUCG1下调,肾癌细胞mTOR和p-AKT表达增加,PTEN表达降低(图4)。KUCG1通过调节相关蛋白表达增强肾癌细胞增殖和侵袭,并增强其耐药性。
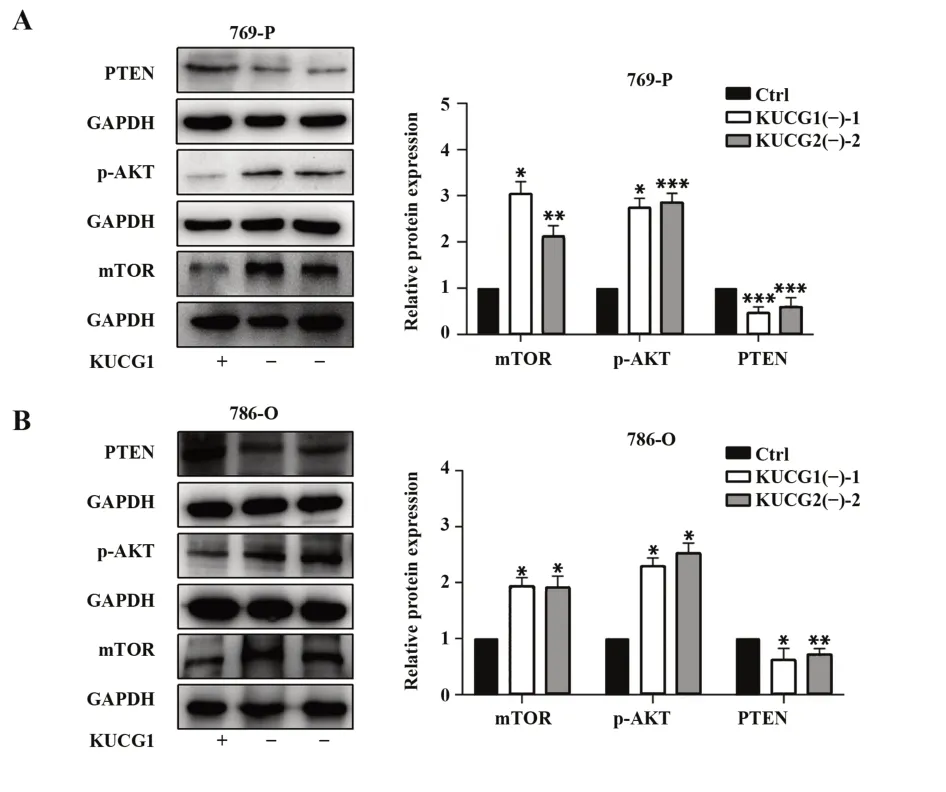
图4 KUCG1下调后PTEN/AKT/mTOR信号通路相关蛋白表达Fig.4 Expressions of PTEN/AKT/mTOR signal-related proteins after KUCG1 down-regulation
2.5 KUCG1通过上调MAGEA11表达促进肿瘤细胞增殖KUCG1前后1 Mb基因表达情况分析结果显示,与未处理的肾癌769-P细胞相比,舒尼替尼耐药的肾癌细胞MAGEA11表达明显升高且变化最为显著,786-O细胞株同样表现出相同结果(图5A),推测KUCG1可能通过调控MAGEA11表达影响肾癌细胞生物学行为。Western blot结果显示,实验组相比对照组细胞MAGEA11蛋白水平明显升高(图5B)。为进一步研究KUCG1基因下调后促进肿瘤细胞增殖的分子机制,采用siRNA下调实验组细胞MAGEA11表达,并采用qPCR和Western blot验证其MAGEA11下调结果(图5B、C)。STRING数据库查询发现,MAGEA11可通过调控AKT/mTOR信号通路影响肿瘤细胞生物学行为。Western blot检测PTEN/AKT/mTOR信号通路发现,MAGEA11下调后mTOR和p-AKT表达下降,PTEN表达上升(图6)。表明KUCG1下调通过上调MAGEA11表达增强细胞活力,促进细胞增殖,并增强其耐药性。
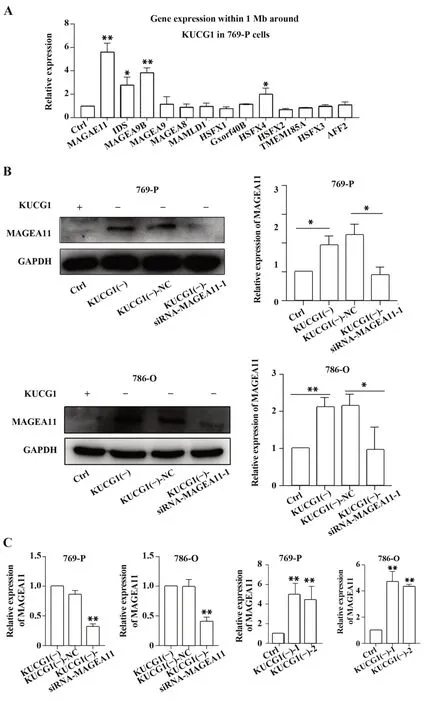
图5 KUCG1调控MAGEA11表达Fig.5 KUCG1 regulates expression of MAGEA11
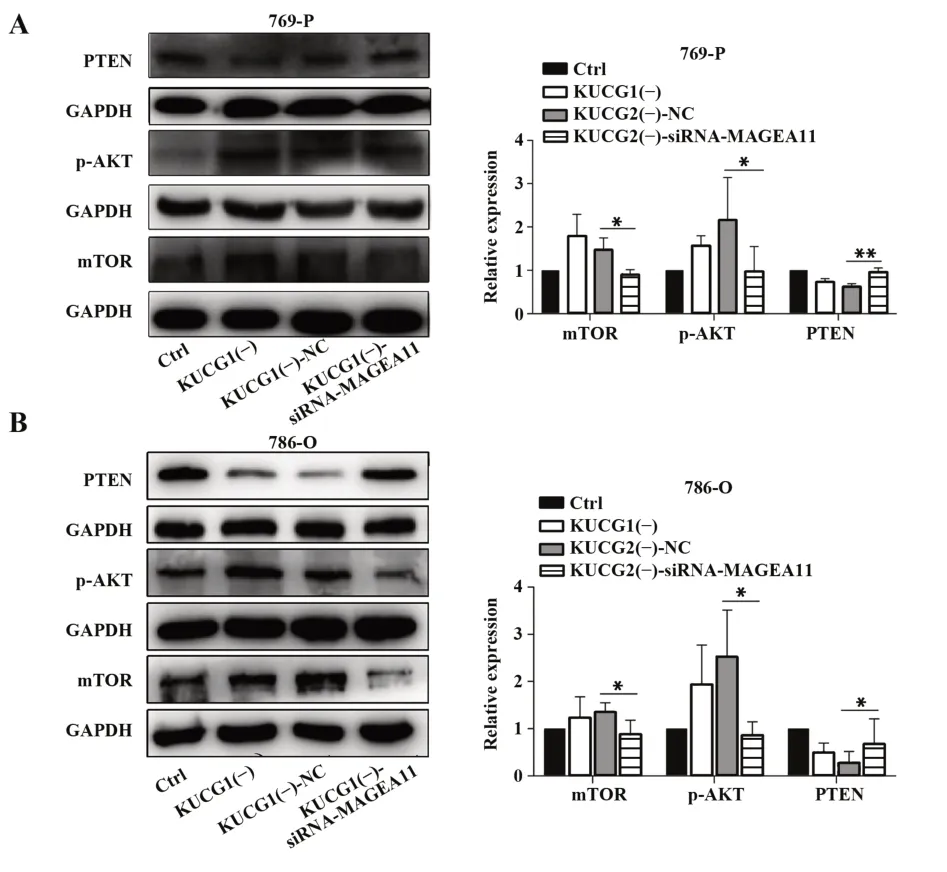
图6 MAGEA11影响PTEN/AKT/mTOR信号通路相关蛋白表达Fig.6 MAGEA11 affects expressions of PTEN/AKT/mTOR signaling pathway related proteins
2.6 MAGEA11表达下调肾癌细胞增殖、侵袭减弱,凋亡增强为验证MAGEA11对肾癌细胞生物学行为的影响,采用siRNA-MAGEA11下调769-P肾癌细胞KUCG1下调组MAGEA11表达,CCK-8、侵袭和凋亡实验结果显示,MAGEA11表达下调后肾癌细胞增殖和侵袭能力较处理前明显降低,凋亡明显增强(图7)。
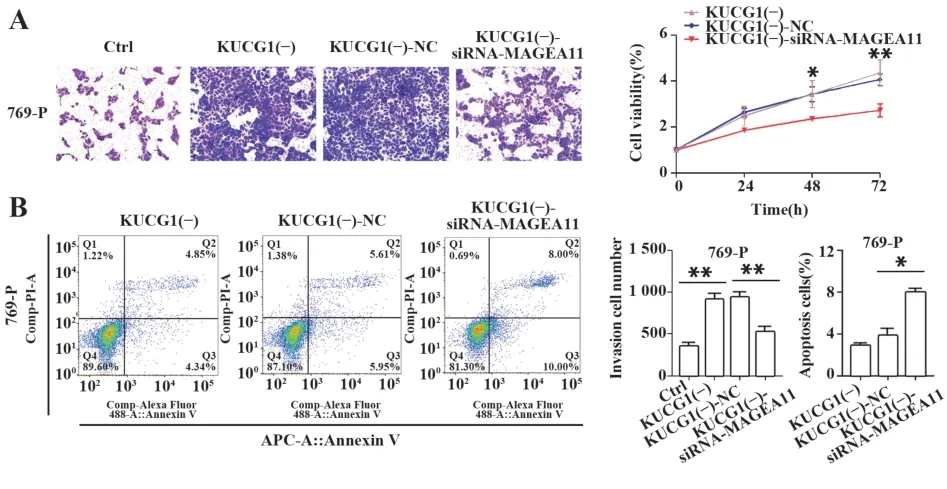
图7 MAGEA11表达下调影响肾癌细胞生物学行为(×400)Fig.7 Down-regulation of MAGEA11 expression affects biological behavior of renal cell carcinoma(×400)
3 讨论
本研究显示,舒尼替尼以剂量依赖的方式抑制肿瘤细胞生存能力。KUCG1表达下调增强肿瘤细胞活力和对舒尼替尼的耐药性。流式细胞术结果显示,KUCG1下调后抑制肾癌细胞凋亡,可能依赖于细胞周期激活。G1/S期转换过程中,周期蛋白依赖激酶(CDK)和细胞周期蛋白D和E结合维持细胞循环正常进行[15]。KUCG1下调可能促进细胞周期蛋白D和E表达,或与细胞周期蛋白/CDK复合物抑制剂表达降低有关,促进细胞循环及细胞生长。
KUCG1下调促进肿瘤细胞侵袭。显微镜下观察细胞形态变化,表明药物诱导细胞损伤。KUCG1下调可抵抗舒尼替尼杀伤效应。舒尼替尼可通过抑制上皮-间质转化(epithelial-mesenchymal transi‑tion,EMT)过程抑制肿瘤细胞增殖、侵袭和转移。EMT过程中,由于上皮钙黏蛋白表达减少导致上皮细胞极性丧失,细胞间黏附减少,诱导肾癌细胞侵袭和转移[16]。同时肿瘤细胞耐药性与EMT密切相关。KUCG1可能通过促进EMT促进肿瘤细胞增殖、侵袭、转移和耐药。
晚期肾癌患者对靶向药物产生耐药性,目前临床无有效治疗方法。肿瘤对一线TKI药物产生耐药的可能机制包括:血管生成信号激活后血管再生;增加覆盖的被膜细胞保护脉管系统;改变肿瘤微环境及增强肿瘤的侵袭和转移加强脉管系统再生以及其他旁路信号激活[17-18]。因此,探索舒尼替尼耐药的分子机制,寻找新的作用靶点是临床研究重点。肿瘤细胞生长抑制是由于药物介导的AKT、MAPK、STAT等信号通路被抑制[19]。PTEN低表达与舒尼替尼耐药密切相关。本研究发现,KUCG1在舒尼替尼耐药肾癌细胞中低表达。KUCG1表达下调,PTEN表达被抑制,AKT/mTOR信号通路被激活,ccRCCs舒尼替尼的耐药性增强。AKT/mTOR是经典生存信号通路,与细胞活力密切相关,而PTEN表达可抑制此通路。
KUCG1对临近编码基因MAGEA11可能通过Cis调控机制进行调控,即KUCG1通过顺式作用元件,包括增强编码基因启动子、增强子活性、调控序列和可诱导元件等激活转录和调控基因表达[20]。KUCG1可能通过形成多个RNP复合物或编码微肽参与基因转录调控。lncRNA还可增强RNA聚合酶Ⅱ活性,此外,lncRNA调节miRNA表达,反过来抑制编码基因和miRNA靶向结合[21]。lncRNA还可通过lncRNA-mRNA/miRNA相互作用调节肾细胞癌MAGEA11表达[22]。MAGEA11是肿瘤种系抗原,通过介导DNA低甲基化、血管形成和肿瘤转移等多种途径促进肿瘤细胞增殖生长及对多种化疗药物耐药,并在黑色素瘤、前列腺癌和食管癌等多种肿瘤细胞中高表达[23-25]。且MAGEA11表达对于细胞自噬至关重要[26]。本研究发现KUCG1下调后两种肾癌细胞株中MAGEA11表达明显增加。为验证MAGEA11表达对肾癌细胞特性的影响,直接利用siRNA敲减MAGEA11表达,MAGEA11表达下调后肿瘤细胞增殖、侵袭受抑制,表明KUCG1表达下调通过促进MAGEA11上调增强肾癌细胞活性,增强肾癌细胞耐药性。
KUCG1通过磷酸化和促进AKT信号传导抑制细胞凋亡。KUCG1正向调节PTEN表达,反向调节p-AKT水平,而p-AKT和mTOR通过MAGEA11表达升高,因此,KUCG1通过调节MAGEA11表达影响PTEN/AKT/mTOR信号通路。而mTOR又可正向调节细胞周期蛋白D和E表达,从而促进细胞周期进展,促进细胞增殖[27]。因此,KUCG1通过MAGEA11调节PTEN/AKT/mTOR信号通路促进肿瘤细胞耐药性。
综上,KUCG1通过促进细胞周期、抑制凋亡和促进AKT信号通路促进肾癌细胞增殖和侵袭,本研究证明KUCG1下调可降低肾透明癌细胞对舒尼替尼药物的敏感性,降低药物治疗效果。KUCG1通过MAGEA11上调影响PTEN/AKT/mTOR信号通路。本研究证实,KUCG1可降低晚期肾癌患者临床治疗效果,为寻找耐药靶点提供了新的思路,将通过临床研究进一步验证。

