卡瑞利珠单抗联合安罗替尼治疗晚期胃癌的疗效及对近期预后的影响Δ
沈 旺,杜雲雲,罗明莹,肖志季,彭黎铭
(重庆医科大学附属南川人民医院肿瘤血液科,重庆 408400)
胃癌是全球恶性肿瘤相关死亡排序居第4位的恶性肿瘤,晚期胃癌预后更差,中位总生存期仅为10~12个月[1]。目前,晚期胃癌的综合治疗手段十分有限,以铂类和氟尿嘧啶类药物为主的一线化疗失败后,二线治疗效果的个体差异大,缺乏有效的后线治疗手段[2]。随着分子靶向治疗、免疫治疗的出现,尤其是免疫检查点抑制剂的问世,晚期胃癌三线治疗格局可能发生重大改变。安罗替尼是我国自主研发的多靶点小分子酪氨酸激酶抑制剂,可通过靶向抑制血管内皮生长因子受体、血小板衍生生长因子受体和成纤维细胞生长因子受体等阻断肿瘤血管形成,临床用于治疗二线化疗后进展或复发的晚期恶性肿瘤,被证实可改善无进展生存期和总体生存期,且Ⅲ级不良反应发生率低[3]。卡瑞利珠单抗是程序性细胞死亡受体1(PD-1)抑制剂,通过阻断PD-1与其配体程序性死亡受体配体1结合,激活T淋巴细胞,诱发持续的抗肿瘤效应[4]。目前卡瑞利珠单抗已经获得全球批准上市,用于治疗复发或难治性经典霍奇金淋巴瘤、食道鳞状细胞癌和肝细胞癌等多种实体肿瘤[5],被证实可显著改善晚期或转移性食管鳞状细胞癌患者的总体生存率[6]。本研究尝试采用卡瑞利珠单抗与安罗替尼联合三线治疗晚期胃癌,探讨其疗效,报告如下。
1 资料与方法
1.1 资料来源
选取2019年1月至2020年1月我院收治的ⅢB—Ⅳ期二线治疗失败的胃癌患者100例。纳入标准:(1)胃镜/腹腔镜取病理组织学确诊为胃癌,TNM分期为ⅢB—Ⅳ期[7];(2)基因检测表皮生长因子受体突变,免疫组织化学检测提示胃癌组织PD-L1阳性;(3)既往接受以伊立替康和紫杉类为主的二线化疗,治疗后未缓解或进展;(4)美国东部肿瘤协作组(ECOG)体力状态评分0~2分,无明显肝肾损伤。排除标准:(1)TNM分期Ⅰ—ⅢA期,行手术治疗者;(2)二线治疗失败后放弃治疗者或死亡患者;(3)预期存活时间<3个月,严重肝肾损伤者。采用随机数字表法将患者分为对照组和观察组,每组50例,患者均知情同意。本研究已通过伦理委员会批准,伦理批准号为181206。
1.2 方法
对照组患者口服盐酸安罗替尼胶囊(规格:10 mg)10 mg,第1—14日,3周为1个治疗周期,治疗4个周期。观察组患者采用注射用卡瑞利珠单抗(规格:200 mg)200 mg,第1日静脉注射;口服盐酸安罗替尼胶囊(规格同上)10 mg,第1—14日,3周为1个治疗周期,治疗4个周期。治疗期间静脉注射阿扎司琼预防恶心、呕吐,每周检测1次血常规、肝肾功能,治疗4个周期后进行疗效评价。
1.3 疗效评定标准
参考RECIST 1.1版实体肿瘤疗效评价标准:完全缓解(CR),显影消失,全部淋巴结短直径减少至<10 mm;部分缓解(PR),显影直径缩小>30%;稳定(SD),显影直径减少≤30%或增大<20%;进展(PD),显影直径增大>20%,或出现1个或以上新发病灶[8]。客观有效率(ORR)=(CR病例数+PR病例数)/总病例数×100%,疾病控制率(DCR)=(CR病例数+PR病例数+SD病例数)/总病例数×100%。
1.4 观察指标
(1)治疗前后分别采集患者外周静脉血5 mL,分别注入干燥试管和肝素抗凝试管,干燥试管标本待血液凝固后取血清离心(转速3 000 r/min,离心半径10 cm,时间5 min)处理后上机检测,采用Multiskan Sky High全波长酶标仪(美国赛默飞科技公司),应用酶联免疫吸附试验检测血清血管内皮生成因子(VEGF)水平,试剂盒为仪器配套(批号为AD1058)。抗凝试管标本检测外周血CD4+T细胞上PD-1表达、CD8+T细胞上PD-1表达,以CD4单克隆抗体、CD8单克隆抗体和PD-1单克隆抗体(购自武汉艾美捷科技有限公司)标记,采用EPICS-XL型流式细胞仪(美国贝克曼库尔特有限公司)检测。(2)记录治疗期间反应性毛细血管增生症、贫血、发热、乏力、甲状腺功能减退和食欲降低等不良反应发生情况。不良反应根据世界卫生组织NCI-CTC 3.0版《抗癌药物急性与亚急性毒性反应判定标准》进行分级(0度为无不良反应,Ⅰ度为轻度,Ⅱ度为中度,Ⅲ度为重度,Ⅳ度为极重度)[9],记录Ⅲ度及以上不良反应发生情况。(3)由随访人员采用电话随访形式定期对患者进行随访(术后第1—6个月,每1个月随访1次;第7—12个月,每3个月随访1次;第2年,每6个月随访1次),随访截至2021年1月30日。结合患者门诊复查情况,统计术后生存情况,包括无进展生存期和总生存期。无进展生存期定义为自病理确诊至复发转移或全因死亡时间;总生存期定义为自病理确诊到全因死亡时间。
1.5 统计学方法

2 结果
2.1 基线资料
100例患者中有12例因不能耐受或其他原因终止治疗,最后88例进入结果分析。两组患者的基线资料相似,具有可比性,见表1。
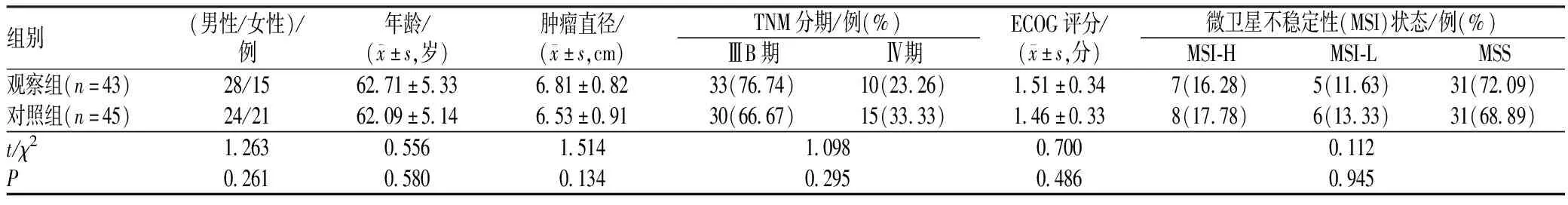
表1 两组患者基线资料比较
2.2 两组患者临床疗效比较
两组均无CR患者,观察组患者的DCR明显高于对照组,差异有统计学意义(P<0.05),见表2。

表2 两组患者临床疗效比较
2.3 两组不同MSI状态患者疗效比较
观察组MSI-H + MSI-L患者的ORR高于MSS患者,差异有统计学意义(P<0.05),DCR与MSS患者的差异无统计学意义(P>0.05);对照组不同MSI状态患者的ORR、DCR比较,差异均无统计学意义(P>0.05),见表3。
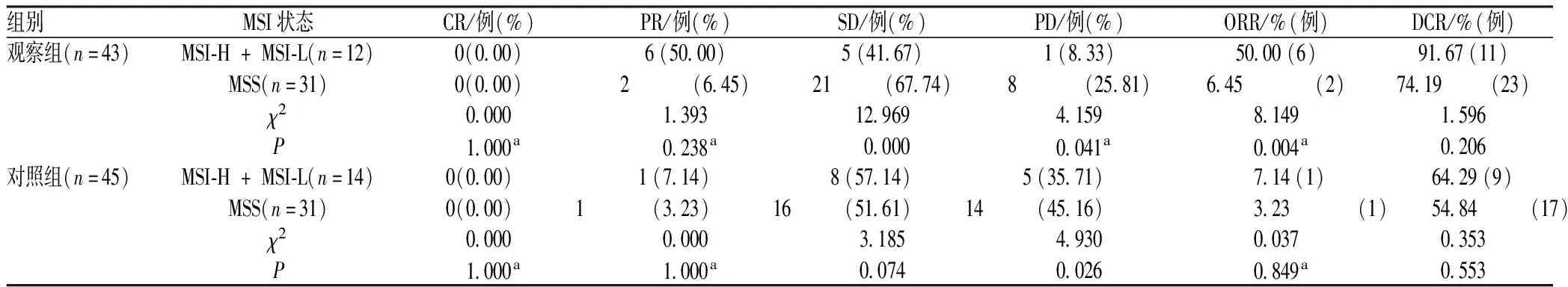
表3 不同MSI状态患者疗效比较
2.4 两组患者治疗前后血清VEGF水平、外周血CD4+ T细胞PD-1表达和CD8+ T细胞PD-1表达比较
两组患者治疗后血清VEGF水平、外周血CD4+T细胞PD-1表达和CD8+T细胞PD-1表达较治疗前明显降低,组间比较,观察组患者明显低于对照组,差异均有统计学意义(P<0.05),见表4。
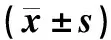
表4 两组患者治疗前后血清VEGF水平、外周血CD4+ T细胞PD-1表达和CD8+ T细胞PD-1表达比较
2.5 两组不同MSI状态患者治疗前后血清VEGF水平、外周血CD4+ T细胞PD-1表达和CD8+ T细胞PD-1表达比较
观察组MSI-H +MSI-L患者治疗后外周血CD4+T细胞PD-1、CD8+T细胞PD-1表达明显低于MSS患者,差异均有统计学意义(P<0.05),血清VEGF水平与MSS患者比较差异无统计学意义(P>0.05)。对照组不同MSI状态患者血清VEGF水平、外周血CD4+T细胞PD-1和CD8+T细胞PD-1表达在治疗前和治疗后的差异均无统计学意义(P>0.05),见表5。

表5 两组不同MSI状态患者治疗前后血清VEGF水平、外周血CD4+ T细胞PD-1表达和CD8+ T细胞PD-1表达比较
2.6 两组患者不良反应发生情况比较
两组患者Ⅲ度及以上不良反应发生率的差异无统计学意义(P>0.05),见表6。

表6 两组患者不良反应(Ⅲ度及以上)发生情况比较[例(%)]
2.7 随访
中位随访16(12~20)个月,88例患者随访期间失访9例,其中观察组失访5例,对照组失访4例。观察组患者中位无进展生存期、中位总生存期明显长于对照组,差异均有统计学意义(z=14.277、3.384,P=0.000、0.001)。观察组MSI-H + MSI-L患者的中位无进展生存期、中位总生存期明显长于MSS患者,差异均有统计学意义(P<0.05);对照组患者不同MSI状态患者的中位无进展生存期、中位总生存期比较,差异无统计学意义(P>0.05),见表7。

表7 不同MSI状态患者生存时间比较[M(Q1,Q3),月]
3 讨论
晚期胃癌一线治疗失败后复发、疾病进展的发生率高,患者生存率低,对于体力状况较好的患者,临床多主张继续采取以伊立替康、紫杉类为主的二线治疗,但是二线治疗个体差异较大,部分患者二线治疗后生存期并无明显延长[10]。目前对于晚期胃癌三线治疗尚无统一的标准,亦缺乏大数据支持,因此,晚期胃癌二线治疗失败后的后线治疗一直是临床研究的热点。近年来,多靶点抑制剂逐渐崭露头角,其中抗血管生成抗体在晚期胃癌治疗中表现出突出的效果,一项Ⅲ期试验结果表明,与安慰剂相比,多靶点小分子酪氨酸激酶抑制剂将难治性转移性胃癌患者的中位总生存期延长了55 d,将无进展生存期延长了25 d[11];另一项研究结果也显示,小分子酪氨酸激酶抑制剂可明显提高胃癌对紫杉醇+5-氟尿嘧啶的敏感性[12]。免疫逃逸是恶性肿瘤发生发展的重要机制之一,PD-1是适应性和先天免疫应答的抑制剂,可调控T细胞活性,诱导T细胞功能衰竭,降低对肿瘤的杀伤能力[13-14]。抑制PD-1可增强T细胞应答,介导抗肿瘤活性[15]。PD-1抑制剂也展现出对多种晚期实体恶性肿瘤的显著抗肿瘤作用[16]。
安罗替尼的吲哚基团可高效抑制血管内皮生长因子受体2表达和肿瘤血管新生,还可抑制血管内皮生长因子受体3表达,抑制淋巴管生成和肿瘤转移[17-18]。安罗替尼二线治疗耐药晚期肺腺癌的ORR、DCR分别达41.67%、88.89%[19];安罗替尼三线治疗晚期非小细胞肺癌的ORR为7.4%,DCR为66.7%[20]。PD-1抑制剂是目前比较热门的肿瘤免疫靶向治疗药物,截至2021年9月在我国上市的有纳武利尤单抗、帕博利珠单抗、特瑞普利单抗、信迪利单抗和卡瑞利珠单抗等8种PD-1抑制剂,纳武利尤单抗是首个在我国获批的治疗胃癌的PD-1抑制剂,其大大改变了我国胃癌后线治疗缺药的弊端,被多数研究结果证实可延长晚期胃癌患者的生存时间,但是其价格昂贵,限制了其在临床的应用[21]。卡瑞利珠单抗是我国自主研发的PD-1抑制剂,自2019 年5月上市以来,临床已开展卡瑞利珠单抗治疗多种肿瘤的临床试验研究,结果显示,卡瑞利珠单抗二线治疗晚期或转移性食管鳞状细胞癌的中位总生存期为8.3个月,长于常规化疗(多西他赛、伊立替康)的6.2个月[6]。与纳武利尤单抗、派姆单抗比较,卡瑞利珠单抗二线或后线治疗复发/转移性鼻咽癌的毒性最低[22]。有学者针对晚期肿瘤的三线治疗提出采用抗血管生成靶向抑制剂和PD-1抑制剂联合应用方案[23-24]。鉴于此,本研究尝试采用安罗替尼联合卡瑞利珠单抗三线治疗晚期胃癌,结果显示,观察组患者的DCR率79.07%,高于对照组;观察组患者治疗后血清VEGF水平、外周血CD4+T细胞PD-1表达、CD8+T细胞PD-1表达均明显降低,且低于对照组,中位无进展生存期、总生存期长于对照组。Mei等[23]对一线或二线治疗失败的晚期原发性肝癌患者采用卡雷珠单抗(3 mg/kg,每2周1次)+阿帕替尼(125、250、375或500 mg,1日1次)治疗,ORR可达10.7%,中位无进展生存期和总生存期分别为3.7和13.2个月。林建光等[24]采用安罗替尼联合卡瑞利珠单抗治疗1例常规化疗后进展的ⅣB期鼻咽癌患者,治疗后获得SD。以上结果说明,酪氨酸激酶抑制剂与PD-1抑制剂联合应用可提高抗肿瘤效果,发挥协同作用机制,但是具体机制尚不清楚,推测可能的原因为酪氨酸激酶抑制剂具有抗血管生成作用,可有效抑制肿瘤新生血管网形成,降低其侵袭和迁移能力;PD-1抑制剂可提高机体免疫和抗肿瘤能力,增强对肿瘤细胞的杀伤力,2种药物双管齐下,共同提高抗肿瘤效果。
MSI是由于肿瘤细胞微卫星区域重复序列插入或缺失导致的微卫星长度变化,MSI的发生与胃癌病理分期、免疫检查点抑制剂治疗效果以及预后均有关[25]。本研究结果显示,观察组不同MSI状态患者的治疗效果不同,表现为MSI-H + MSI-L患者的ORR高于MSS患者,治疗后外周血CD4+T细胞PD-1表达、CD8+T细胞PD-1表达低于MSS患者,说明MSI-H + MSI-L胃癌患者可能对安罗替尼联合卡瑞利珠单抗治疗更为敏感。Chang等[26]报道,MSI-H 会导致肿瘤细胞中体细胞突变的积累,高肿瘤突变负荷,新抗原表达增加和大量肿瘤浸润淋巴细胞,增加对免疫检查点抑制剂的敏感性。说明MSI-H + MSI-L胃癌患者可能在PD-1抑制剂治疗中获益,对于接受PD-1抑制剂治疗的晚期胃癌患者应考虑检查MSI状态。研究结果表明,在可手术根治的胃癌患者中,与MSS患者比较,MSI-H + MSI-L患者5年无瘤生存率和总生存率均明显升高[27];在不可手术切除的晚期胃癌患者中,MSI-H患者中位总生存期长于非MSI-H患者[28]。本研究中,观察组MSI-H + MSI-L患者中位无进展生存期、中位总生存期长于MSS患者,表明安罗替尼联合卡瑞利珠单抗治疗可延长MSI-H和MSI-L晚期胃癌患者的生存时间。
本研究中,观察组患者Ⅲ度及以上不良反应发生率与对照组相近,说明在安罗替尼基础上加用卡瑞利珠单抗治疗的毒性可控,安全性较好。皮肤毛细血管增生症是卡瑞利珠单抗特有的皮肤毛细血管内皮细胞的免疫反应[29]。本研究中,观察组患者发生2例Ⅲ度及以上的反应性毛细血管增生症,但与对照组的差异无统计学意义(P>0.05),原因可能为卡瑞利珠单抗与抗血管生成靶向抑制剂联合应用可降低皮肤毛细血管增生症发生率[30]。由此可见,卡瑞利珠单抗联合安罗替尼三线治疗不仅可提高疾病控制率,延长中位生存时间,还能减轻不良反应,治疗晚期胃癌具有较高的可行性。
综上所述,卡瑞利珠单抗联合安罗替尼三线治疗晚期胃癌更有助于控制恶性肿瘤进展,延长患者生存时间,尤其是对于MSI-H + MSI-L晚期胃癌患者,且不良反应在可控范围内。卡瑞利珠单抗和安罗替尼均为国产抗肿瘤药,相对经济实惠,适合在临床推广。由于本研究样本量较少,随访时间较短,卡瑞利珠单抗联合安罗替尼用于晚期胃癌的疗效尚待进一步研究证实。

