PARP1单核苷酸多态性与转移性食管鳞癌顺铂化疗敏感性及预后关系*
赵 万,仇俊兰,许丽华,张 怀,张 允,余玲玲,奉 林
(南京医科大学附属苏州科技城医院肿瘤科,江苏苏州 215153)
食管癌是第六大常见肿瘤,我国食管癌每年新发病例约占全球的一半[1]。最常见的病理类型是食管鳞癌(esophageal squamous cell carcinoma,ESCC),约占总数的90%。食管癌患者在诊断时多数已处于中晚期,无手术根治机会,化疗仍是最重要的治疗手段。然而,约半数以上食管癌患者对化疗并不敏感,化疗耐药已成为晚期食管癌治疗的瓶颈。
聚腺苷二磷酸核糖聚合酶1[Poly(ADP-ribose)polymerase 1,PARP1]是一种核蛋白,参与多种细胞功能,包括基因转录调控、染色质重塑及DNA损伤修复[2]。研究发现,在卵巢癌耐药细胞中PARP1呈高表达,通过下调PARP1水平,可恢复癌细胞对顺铂(cisplatin,DDP)的敏感性[3]。此外, PARP1是食管癌细胞中miR-223的直接靶基因,PARP1表达减少的细胞显示对化疗更加敏感[4]。PARP1表达水平还被证实是卵巢癌[5]和食管癌[6]患者的临床预后指标。
PARP1单核苷酸多态性能改变PARP1的转录和表达[7],进而影响食管癌[8]的发病风险。但是,目前其与肿瘤化疗疗效的关系仍不清楚。因此,本研究旨在评价PARP1基因rs907187C/G、rs8679T/C和rs1136410T/C单核苷酸多态性对接受DDP为基础化疗的转移性ESCC患者的化疗反应及总生存期(overall survival,OS)的影响。
1 资料与方法
1.1 一般资料
选取2016年7月至2020年1月本院收治的175例转移性ESCC患者,其中男97例,女78例,年龄27~79岁,中位年龄58岁,均为汉族。本研究经医院伦理委员会审批(2016KJCYY017),受试者均自愿参加研究并签署知情同意书。纳入标准:(1)经组织病理学确诊为ESCC;(2)伴有远处脏器或组织转移,无法手术根治切除;(3)至少有1个可经CT扫描测量评价的肿瘤病灶;(4)化疗前心电图、血常规、生化电解质均正常;(5)Karnofsky评分≥70分;(6)预计患者生存期超过3个月。排除标准:(1)年龄<18岁;(2)哺乳期或妊娠期妇女;(3)精神病史或存在认知障碍;(4)属于化疗禁忌证;(5)对研究药物过敏;(6)既往接受过任何形式的抗肿瘤治疗。
1.2 方法
1.2.1化疗方案及疗效评价
所有受试者均接受DDP联合卡培他滨(capecitabine,CAPE)化疗:DDP(齐鲁制药有限公司)75 mg/m2,加入生理盐水500 mL静脉滴注,第1天;CAPE (罗氏制药有限公司)1 000 mg/m2,第1~14天口服,停药7 d,21 d为1个周期。2个周期治疗后行CT扫描测量肿瘤大小变化,依据RECIST1.1实体瘤评价标准,近期疗效分为稳定(SD)、进展(PD)、部分缓解(PR)和完全缓解(CR)。PR、CR属于化疗敏感,而SD、PD对化疗不敏感。所有受试者至少完成2个周期的化疗,在治疗过程的任何时间出现PD,则停止当前方案化疗,更改为二线治疗方案或予最佳支持治疗。
1.2.2随访
本研究使用电话、电子邮件、查阅电子病历系统等方式随访,截止时间为2020年12月30日。本组患者随访3~32个月,Reverse Kaplan-Meier法计算中位随访时间为30.3个月(95%CI:26.56~34.04)。其中19例受试者失访,失访患者的生存时间按截尾数据处理。OS:从首次化疗开始至因任何原因引起死亡的时间(失访患者为最后一次随访时间)。
1.2.3DNA提取和基因型分析
首次化疗前抽取静脉血5 mL,外周血DNA提取采用DNA快速抽提纯化试剂盒(北京天根生化科技有限公司),DNA样本置于-20 ℃冰箱保存。使用TaqMan探针法对基因型进行鉴别,PCR引物及探针由上海索宝生物科技有限公司制备,PCR反应预混液(TaqMan Real-Time PCR Master Mixes)由赛默飞世尔科技公司制备,PCR在美国ABI 7900HT实时荧光定量PCR仪上进行。PCR体系:DNA样本1.0 μL,3.0 μL Mix、上下游引物各0.5 μL、TaqMan探针各0.5 μL、双蒸水4.0 μL。PCR循环参数:95 ℃预变性3 min,95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,共38个循环,72 ℃延伸8 min。捕获荧光信号后,经SDS软件分析得出基因型结果。rs907187:上游引物5′-TCGAATGTGCACTCAGTGATC-3′,下游引物5′-AGTATATGACGCATCGTCTGT-3′,探针:FAM-TACAGTGCTCACGCCATGGACA-MGB,HEX-TACT GCTCTACTAGCTTCGAT-MGB;rs8679:上游引物5′-AGTTAGCTGTCTAATGTGTC-3′,下游引物5′-CTA GTGGAGACTACGACGTC-3′,探针:FAM-TCACGCATCTAGCTAAGTATC-MGB,HEX-TACATCGGCT GATGATCTACAT-MGB;rs1136410:上游引物5′-ATGAGTCGCTTCGACTAGTGTCT-3′,下游引物5′-ATCCTACTCATGCTAACGTACA-3′,探针:FAM-CATGCTACTACATAGATGCTC-MGB,HEX-ATACT GAGTAGCAGTGTTACT-MGB。
1.3 统计学处理
采用SPSS23.0统计软件进行分析。拟合优度卡方检验Hardy-Weinberg平衡。卡方检验分析临床特征与化疗反应的关系;logistic回归分析基因型对化疗反应的影响,计算OR及95%CI,并经性别、年龄、分化等因素调整;Kaplan-Meier法绘制生存曲线;基因型与OS的关系分别用Log-rank检验和Cox回归模型进行单因素和多因素分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 临床特征对化疗反应的影响
175例转移性ESCC患者2例(1.1%)CR,66例(37.7%)PR,51例(29.1%)SD,56例(32.0%)PD,总化疗有效率(CR+PR)为38.8%。患者年龄、性别、饮酒史、吸烟史、肿瘤分化程度、食管癌原发部位与化疗反应无关联(P>0.05),见表1。
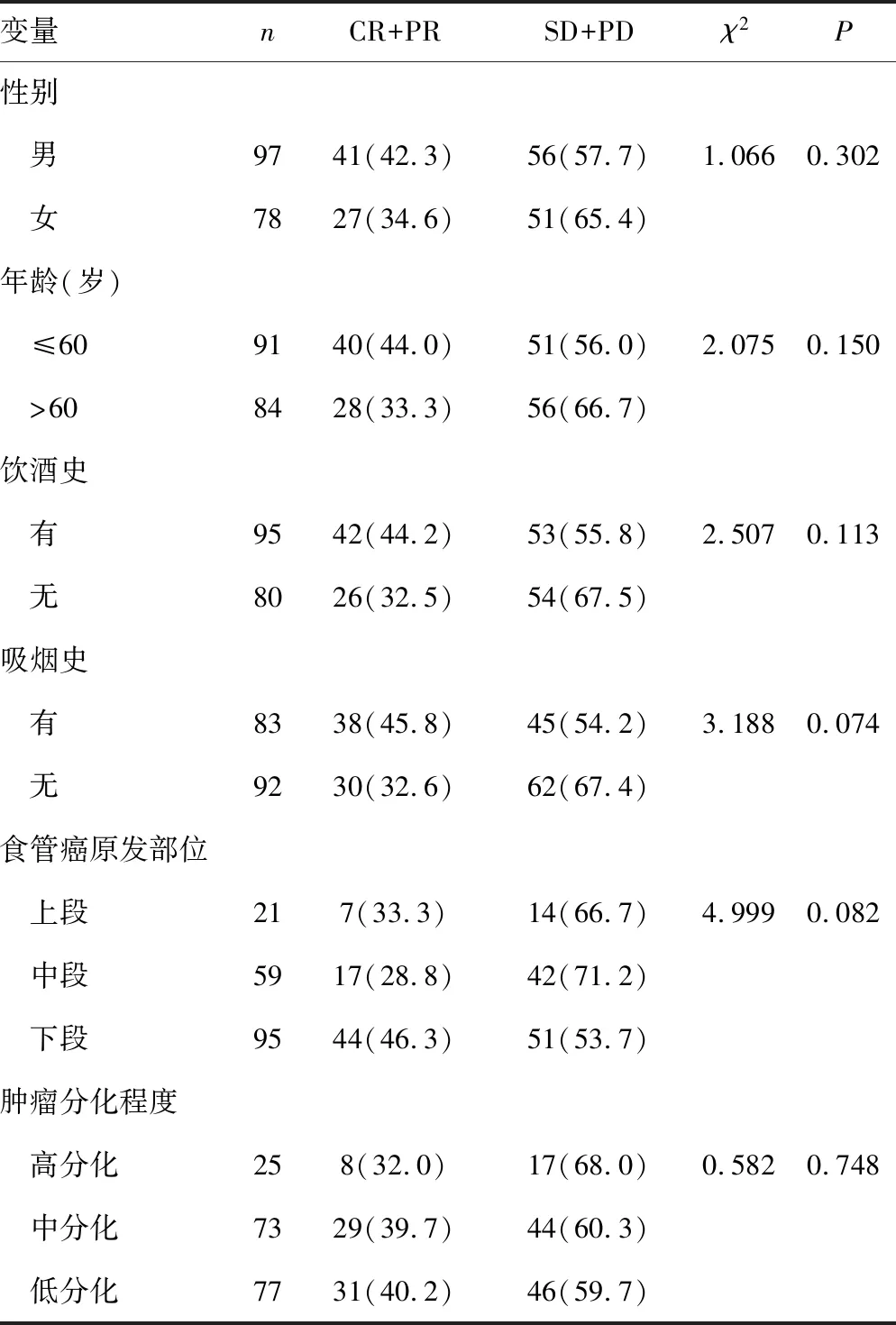
表1 175例ESCC患者临床特征与化疗反应的关系[n(%)]
2.2 单核苷酸多态性位点基因型分布
3个单核苷酸多态性位点在175例受试者中均能被明确基因分型。rs907187C/G单核苷酸多态性位点的CC、CG、GG基因型分别为53例(30.3%)、81例(46.3%)和41例(23.4%),rs8679T/C单核苷酸多态性位点的TT、TC、CC基因型分别为51例(29.1%)、77例(44.0%)和47例(26.8%),rs1136410T/C单核苷酸多态性位点的TT、TC、CC基因型分别为57例(32.6%)、79例(45.1%)和39例(22.3%)。以上3个单核苷酸多态性位点基因型分布符合群体遗传学Hardy-Weinberg平衡(P>0.05)。
2.3 单核苷酸多态性位点基因型与化疗敏感性的关系
rs8679T/C、rs1136410T/C单核苷酸多态性与化疗反应无关(P>0.05)。rs907187C/G单核苷酸多态性与化疗反应明显相关,CC、CG、GG基因型化疗有效率分别为12/53(22.6%)、33/81(40.7%)和23/41(56.1%),差异有统计学意义(χ2=11.116,P=0.004)。CG杂合基因型化疗反应率为CC基因型的2.337倍(95%CI:1.068~5.113,χ2=4.516,P=0.034);GG纯合突变基因型化疗反应率为CC基因型的4.326倍 (95%CI:1.771~10.565,χ2=10.334,P=0.001);CG+GG基因型化疗反应率为CC基因型的2.881倍(95%CI:1.379~6.019,χ2=7.927,P=0.005)。此外, GG基因型化疗反应率明显高于CG+CC基因型(OR=2.514,95%CI:1.229~5.142,χ2=6.375,P=0.012),见表2。
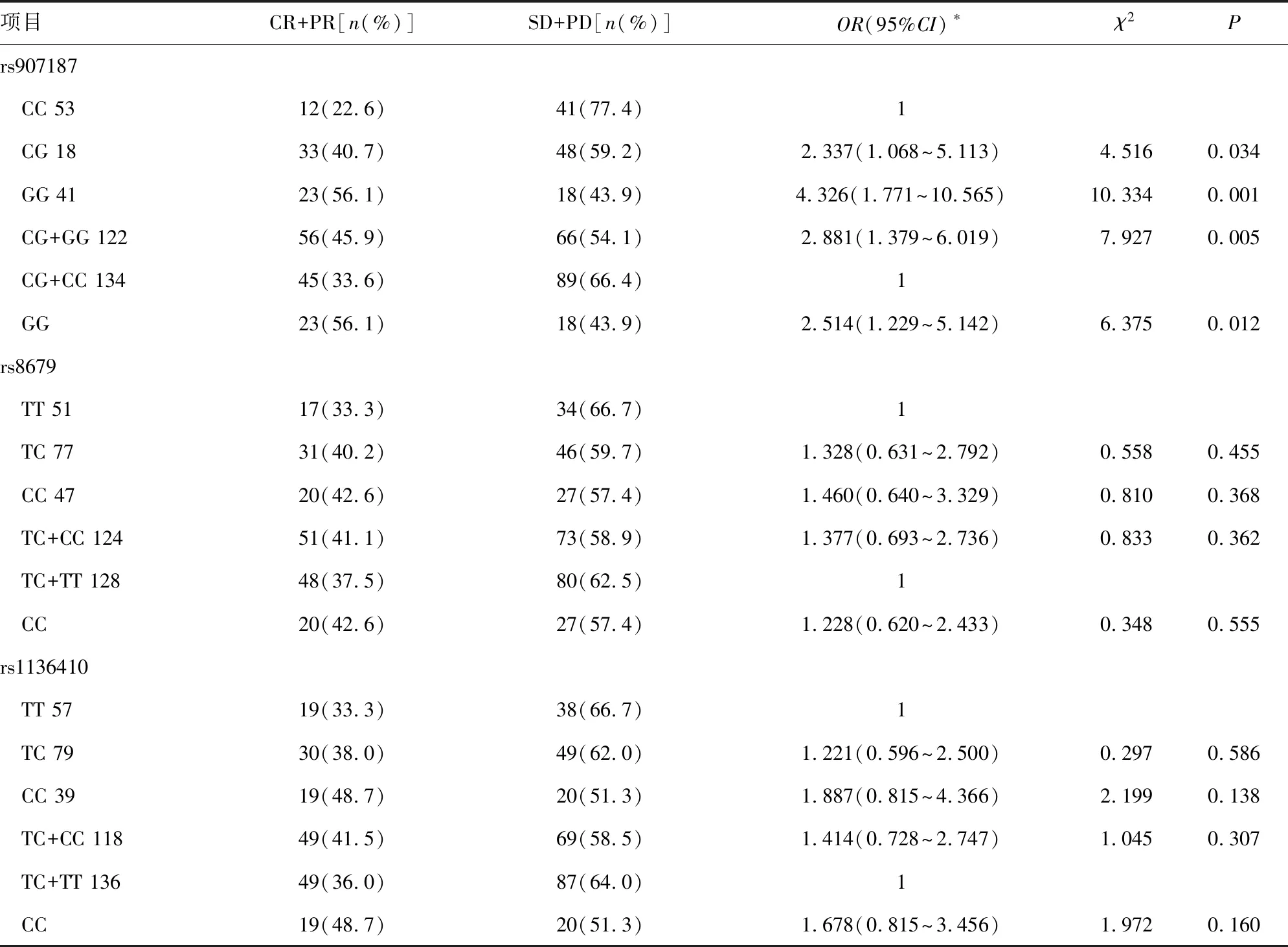
表2 rs907187C/G、rs8679T/C和rs1136410T/C单核苷酸多态性位点基因型分布及与化疗反应的关系
2.4 单核苷酸多态性位点基因型与患者OS的关系
175例受试者总体中位OS为12.5个月(95%CI:10.912~14.088)。rs8679T/C单核苷酸多态性位点的TT、TC、CC基因型患者中位OS分别为11.6、12.0、14.2个月(χ2=0.955,P=0.620); rs907187C/G单核苷酸多态性位点的CC、CG、GG基因型患者中位OS分别为10.7、12.8、13.9个月(χ2=0.420,P=0.811)。
rs1136410T/C单核苷酸多态性与患者OS显著相关,随着等位基因C数目的增加,患者中位OS逐步延长,TT、TC、CC基因型分别为9.3、13.2、15.6个月(χ2=11.846,P=0.003);TC+CC基因型携带者中位OS为13.9个月,较TT明显延长(χ2=7.787,P=0.005),见图1。

图1 PARP1基因rs1136410多态性位点不同基因型ESCC患者OS曲线对比
使用Cox模型进行多因素分析(纳入年龄、吸烟史、饮酒史、分化程度、肿瘤部位及单核苷酸多态性),结果显示rs1136410T/C单核苷酸多态性仍是影响ESCC患者OS的独立预后因素(OR=1.717,95%CI:1.208~2.440,χ2=9.088,P=0.003)。
3 讨 论
DDP是治疗晚期ESCC最常用的化疗药物之一,常与紫杉烷或氟尿嘧啶类药物组成联合方案。然而,晚期ESCC对化疗反应存在明显异质性,半数以上患者对化疗耐药,导致预后不良。DDP进入细胞后作用靶点是DNA,可形成铂-DNA加合物,导致DNA链交叉连接,阻断DNA复制和转录、促进凋亡[9]。此外,研究已证实DNA修复能力增强是DDP耐药的主要原因[10]。PARP1是众所周知的DNA修复蛋白,在碱基切除修复通路中发挥重要作用[2]。研究显示,PARP1表达减少使食管癌细胞对化疗的敏感性增强[4]。同时,PARP1表达变化还能影响食管癌患者的生存预后[6]。所以,笔者猜测PARP1基因单核苷酸多态性可能与转移性ESCC患者DDP化疗反应及OS相关。
rs907187C/G单核苷酸多态性位于PARP1基因启动子区,含有E2F1转录因子的结合位点。荧光素酶报告显示,rs907187多态性位点的G等位基因与E2F1结合亲和力低,导致启动子活性下降,并降低神经母细胞瘤细胞株PARP1-mRNA的表达水平 (P=0.003);基因型组织表达分析也发现G等位基因与较低的PARP1蛋白表达相关(P<0.001)[7]。研究显示,在伊朗人群中,rs907187多态性位点的CC及GG基因型携带者发生乳腺癌的风险显著增高[11]。此前,AVITABLIE等[7]对意大利神经母细胞瘤患者进行研究,发现rs907187多态性位点的G变异等位基因携带者拥有更好的化疗反应(P=0.02)。本研究也发现了类似的结果,随着rs907187多态性位点的G等位基因数目的增加,ESCC患者化疗有效率逐步升高(CC 22.6%、CG 40.7%、GG 56.1%,P=0.004);CG+GG基因型化疗反应率为CC基因型的2.881倍 (95%CI:1.379~6.019,P=0.005)。根据此前的基因功能学研究[7],笔者推测rs907187多态性位点变异等位基因G通过影响与E2F1转录因子的结合,下调PARP1的转录、表达水平,减弱了DNA修复能力,使得癌细胞无法修复DDP诱导的DNA损伤,这可能是G等位基因携带者对DDP化疗更加敏感的原因。当然,这种推断仍需更多的单核苷酸多态性功能学研究来证实。
rs8679T/C单核苷酸多态性位于PARP1基因3′-UTR,能影响microRNA与mRNA的结合,进而调控PARP1基因的表达,最终影响结直肠癌的发病风险[12]。然而,最近的研究并未发现该多态性与食管癌发病易感性存在明显关联[8]。此外,ZHAO等[13]对卵巢癌患者进行研究,也未发现rs8679T/C单核苷酸多态性与铂类化疗敏感性相关。同样,本研究也未发现rs8679T/C单核苷酸多态性与ESCC患者化疗反应及OS之间存在关联(P>0.05)。当前,rs8679T/C与肿瘤化疗疗效之间的研究较少,二者间的真实关系尚不清楚,需开展更多的研究深入探讨。
rs1136410T/C单核苷酸多态性属于非同义多态性,碱基T变异为C后导致编码的762位氨基酸残基由缬氨酸(Val)替换为丙氨酸(Ala) ,导致蛋白结构改变,进而影响PARP1蛋白酶的功能[8]。研究显示rs1136410T/C单核苷酸多态性与卵巢癌化疗反应相关, CC基因型患者对铂类化疗敏感,耐药风险显著下降(P=0.001)[13]。另外,在一项食管小细胞癌的研究中,发现rs1136410多态性位点变异基因型TC+CC携带者的中位OS较野生纯合基因型TT患者明显延长,分别为17.4个月和14.8个月(P=0.032)[14]。这与本研究结果一致,本研究首次发现rs1136410T/C单核苷酸多态性与转移性ESCC患者OS相关,变异等位基因C携带者中位OS明显延长(P=0.003);至少携带一个C等位基因的患者TC+CC中位OS为13.9个月,较TT明显延长(P=0.005)。然而,在接受DDP同步放化疗的宫颈癌患者中,rs1136410多态性位点变异等位基因C与围绝经期和绝经后妇女的OS缩短显著相关(P=0.008)[15]。这与本研究结论并不一致,考虑种族、性别组成、瘤种、肿瘤分期、治疗方案的不同导致研究结果存在差异。
综上所述,本研究发现PARP1单核苷酸多态性能影响转移性ESCC患者的化疗敏感性及生存预后,rs907187多态性位点G等位基因预示更好的化疗反应,而rs1136410多态性位点C等位基因与OS延长相关,本研究结果可能对预测转移性ESCC患者化疗反应及预后有一定的作用。

