FoxM1蛋白在宫颈癌的表达及临床意义的meta分析*
李丽红,沐 超,王 婷,袁 炜,姚运红,胡新荣△
(广东医科大学:1.医学技术学院;2.基础医学院,广东东莞 523808)
宫颈癌是常见的女性生殖道恶性肿瘤,亦是目前唯一明确病因的恶性肿瘤。如今,宫颈癌的发病率和病死率均居全球第四[1]。目前宫颈癌的确诊仍然依靠病理活检,缺乏早期诊断中灵敏度高的分子标志,因此寻找合适的用于早期发现和诊断宫颈癌的生物标志物是当今的研究热点。叉头框蛋白M1(forkhead box M1,FoxM1)隶属于叉头框转录因子家族。多项研究报道,FoxM1在人类的多种实体肿瘤中高表达,包括黑色素瘤、肝细胞癌、食管鳞状细胞癌等[2-4]。FENG等[5]研究发现,FoxM1的高表达与子宫内膜癌的预后、临床等级和病理分期密切相关,还可以促进癌细胞的增殖和迁移;并且与胃癌的增殖、侵袭和转移息息相关[6]。目前已有不少的研究报道FoxM1蛋白的表达与宫颈癌发生发展、不同临床特征的关系,但结论存在争议。陈光治等[7]研究发现,FoxM1蛋白的表达与浸润深度、分化程度及淋巴结转移有关。然而郭丽梅等[8]指出,FoxM1蛋白的表达与年龄、是否发生淋巴结转移无关。因此,考虑到现有研究结论的不一致性,且目前尚无关于FoxM1蛋白表达与宫颈癌相关关系的系统性评价,本文对所有符合纳入条件的研究采用meta分析的方法进行汇总、合并分析,以期明确FoxM1蛋白表达与宫颈癌的相关关系及其临床意义。
1 资料与方法
1.1 纳入与排除标准
1.1.1纳入标准
(1)研究类型:国内外公开发表的关于FoxM1蛋白在宫颈上皮内瘤变(CIN)和宫颈癌中表达差异及与宫颈癌不同临床病理特征关系的临床研究。文种限中、英文。(2)研究对象:所有病例均有完整的临床病理资料,都经病理诊断证实,全部病例取材前未经手术、放化疗等特殊治疗。所有对照均为因其他原因行子宫切除的正常宫颈组织。所有纳入人群均不受种族、国籍、年龄限制。(3)研究方法相似,且为随机对照研究。(4)FoxM1蛋白检测方法采用免疫组织化学法。(5)提供病例组和对照组的例数或阳性率。
1.1.2排除标准
(1)非随机对照的临床研究。(2)检测方法不是免疫组织化学法。(3)文摘、综述、讲座、述评。(4)相同作者重复发表的文献。(5)数据不完整或重复。
1.2 检索策略
计算机检索PubMed、CBM、Cochrane Library、万方、知网、维普等数据库,收集已公开发表的关于宫颈癌和FoxM1蛋白相关性的病例随机对照研究,时间为自建库起至2020年7月。检索策略运用自由词与主题词结合的方式,英文检索词为“Forkhead Box M1”or“FOXM1” or“FoxM1”and“cervical cancer”or“cervical intraepithelial neoplasia” or“CIN”。中文检索词为“叉头转录因子蛋白”“FoxM1”“宫颈癌”“宫颈上皮内瘤变”“CIN”。
1.3 文献的筛选与信息提取
由两名研究人员根据纳入和排除标准独立筛选文献、提取数据,如出现意见不一致,经过双方讨论协商或由第三方仲裁。提取内容主要包括:文题、作者、发表年限、纳入病例年龄范围、病例和对照的样本量、淋巴结转移、分化程度、肌层浸润等。
1.4 纳入文献质量评价
使用纽卡斯尔-渥太华量表(Newcastle-Ottawa scale,NOS)评估入选文献的质量。NOS评分项目包括纳入研究对象的情况、研究对象按照病例组与对照组分类的可比性、结果的可信度3个方面。评分为0~9分,NOS≥6分为高质量研究,即可纳入meta分析。
1.5 统计学处理
采用RevMan5.3软件进行meta分析,以OR及95%CI作为效应量表示结果,P<0.05为差异有统计学意义。用I2检验对提取的研究结果进行异质性检验(α=0.1)。当I2≤50%,说明各研究结果无明显异质性,使用固定效应模型进行分析;若I2>50%,说明各研究结果间存在异质性,应采用随机效应模型。
2 结 果
2.1 文献搜索结果
本次研究初步检索到223篇文献,根据文献入选标准,经筛选纳入19篇文献[7-25],共2 781例受试者,包括932例正常宫颈妇女,403例CIN患者,1 446例宫颈癌患者。筛选流程见图1。

图1 文献检索和筛选流程
2.2 纳入研究的基本特征及质量评价
19篇文献报道了正常宫颈、CIN和宫颈癌组织中FoxM1蛋白的表达情况,其中FoxM1蛋白的阳性判断依靠病理医师的多年经验,存在个人经验误差。纳入研究相关信息见表1。
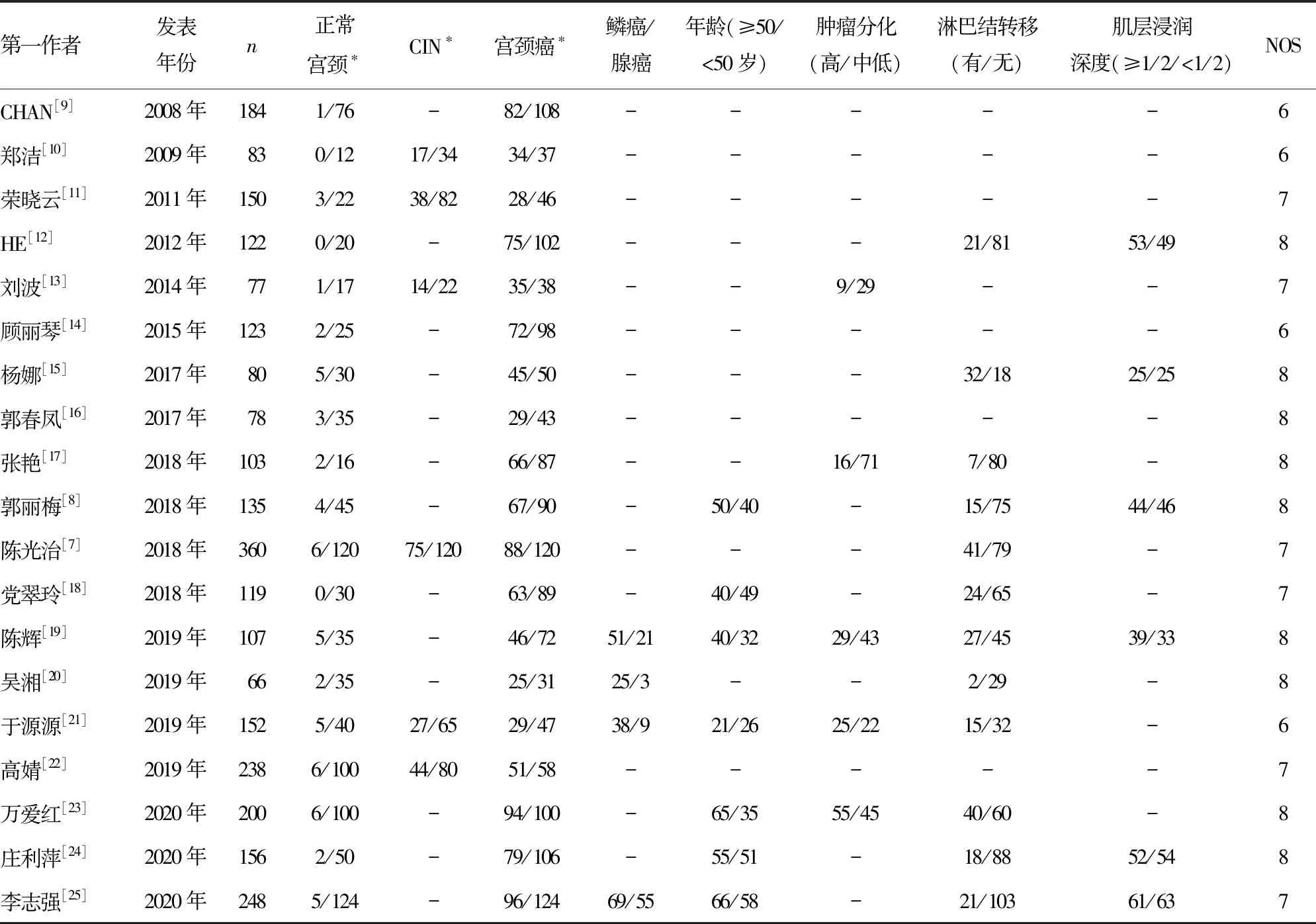
表1 纳入研究的基本特征分析
2.3 mate分析结果
2.3.1宫颈癌组与正常宫颈组
共有19篇文献报道了宫颈癌组与正常宫颈组的FoxM1蛋白表达情况,I2=55%,P=0.002,分析中使用随机效应模型。宫颈癌组的FoxM1蛋白表达高于正常宫颈组,差异有统计学意义(OR=47.50,95%CI:29.18~77.32,P<0.001)。
2.3.2宫颈癌组与CIN组
共有6篇文献报道了宫颈癌组与CIN组的FoxM1蛋白表达情况,I2=62%,P=0.020,各项研究结果间统计有中度异质性,分析中使用随机效应模型。宫颈癌组的FoxM1蛋白表达高于CIN组,差异有统计学意义(OR=3.17,95%CI:1.77~5.65,P<0.001)。
2.3.3CIN组与正常宫颈组
共有6篇文献报道了CIN组与正常宫颈组的FoxM1蛋白表达情况,I2=49%,P=0.080,分析中使用固定效应模型。CIN组的FoxM1蛋白表达高于正常宫颈组,差异有统计学意义(OR=14.65,95%CI:9.05~23.72,P<0.001)。
2.3.4年龄≥50岁组与年龄<50岁
共有7篇文献报道了宫颈癌中年龄≥50岁组与年龄<50岁组的FoxM1蛋白的表达情况,I2=0,P=0.920,两组间无异质性,分析中使用固定效应模型。两组间FoxM1蛋白表达差异无统计学意义(OR=0.76,95%CI:0.52~1.11,P=0.150)。
2.3.5伴淋巴结转移组与无淋巴结转移组
共有12篇文献报道了宫颈癌中伴淋巴转移组与无淋巴转移组的FoxM1蛋白表达情况,I2=44%,P=0.050,分析中使用固定效应模型。伴淋巴结转移组的FoxM1蛋白表达高于无淋巴结转移组,差异有统计学意义(OR=1.94,95%CI:1.33~2.84,P<0.001)。
2.3.6高分化组与中低分化组
共有5篇文献报道了FoxM1蛋白在不同分化程度宫颈癌中表达情况,I2=0,P=0.560,分析中使用固定效应模型。宫颈癌中低分化组的FoxM1蛋白表达高于高分化组,差异有统计学意义(OR=0.16,95%CI:0.09~0.30,P<0.001)。
2.3.7肌层浸润≥1/2组与肌层浸润<1/2组间
共有6篇文献报道了FoxM1蛋白在不同肌层浸润程度宫颈癌中表达情况,I2=0,P=0.64,分析中使用固定效应模型。肌层浸润≥1/2组的FoxM1蛋白表达高于肌层浸润<1/2组,差异有统计学意义(OR=3.65,95%CI:2.38~5.59,P<0.001)。
2.3.8鳞癌组与腺癌组
共有4篇文献报道了FoxM1蛋白在不同病理类型宫颈癌中的表达情况,I2=0,P=0.970,两组间无异质性,分析中使用固定效应模型。两组间FoxM1蛋白表达差异无统计学意义(OR=0.72,95%CI:0.40~1.32,P=0.290)。
2.4 敏感性分析与发表偏倚评估
逐一剔除单个研究后,对剩余的研究进行合并分析显示,每剔除1篇文献对合并效应量的影响均较小,表明本研究结果较稳健,分析结果可信度高;对宫颈癌组与正常宫颈组中FoxM1蛋白表达所纳入的19篇文献进行发表偏倚检验,结果显示:Begg检验结果P=0.184(图2),Egger线性回归结果P=0.224(图3),提示纳入文献不存在发表偏倚,漏斗图未见明显的不对称,漏斗图中大部分点都均匀地分布在可信区间内。
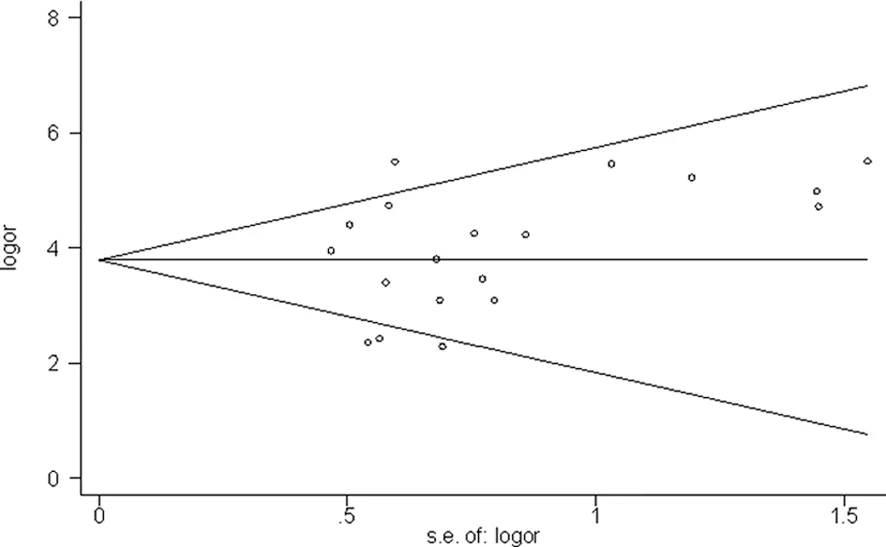
图2 Begg漏斗图

图3 Egger回归图
3 讨 论
宫颈癌是全球范围内最常见的妇科肿瘤,它的发生、发展是一个漫长的过程,常常历经数年至数十年,早诊断、早治疗能有效地减低宫颈癌的死亡,因此寻找有效的早期筛查和诊断宫颈癌的新靶点是十分重要且必要的。
Fox是一类存在于广泛生物中的转录因子,具有一段特定“翼状螺旋结构”DNA结合域,其在细胞周期调控,胚胎发育,免疫调节等方面发挥着重要作用[26-27]。FoxM1为Fox蛋白家族的一员,定位于人类染色体12p13,全长约25 kb,由10个外显子组成。FoxM1是一种细胞周期调控基因,参与调节与细胞周期相关的多个基因的转录,并且在细胞增殖、分化、凋亡中发挥着重要的生理作用[28-29]。同时,在多种肿瘤中它还涉及细胞的迁移、侵袭[30-32]。现已有相关文献报道,FoxM1在多种恶性肿瘤中异常高表达,且参与多个癌基因信号转导通路。ZHANG等[33]研究发现,Akt/FoxM1信号通路通过激活关键下游转录因子MYBL2促进人脑胶质瘤细胞增殖。LIN等[34]研究发现,FoxM1通过靶向AMPK/mTOR激活自噬途径而促进去势抵抗性前列腺癌(CRPC)的多西他赛耐药性。在MAPK信号通路中,FoxM1在G2/M调控中是Raf/MEK/MAPK信号传导的效应分子。Raf/MEK/MAPK途径的激活对于FoxM1的核易位非常必要,同时增强FoxM1对细胞周期蛋白cyclin B1的启动子激活活性,促进细胞的有丝分裂[35]。
本meta分析共纳入19篇病例对照研究,结果显示:FoxM1蛋白在宫颈癌组织中表达阳性率较高,在CIN中表达阳性率次之,而在正常宫颈组织中较少表达,提示FoxM1蛋白与宫颈癌的发生、发展有显著联系,FoxM1蛋白的高表达增高了罹患宫颈癌的风险。宫颈癌淋巴结转移是和多种因素相关的,而FoxM1蛋白的高表达可能是其中的一种危险因素。本研究发现伴淋巴结转移组的FoxM1蛋白表达明显高于无淋巴结转移组(OR=1.94,95%CI:1.33~2.84,P<0.001),提示FoxM1蛋白表达升高会促进宫颈癌的淋巴结转移。宫颈癌不同分化程度中,FoxM1蛋白的表达存在着分歧。万爱红等[23]发现在宫颈癌细胞分化较差的患者中,FoxM1蛋白的阳性表达率可进一步升高;而杨娜等[15]却认为FoxM1蛋白的表达与宫颈癌的分化程度无关。本研究则证明,FoxM1蛋白表达在宫颈癌低分化组中要高于高分化组,差异有统计学意义(OR=0.16,95%CI:0.09~0.30,P<0.001),表明FoxM1蛋白表达上升能够促进宫颈癌细胞分化成熟障碍。关于FoxM1蛋白表达与宫颈癌不同肌层浸润深度的关系,研究结果显示,宫颈癌肌层浸润≥1/2组的FoxM1蛋白表达是肌层浸润<1/2组的3.65倍,差异有统计学意义(95%CI:2.38~5.59,P<0.001)。此外本研究还发现, FoxM1蛋白的表达与宫颈癌患者的年龄(P=0.150)和宫颈癌的病理类型(P=0.290)无显著相关性。
本研究仍可能存在以下局限性:(1)纳入文献均为国内外公开发表的文献,不包含文摘、综述、讲座、述评和相关灰色文献,可能存在一定的发表偏倚。(2)纳入研究的样本量差异较大,部分结局指标纳入研究数量较少,缺乏一定的可信度,需要进一步的验证。(3)部分研究结果存在中度异质性,影响数据的可靠性。
综上所述,FoxM1蛋白在宫颈癌、CIN和正常宫颈组织中差异表达,且宫颈癌伴淋巴结转移、中低分化及肌层浸润≥1/2的患者FoxM1蛋白表达更高,而FoxM1蛋白的表达与宫颈癌患者的年龄和病理类型无显著相关性。由此可见,FoxM1蛋白可能参与宫颈癌的发生、发展,并影响其预后,可以作为一个临床上有效的基因治疗靶点。

