B细胞急性淋巴瘤9L蛋白在结肠癌中的表达和临床意义及其与预后的关系
陈丑彦 杨含腾 潘宏波
结肠癌的发生涉及多个基因与分子通路,寻找有效的靶点评估临床治疗效果及患者预后可成为治疗结肠癌新的突破点[1-2]。 B 细胞急性淋巴瘤9L(B-cell CLL/lymphoma 9-like,BCL9L)是近年来发现的Wnt/β-catenin信号通路上的癌基因[3]。目前,关于BCL9L蛋白对肿瘤影响的研究较少,且有争议。López-García等[4-5]认为,BCL9L蛋白在正常的细胞中帮助激活一种凋亡相关蛋白胱天蛋白酶-2(caspase-2)以应对异常数量的染色体,引发细胞凋亡程序;而当BCL9L蛋白异常低表达时,染色体异常的结肠癌细胞可发生继续生长与进化的情况。而Sannino等[6]认为BCL9L蛋白高表达与胰腺癌的严重程度密切相关,敲除BCL9L基因后,移植瘤小鼠模型中癌细胞肝转移的数量显著减少。Hallas等[7]对恶性胰腺肿瘤的研究得到了与之相似的结果。因此,本研究通过免疫组织化学(简称免疫组化)分析、实时荧光定量(qRT)-PCR检测、蛋白质印迹法(Western blot)等方法,同时随访并对临床病理资料进行分析,探讨BCL9L蛋白表达水平与结肠癌患者预后的关系。
1 对象与方法
1.1 研究对象 选取2012年1月—2014年1月定西市人民医院收治的68例行结肠癌手术患者的临床病理资料,其中男、女各34例;年龄范围30~76岁。68例患者术前均未行放射或化学治疗,结肠癌与癌旁正常组织(于距肿瘤外缘>2 cm处取材)标本均为术后立刻取材,液氮冷冻保存。本研究通过医院伦理委员会审核并批准(审批号为2021-001)。所有患者及家属均签署知情同意书。
1.2 纳入和排除标准[8]纳入标准:①符合结肠癌临床诊断标准;②预计生存周期>6个月。排除标准:①中途脱落或退出研究;②患有精神疾病或沟通障碍。
1.3 随访方法和内容 采用电话和门诊方式进行随访,记录患者病例数、随访时间、性别、年龄、肿瘤复发情况、肿瘤转移和生存情况,随访时间截至2019年1月。
1.4 术后预后因素分析 分析BCL9L蛋白高表达组和低表达组患者年龄、性别、肿瘤大小、肿瘤数目、淋巴结转移、临床分期、切缘肿瘤细胞阳性的差异,以及BCL9L蛋白与结肠癌术后复发、转移的相关性。
1.5 RNA和总蛋白提取 取新鲜结肠癌组织,液氮研磨后加TRIzol试剂,按常规方法提取组织RNA或总蛋白,并测定RNA和蛋白质浓度。
1.6 qRT-PCR检测
1.6.1 反转录 按照反转录试剂盒说明书进行操作,反应总体系为10 μL。其中RNA 1 μL,MMLV反转录酶0.25 μL,5×反转录缓冲液2 μL,dNTPs 2 μL,Random 6 Mers 0.5 μL,RNA酶抑制剂0.25 μL,DEPC水4 μL。反应条件:42 ℃ 10 min, 95 ℃ 2 min。
1.6.2 PCR反应体系 cDNA模板1 μL,TaqHS酶0.25 μL, 10×PCR缓冲液2.5 μL, dNTPs 0.5 μL,上游引物、下游引物各0.5 μL,ddH2O 19.75 μL,总体积25 μL。GAPDH作为内参。正向引物 5’-TTT GGT ATC GTG GAA GGA CTC-3’;反向引物 5’-GAA CAT CAT CCC TGC CTC TAC-3’;探针 5’-CAT GCC ATC ACT GCC-3’。反应条件: 94 ℃ 5 min,98 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,共38个循环,最后72 ℃ 10 min延伸。BCL9L正向引物5’-CAC AAT GCC ATC AAG ACC ATC-3’ ;反向引物5’-AGT TCA GGT GCA TCT GGC TGT CAG ACG ACG AGC TGC-3’;探针 5’-TCA GAC GAC GAG CT GC-3’。反应条件:94 ℃ 5 min, 98 ℃ 10 s, 55 ℃ 15 s, 72 ℃ 3 min, 共38个循环, 最后72 ℃ 10 min延伸。
1.7 蛋白质印迹法 取30 μg组织蛋白,用含9%十二烷基硫酸钠的聚丙烯凝胶电泳(9%SDS-PAGE)进行电泳分离,将凝胶中的蛋白质用湿转法转印至0.45 μm的聚偏二氟乙烯(PVDF)膜上。转膜结束后,将膜置于5%脱脂奶粉中封闭1 h,然后加入鼠抗人的BCL9L多克隆抗体(美国Abcam公司),置于4 ℃冰箱孵育过夜。用1×TBST洗膜15 min 3次后,加入辣根过氧化物酶标记的二抗,于室温孵育45 min,再用1×TBST将未结合的抗体洗脱,加入电化学发光(ECL)法发光液显色后,将膜置于暗盒内曝光于X胶片上,胶片常规显影、定影。以β-actin为内参。
1.8 免疫组化检测BCL9L蛋白质表达 将待测组织置入4 ℃ 4%多聚甲醛中充分固定,再置入4 ℃ 30%蔗糖脱水过夜,然后将组织包埋成石蜡块,切片、爬片、脱蜡后采用链霉素抗生物素蛋白-过氧化物酶连结法(S-P法)进行免疫组化实验,具体步骤依照试剂盒说明书。主要抗体来源、剂量、结果判定标准如下。用PBS取代一抗作为阴性对照。SP-9002 小鼠S-P试剂盒和DAB显色试剂盒购于北京中杉金桥生物技术有限公司。评分标准[9]:根据染色组织的染色强度得到评分A( 0分为无色,1分为淡黄色,2分为黄褐色,3分为棕褐色);根据染色组织的染色密度得到评分B(0分为阳性比例<25%,1分为26%~50%,2分为51%~75%,3分为76%~100%);A×B结果为0~3分为低表达,4~9分为高表达。

2 结 果
2.1 BCL9L在结肠癌及癌旁组织中的表达 免疫组化S-P法检测发现,BCL9L蛋白主要在细胞质中表达,呈棕褐色。68例患者中42例结肠癌组织BCL9L蛋白为低表达,26例为高表达;癌组织中BCL9L蛋白表达评分显著低于癌旁组织[(1.89±0.67)分比(5.26±1.23)分,P<0.001]。见图1。蛋白质印迹法检测68例患者结肠癌及其癌旁组织BCL9L蛋白,qRT-PCR检测12例患者结肠癌及其癌旁组织BCL9LmRNA,发现癌组织中BCL9L蛋白和mRNA相对表达量(0.36±0.28和0.62±0.34)均显著低于癌旁组织(1.02±0.37和2.73±0.23,P值均<0.05)。见图2。

A BCL9L蛋白在癌旁组织中高表达 B BCL9L蛋白在结肠癌组织中低表达图1 BCL9L蛋白在结肠癌及癌旁组织中的表达情况(免疫组化S-P法,×200)

1 癌旁正常组织 2 结肠癌组织图2 蛋白质印迹法检测结肠癌和癌旁组织中BCL9L蛋白的表达
2.2 BCL9L蛋白表达与临床病理特征的关系 如表1所示, 不同BCL9L蛋白的表达水平的结肠癌患者的性别、年龄、肿瘤数目及肿瘤直径的差异均无统计学意义(P值均>0.05);而与BCL9L蛋白高表达患者相比,低表达患者的淋巴结转移、TNM分期为晚期,及切缘肿瘤细胞阳性的比例更高(P值均<0.05)。

表1 BCL9L蛋白表达与结肠癌临床病理特征的关系 (n,N=68)
2.3 随访和生存情况 对68例患者术后进行8~59个月的随访(中位随访时间为38个月),其中32例患者无复发,36例患者复发;复发患者中30例死亡。术后3年总体复发率与总体生存率分别为52.94%(36/68)、55.88%(38/68)。BCL9L蛋白低表达和高表达结肠癌患者术后3年总体生存率分别为38.10%和84.62%。见表2。

表2 结肠癌患者术后预后单因素分析 (N=68)
2.4 预后因素分析 单因素Cox回归分析结果显示,性别、肿瘤大小不是影响结肠癌术后3年总体生存率的关键因素(P值均>0.05)。年龄、肿瘤数目、淋巴结转移、临床分期、切缘肿瘤细胞阳性及BCL9L蛋白表达水平均是影响结肠癌术后3年总体生存率的关键因素(P值均<0.05)。见表2。
多因素Cox回归分析结果显示,淋巴结转移、临床分期Ⅲ或Ⅳ期、切缘肿瘤细胞阳性及BCL9L蛋白低表达均是影响结肠癌患者术后3年生存率的独立危险因素(P值均<0.05)。BCL9L蛋白低表达结肠癌患者术后3年死亡风险是BCL9L蛋白高表达结肠癌患者的6.26倍。见表3。
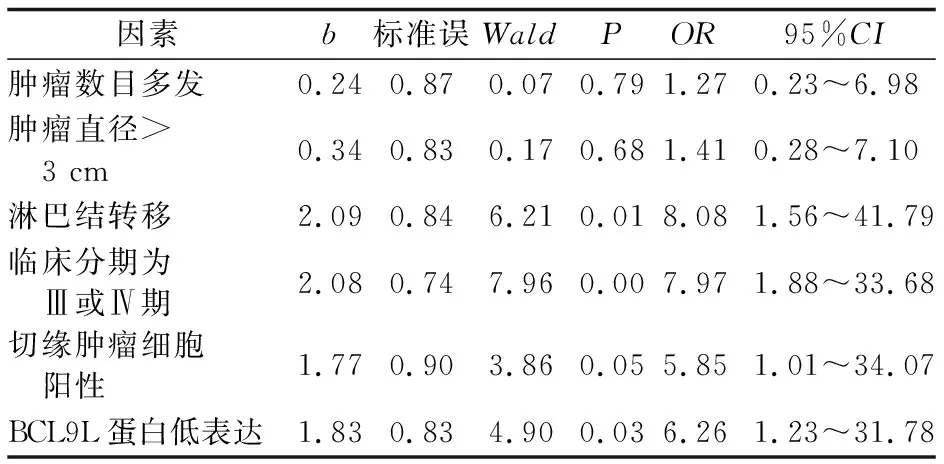
表3 结肠癌患者术后预后多因素分析
生存曲线显示,BCL9L蛋白高表达的结肠癌患者总体生存率显著高于低表达者(log rankP=0.005 8),见图3。

图3 BCL9L蛋白高表达和低表达结肠癌患者的总体生存率
2.5 BCL9L的蛋白质表达水平与结肠癌术后复发的相关性分析 Spearman相关性分析结果显示,BCL9L蛋白低表达与结肠癌术后肿瘤复发和死亡(r=0.862、0.640)显著相关(P值均<0.001)。
3 讨 论
结肠癌的发生率占所有癌症的9%以上[10],肝转移是结肠癌患者死亡的主要原因[11],因此寻求结肠癌有效靶点是治疗结肠癌新的突破点。目前,已发现的通过遗传变异导致癌症发生、发展的影响因子有:TGF-β通路失调[3]、长散布重复序列(LINEs)甲基化[9]、微RNA-454-3p异常表达[12]、Wnt信号通路分子突变和解除管制[13]等。越来越多的研究证明,Wnt/β连环蛋白(β-catenin)信号通路分子突变与多种癌症的发生、发展相关密切。如微RNA-30-5p通过靶向抑制Wnt/β-catenin信号通路调控结肠癌的发生、发展[14], 结肠癌细胞Wnt/β-catenin信号通路的激活与TGF7的突变有关[15],新西兰牡荆苷(Vicenin-2)通过抑制Wnt/β-catenin信号通路诱导结肠癌细胞的凋亡[16]等。此外,BCL9L蛋白的异常表达参与结直肠癌和胰腺癌的发生、发展[5,7],本研究对68例结肠癌患者的结肠癌与癌旁组织进行免疫组化分析,发现结肠癌组织中的BCL9L蛋白质的表达量显著低于癌旁组织,这与López-García等[4-5]的研究结果相一致,却与Sannino等[6]和Hallas等[7]的研究结果相反。这种差异可能与肿瘤的生长部位不同有关,也可能与肿瘤细胞的突变背景、肿瘤的不同发展阶段及患者的基因背景有关。与之相同的研究发现,TGF-β负反馈调控肾癌细胞的黏附与迁移[17],却正反馈调节非小细胞肺癌细胞的侵袭和迁移[18],这种正或负反馈调节作用导致了BCL9L基因在不同肿瘤组织中的异常表达。
结肠癌患者术后复发转移是患者死亡的主要原因[9],因此探索相关靶基因从而降低术后复发、转移和提高患者术后3年的总体生存率是亟待解决的问题。本研究对68例结肠癌患者进行跟踪随访,并对临床病理资料进行分析,发现3年总体复发率与生存率分别为52.94%、55.88%,且BCL9L蛋白低表达的患者复发率较高,提示BCL9L蛋白异常低表达常常预示肿瘤预后不良。本研究中单因素Cox回归分析结果显示,年龄、肿瘤数目、淋巴结转移、临床分期、切缘肿瘤细胞阳性及BCL9L蛋白表达水平均是影响结肠癌术后3年总体生存率的关键因素;多因素Cox回归分析结果显示,淋巴结转移、临床分期较晚、切缘肿瘤细胞阳性及BCL9L蛋白低表达水平均是影响结肠癌患者术后3年总体生存率的独立危险因素。BCL9L蛋白低表达结肠癌患者术后3年的总体生存率显著低于高表达者;Spearman相关性分析结果显示,BCL9L蛋白的表达水平与结肠癌术后肿瘤复发转移和死亡率明显相关。在正常的细胞中,BCL9L蛋白帮助激活caspase-2蛋白以应对异常数量的染色体,引发自毁程序;但是在结肠癌细胞中BCL9L基因缺陷,caspase-2蛋白沉默导致结肠癌细胞中出现染色体数量异常,且不断发展。以上提示BCL9L基因在结肠癌细胞中缺失, caspase-2蛋白沉默导致结肠癌细胞无限制的生长,从而使患者术后肿瘤复发转移率升高,可作为结肠癌患者临床诊疗靶点及其术后预后指标。
综上所述,BCL9L蛋白在结肠癌中异常低表达,不仅影响结肠癌患者复发转移与死亡,而且影响结肠癌患者的预后。尽管关于这种特殊的基因异常表达的临床数据很少,但随着治疗靶点的研究发现与治疗方法的改进,进一步优化临床分期有助于高危结肠癌患者准确选择辅助治疗方式。

