WT1基因在急性髓细胞性白血病微小残留病检测中的应用*
李乾鹏,曹荣旋,张俊英,孙艳花,王宝宏,冉学红
山东省潍坊市人民医院血液科,山东潍坊 261000
急性髓细胞性白血病(AML)是一类起源于白血病干细胞的造血系统恶性克隆性疾病,严重危害人类健康[1]。AML的发病率逐年上升,且5年生存率小于50%[2]。尽管AML的治疗已取得较大进展,但由于疾病易复发、耐药,导致多数患者最终治疗失败,其重要原因是微小残留病(MRD)的存在,MRD是指白血病经诱导化疗获得完全缓解后体内残留的白血病细胞,不易被化疗药物杀伤,是引起AML复发、耐药的根本原因[3]。因此,精准检测MRD具有重要的科学意义和临床应用价值。融合基因检测是监测MRD的重要手段之一,对于AML患者的诊疗及预后判断具有重要意义,其中RUNX1-RUNX1T1和早幼粒细胞白血病蛋白(PML)/视黄酸受体(RAR)α(PML/RARα)是AML患者中较常见的融合基因,约占10%~20%[4-5]。肾母细胞瘤基因1(WT1)定位于人类染色体11q13,WT1在正常造血干祖细胞中呈低表达,在成熟血细胞中不表达。WT1在AML患者骨髓细胞中通常过表达,且与肿瘤负荷呈一定的相关性,为AML的生物标志物[6-7],WT1亦是MRD检测的有效指标。然而,关于WT1与融合基因(RUNX1-RUNX1T1、PML/RARα)相关性研究及综合应用两者评估MRD的研究较少,需进一步探讨。本研究通过检测融合基因(RUNX1-RUNX1T1、PML/RARα)和WT1转录本水平,以探讨联合检测融合基因(RUNX1-RUNX1T1、PML/RARα)和WT1对AML患者预后评估的价值。
1 资料和方法
1.1一般资料 选取2018-2020年于本院确诊并完成RUNX1-RUNX1T1或PML/RARα和WT1基因联合检测的伴重现性遗传学异常的196例AML患者为研究对象。其中男112例,女84例;年龄50(10,74)岁。所有患者经骨髓细胞形态学、细胞遗传学、免疫表型及分子生物学检查确诊为AML。应用实时荧光定量PCR(qPCR)方法同时检测RUNX1-RUNX1T1、PML/RARα和WT1转录本水平,将RUNX1-RUNX1T1或PML/RARα融合基因转录本水平为0%看作融合基因阴性组(139例),包括AML伴RUNX1-RUNX1T1的患者46例,急性早幼粒细胞白血病(APL)伴PML/RARα的患者93例,将RUNX1-RUNX1T1且PML/RARα融合基因转录本水平均不为0%看作融合基因阳性组(57例),包括AML伴RUNX1-RUNX1T1的患者37例,APL伴PML/RARα的患者20例。本研究经本院医学伦理委员会批准。
1.2方法 收集新鲜骨髓液0.5~1.0 mL,采用乙二胺四乙酸抗凝,试剂Trizol为美国Invitrogen公司产品,常规法提取总RNA。应用罗氏Z480 qPCR仪进行检测。白血病相关融合基因检测试剂盒购自上海源奇生物医药科技有限公司,Trizol法提取总RNA后按照试剂盒说明书进行检测。以ABL基因作为内参基因,目的基因的转录本水平以目的基因拷贝数/内参基因拷贝数的百分比来表示。

2 结 果
2.1WT1基因在融合基因阴性组、阳性组中的表达情况 融合基因阴性组患者的WT1转录本水平为0.096%(0.007%,1.990%),融合基因阳性组患者WT1转录本水平为1.420%(0.100%,60.340%);融合基因阴性组患者WT1转录本水平低于融合基因阳性组患者,差异有统计学意义(P<0.01)。其中,在融合基因阴性组中,AML伴RUNX1-RUNX1T1患者与APL伴PML/RARα患者的WT1转录本水平分别为0.096%(0.007%,1.990%)和0.095%(0.009%,1.240%),差异无统计学意义(P>0.05),见图1、2。
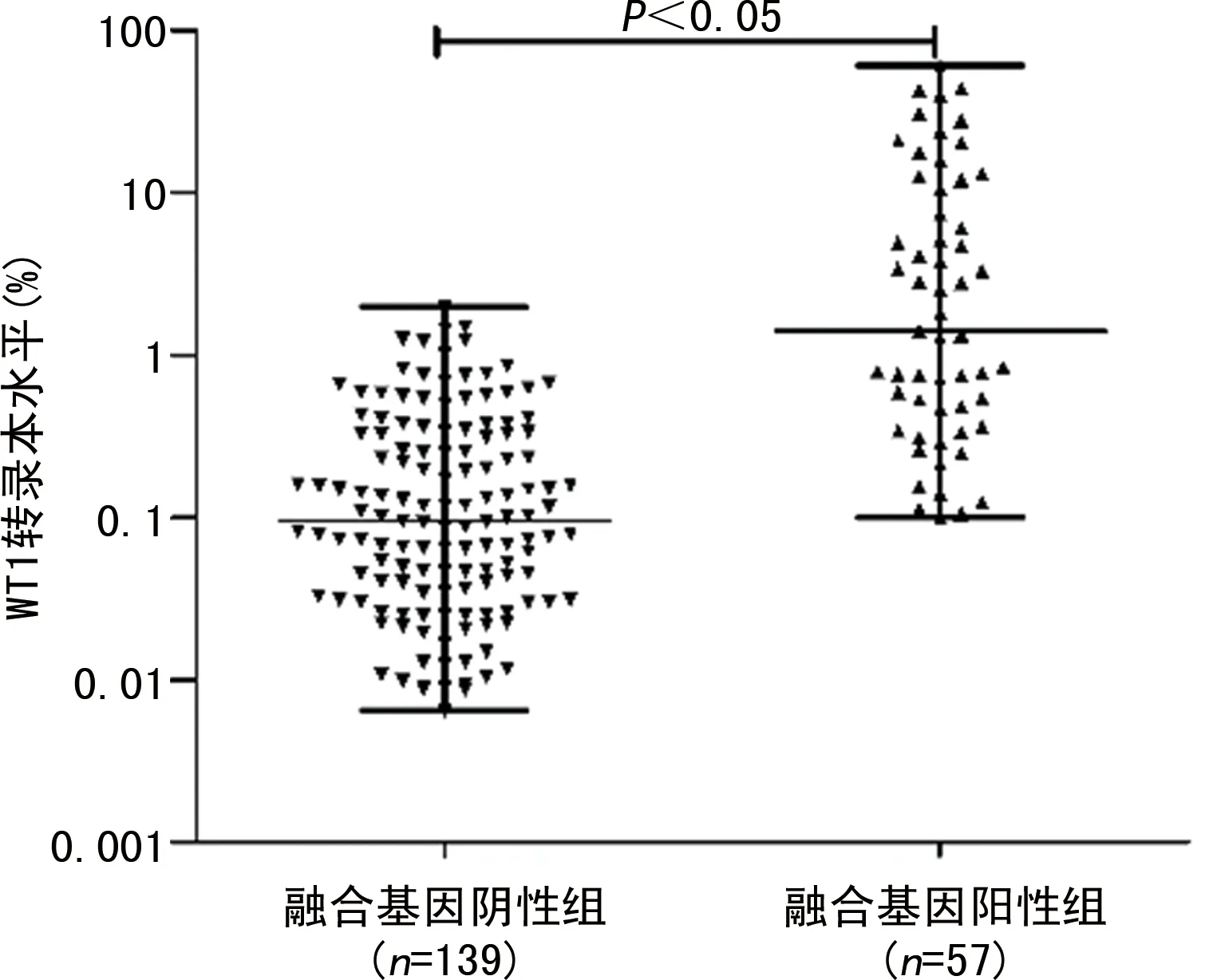
图1 融合基因阴性组患者与融合基因阳性组患者WT1转录本水平比较
2.2WT1基因在融合基因低表达组、融合基因高表达组中的表达情况 横向检测57例融合基因阳性组患者中每例患者的WT1和融合基因转录本水平,在40例融合基因转录本水平≥1%的患者中(融合基因高表达组),38例患者融合基因转录本水平高于WT1转录本水平,占比95%;在17例融合基因转录本水平<1%的患者中(融合基因低表达组),16例患者WT1转录本水平高于融合基因转录本水平,占比94%。由此可见,在融合基因高表达组,融合基因检测MRD的敏感性高于WT1;在融合基因低表达组,融合基因检测MRD的敏感性低于WT1,可联合检测融合基因和WT1,以此提高MRD的检测深度。见图3。
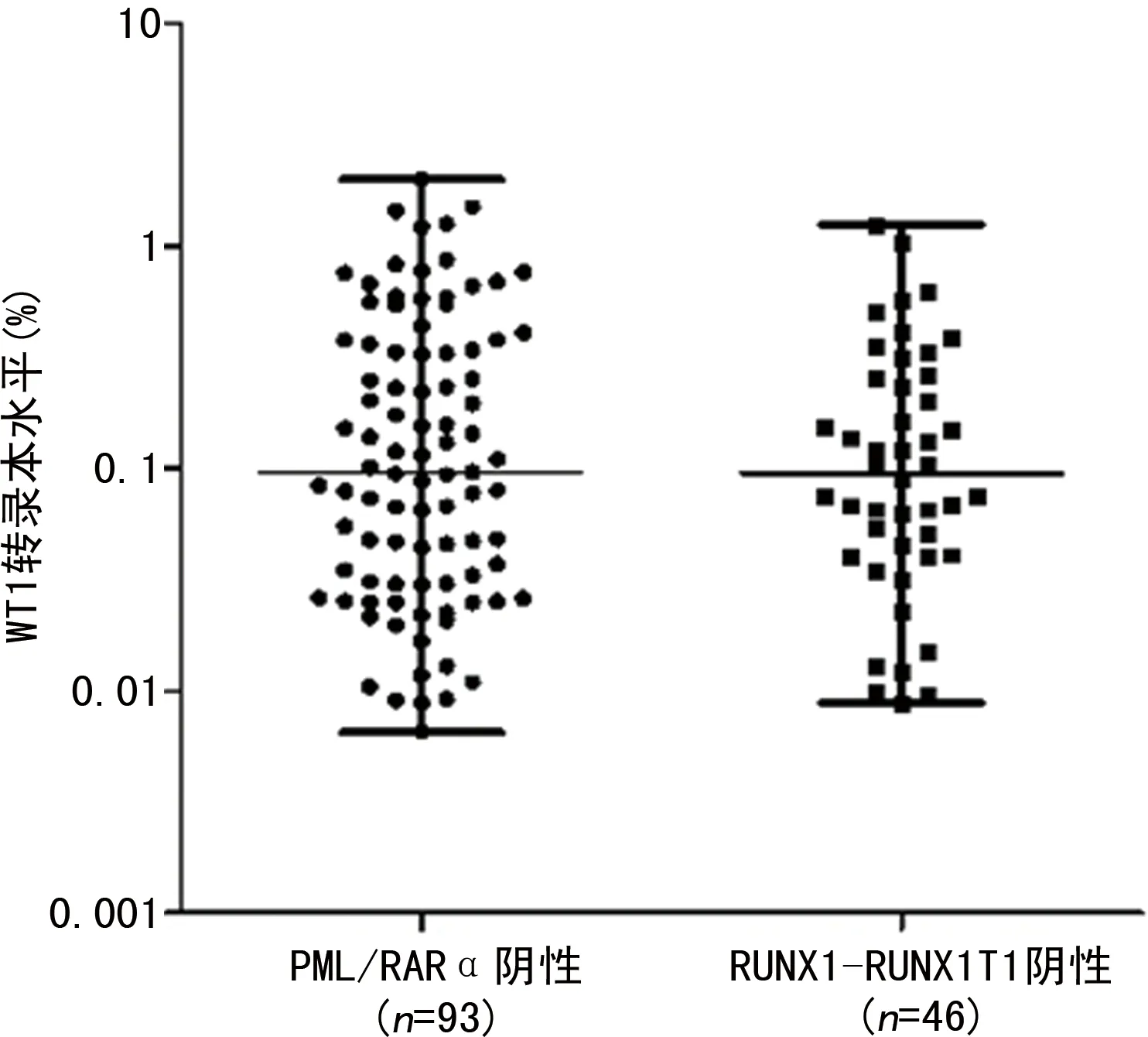
图2 PML/RARα阴性患者与RUNX1-RUNX1T1

图3 WT1基因在融合基因阳性组中的表达水平
3 讨 论
AML是一类严重危害人类健康的造血系统恶性疾病,具有高度异质性的AML的治疗已取得较大进展,但由于疾病易复发,导致多数患者最终治疗失败。AML的预后与患者遗传学标志物、分子生物学特征、MRD等相关,MRD是影响AML预后和疗效评价的重要因素[3]。伴重现性遗传学异常的AML约占AML的30%,此类患者临床表现独特,预后相对较好,但仍有部分患者易复发,临床治疗困难[8],因此,准确有效地动态检测MRD具有重要的临床应用价值。
RUNX1-RUNX1T1融合基因由t(8;21)(q22;q22.1)形成,AML伴RUNX1-RUNX1T1的发病率约占AML的12%~15%,且多见于FAB分型中的M2型,AML伴RUNX1-RUNX1T1通常预后良好,美国国家综合癌症网络指南将此类型归为低危组,高剂量化疗或造血干细胞移植可取得较好疗效,但AML伴RUNX1-RUNX1T1患者的临床及实验室特征、预后不尽相同[5,9]。研究发现临床因素影响AML伴RUNX1-RUNX1T1患者的预后,多数初治AML伴RUNX1-RUNX1T1患者的白细胞水平不高,而白细胞水平升高者则预后较差[5,10]。另有研究报道,单RUNX1-RUNX1T1融合基因不会导致白血病的发生,RUNX1-RUNX1T1融合基因合并多种基因突变(如C-KIT、FLT3、NPM1、CEBPA)共同作用致使白血病的发生,即“二次打击”学说,AML伴RUNX1-RUNX1T1患者合并C-KIT exon17、FLT3-ITD基因突变时,其预后较差,因而,对AML伴RUNX1-RUNX1T1患者进行全面精准地预后评估至关重要。PML/RARα融合基因由15号染色体上的PML基因与17号染色体上的RARα易位形成[4]。PML/RARα融合基因既能下调核酸适配子的表达,导致核体结构破坏,亦能募集组蛋白去乙酰酶和甲基化酶,以此增加共抑制复合物和视黄酸靶基因启动子甲基化,进而影响髓系细胞分化、增殖、凋亡及DNA修复等生物学进程,使髓系细胞停滞于早幼粒细胞阶段,继而导致APL的发生[4,11]。PML/RARα融合基因是APL的关键驱动基因。APL具有独特形态学和细胞遗传学特征,临床以严重的凝血异常为特征,约占AML的10%~15%,APL是首个针对肿瘤特异性标志分子应用靶向诱导分化治疗并取得良好疗效的恶性肿瘤[12]。APL的特异性标志分子PML/RARα融合基因是全反式视黄酸与砷剂的靶点,全反式视黄酸作用于PML/RARα融合基因的RARα基因,并诱导APL细胞分化成熟,砷剂能够降解PML/RARα融合基因表达产物,并触发APL细胞的凋亡机制。尽管多数APL患者治疗效果较好,但仍有约10%~20%的APL患者复发[13]。因而,探寻APL复发的生物标志物具有重要的科学意义和临床价值。综上所述,探寻伴重现性遗传学异常的AML复发难治的生物标志物仍具有重要的科学意义和临床价值。通过对MRD精准的动态监测,早期发现复发难治征象,筛选并预测出可能复发的个体,对于复发干预措施的具体实施具有重要意义,能够有效地预防疾病复发和改善患者预后。
本研究提示联合检测融合基因和WT1转录本水平,可提高MRD检测的敏感性和准确性,能够更好地评估白血病患者的预后和临床发展趋势。研究报道,WT1基因与白血病发生、发展相关,WT1基因在评估白血病患者预后及预测疾病发展趋势方面具有重要应用价值。WT1基因是定位于11号染色体短臂的抑癌基因,在转录因子调控和调节组织发育中发挥重要作用,WT1基因参与骨髓髓系细胞增殖分化过程,WT1基因转录本水平与白血病原始细胞肿瘤负荷相关,是白血病细胞的肿瘤标志物[6]。约10%的AML患者存在WT1基因异常,包括框外缺失、框外插入、过早地终止密码子等,WT1 mRNA高表达与AML预后不良相关[6,14]。WT1 mRNA在骨髓增生异常综合征(RAEB)各亚型患者中的表达水平均高于健康者,且WT1表达水平随着RAEB的疾病进展升高,并与RAEB或RAEB-t共同影响AML的发生发展[15]。初诊时高表达WT1基因的AML患者3年总生存期仅为19%,而低表达者3年总生存期高达64%[16]。在AML患者诱导化疗过程中,WT1基因转录本水平降低速率亦与患者预后相关,WT1基因转录本水平降低预示较好的总生存期和无病生存期[3]。AML伴RUNX1-RUNX1T1患者造血干细胞移植(HSCT)后,WT1转录本水平与累积复发率相关,WT1转录本水平>0.6%的患者3年累积复发率在28.4%~41.2%,WT1转录本水平≤0.6%的患者3年累积复发率在15.6%~16.2%[16]。WT1基因在健康骨髓细胞呈低表达状态,有研究表明WT1基因在健康者骨髓细胞中表达上限为0.60%[17]。还有研究表明WT1基因在健康者骨髓细胞中表达上限为2.5%[18]。本研究发现,融合基因阴性组患者的WT1转录本水平为0.096%(0.007%,1.990%);融合基因阳性组患者的WT1转录本水平为1.420%(0.100%,60.340%),组间比较差异有统计学意义(P<0.05)。有研究表明,WT1基因与FCM-MRD联合预测AML早期复发的灵敏度、特异度、有效性均高于WT1基因和FCM-MRD单独检测[19]。WT1基因高表达与FCM-MRD阳性是AML和急性淋巴细胞白血病(ALL)患者HSCT后复发的独立危险因素,联合检测WT1基因与FCM-MRD可预测AML和ALL患者HSCT后的总生存期和无病生存期[19-20]。
综上所述,MRD检测手段的联合应用能够更精准地评估白血病患者的预后。本研究发现融合基因高表达组(融合基因转录本水平>1%)中融合基因转录本水平高于WT1转录本水平,融合基因低表达组(融合基因转录本水平<1%)中WT1转录本水平高于融合基因转录本水平,由此可见,在融合基因高表达组,融合基因作为MRD的敏感性高于WT1,在融合基因低表达组,融合基因作为MRD的敏感性低于WT1,因此,联合检测融合基因和WT1转录本水平,能够提高MRD检测的敏感性和准确性,以此更好地评估白血病患者的预后和临床发展趋势。本研究尚有不足之处,目标人群样本数量受限,且数据来源于单中心。今后需积累更多样本,以便提高研究的准确性与代表性,并加强多中心协作。

