食管胃结合部腺癌生物信息学分析及Involucrin基因突变位点筛选
吕 雪,李雪薇,杨 婷,郑锦秀,祝子鹤,杨 涛,3*,徐 钧
(山西医科大学 1.生物化学与分子生物学教研室;2.药理学教研室;3.细胞生理学教育部重点实验室,山西 太原030001;4.山西医科大学第一医院 肝胆胰外科,山西 太原030001)
食管胃结合部腺癌(adenocarcinoma of the esophagogastric junction,AEG)是发生于食管-胃交界处的腺癌,表现出与食管癌、胃癌既相关又独特的临床病理特征,山西、河北和河南三省交界处是AEG发病率和病死率最高的地区[3]。
食管黏膜上皮基底层的角质细胞通过形成包膜作为防御屏障的基础, IVL是第一个被发现的包膜前体蛋白[4],在TGase1的作用下与其他包膜前体蛋白发生交联[5]。在食管腺癌和巴雷特食管的生物信息分析中,IVL是显著改变的差异表达基因[6-7],但目前尚未见IVL异常表达对肿瘤细胞生物学功能影响的研究,IVL突变在AEG中的研究也未见报道。
本文以山西地区AEG患者为研究对象,通过全外显子组测序、TCGA数据分析IVL的突变情况,并进一步探讨IVL异常表达和突变对肿瘤细胞生物学功能的影响。
1 材料与方法
1.1 材料
1.1.1 细胞系及组织标本:食管癌细胞系KYSE150、KYSE30、TE9 购自ATCC(american type culture collection),由本实验室自存。
医院普通外科切除的22例SiewertⅡ型AEG患者的肿瘤组织及癌旁组织,委托上海华大基因公司运用高通量测序(high-throughput sequencing)技术进行测序,测序深度为200×。
食管癌的基因表达数据来自TCGA数据库(https://tcga.xenahubs.net/download/TCGA.ESCA. sampleMap/HiSeq_exon.gz),包含185例肿瘤样本和11例正常对照样本,并经Log2标准化(由于目前并无AEG的TCGA表达谱数据和标准化细胞系,TCGA数据库中AEG患者的IVL突变率为1%,Siewert Ⅱ 型AEG的生物学特性与食管癌更为相近,且IVL在SNU-1、AGS、GES等胃癌细胞中几乎不表达,所以本文采用的TCGA数据和细胞系皆为食管癌)。
经山西医科大学第一医院伦理委员会监督下实施,患者标本采集及检测全部经知情同意后实施,批准文号:[2020]伦审字(K036)号。
1.1.2 主要试剂:RPMI1640培养基(含0.4 mmoL/L的Ca2+, Hyclone公司);胎牛血清(FBS)(Moregate Biotech公司);NeofectTMDNA transfection reagent(Neofecth公司);Ultrapure RNA Kit、HiFiScript gDNA Removal RT MasterMix(Cwbiotech公司);IVL寡肽(中国常州康龙生物科技有限公司合成);3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物(MTT)、G-418(Solarbio公司);Involucrin抗体(Abcam公司);Transglutaminase1抗体(Novus公司);Streptavidin-HRP抗体(Cell Signaling Technology公司)。
1.2 方法
1.2.1 差异表达基因的筛选:由于目前并无AEG的TCGA表达谱数据,且TCGA中AEG数据的IVL突变率为1%,所以本文采用的TCGA数据为食管癌数据。将TCGA数据库中的196例食管癌样本分为两组,一组为15例IVL突变肿瘤样本和170例非IVL突变肿瘤样本(T&T组),一组为15例IVL突变肿瘤样本和11例正常对照样本(T&N组),以Log2FC>1或Log2FC<-1,P<0.05为条件对两组进行筛选,筛选得到的差异基因输入Venny网站(http://bioinfogp.cnb.csic.es/tools/venny/index.html)中,用韦恩法取交集得到共同差异表达基因。
1.2.2 GO分析和KEGG富集分析:将上述基因的ID统一为Entrez Gene ID输入到DAVID在线工具(https: //david.ncifcrf.gov/home.jsp)中,选择Functional Annotation Too作为分析工具进行 GO 分析和 KEGG 信号通路分析,筛选条件为P<0.05。
1.2.3 细胞分组及处理:KYSE150、KYSE30和TE9细胞[8-9]用含10% FBS和1%青-链霉素的RPMI 1640培养基,在 37 ℃、5% CO2培养箱中培养,鉴于后期实验中需要检测TGase1催化IVL交联的活性,而TGase1是Ca2+依赖性蛋白,故选用含有0.4 mmoL/L Ca2+的RPMI 1640培养基。
选取对数增殖期的KYSE150、KYSE30、TE9细胞接种于6孔板中,KYSE150分为GV362-NC组和GV362-IVL组;KYSE30和TE9分为shCtrl组、shIVL-1318组、shIVL-1593组、shIVL-1640组、shIVL-2930组。
1.2.4 质粒的构建:IVL过表达质粒GV362-IVL由上海GeneChem公司构建,上游引物为:5′-TACCG GACTCAGATCTCGAGCGCCACCATGTCCCAGCAAC ACACACTGCCAG-3′,下游引物为:5′-TCCTTGTAG TCCATGGATCCTTTATGTTTGGGTGGCCACTGCAC-3′。IVL敲减质粒由上海GenePharma公司构建,靶向IVL的shRNA序列见表1。
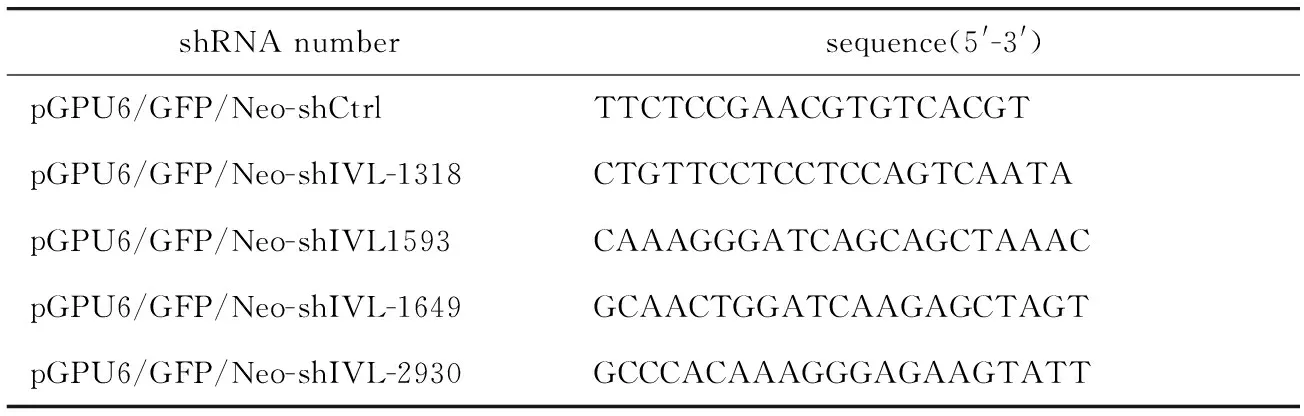
表1 靶向IVL的shRNA序列Table 1 shRNA sequence targeting IVL
1.2.5 IVL过表达和IVL敲减质粒转染及G418的筛选:待细胞汇合至80%~90%时,用NeofectTMDNA transfection reagent分别转染IVL过表达或敲减质粒,48 h后用G-418(600 μg/mL)筛选稳定转染细胞株。
1.2.6 RT-qPCR检测IVLmRNA:使用Ultrapure RNA Kit从细胞中提取总RNA,按照HiFiScript gDNA Removal RT MasterMix说明进行反转录,利用QuantiNova SYBR Green PCR Kit进行qPCR,以GAPDH为内参。引物序列见表2。
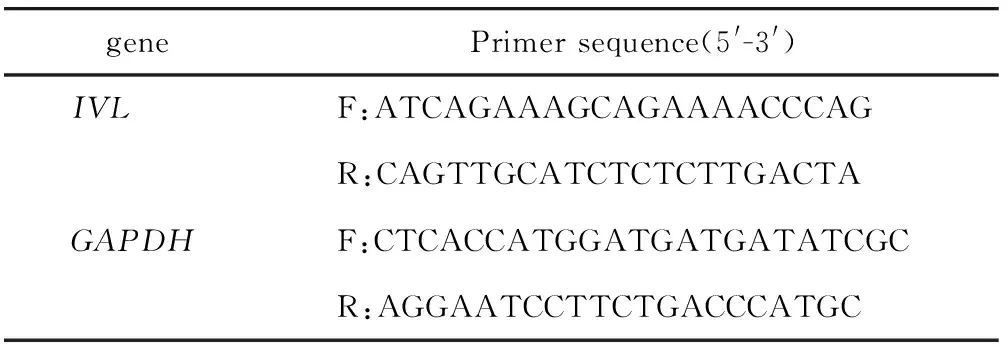
表2 qPCR引物序列Table 2 qPCR primer sequences
1.2.7 蛋白质印迹检测IVL和TGase1蛋白:使用RIPA(radio immunoprecipitation assay)裂解液提取细胞总蛋白,BCA法对蛋白进行定量分析。通过SDS-PAGE分离蛋白质,并转移至聚偏氟乙烯膜(PVDF)上,室温下用5%的脱脂牛奶封闭1 h,加入一抗4 ℃过夜孵育,次日加入二抗室温孵育1 h,加入ECL发光液曝光显影。
1.2.8 MTT法检测细胞增殖:取对数增殖期的KYSE150细胞,按1×103个/孔接种至96孔板中,实验分为NC组和IVL过表达组,每组设置3个复孔。分别培养0、1、2、3、4和5 d后,每孔加入20 μL(5 g/L)的MTT,4 h后终止培养,弃去培养基,加入150 μL DMSO,振荡10 min,检测490 nm处的吸光度值(A)。
1.2.9 划痕愈合实验:取对数增殖期的细胞接种于6孔板中,每组设置3个复孔,待细胞完全汇合后用200 μL的枪头在孔板内行“井”字划痕,保证每孔划痕宽度一致。用PBS清洗脱落的细胞后,加入无血清培养基,分别于0 h和12 h时在相同位置拍照观察划痕愈合情况。
1.2.10 寡肽合成及体外寡肽与TGase1结合能力分析:为了检测IVL突变对TGase1催化活性的影响,根据测序结果和TCGA数据库中IVL的突变情况,合成13种N端标记生物素的IVL寡肽片段(表3)。以pepK5[10]和Net1、Net2(http://genomics.dote.hu/wiki)作为阳性对照,其余10个寡肽为野生型和突变型IVL寡肽分别作为对照组和实验组。
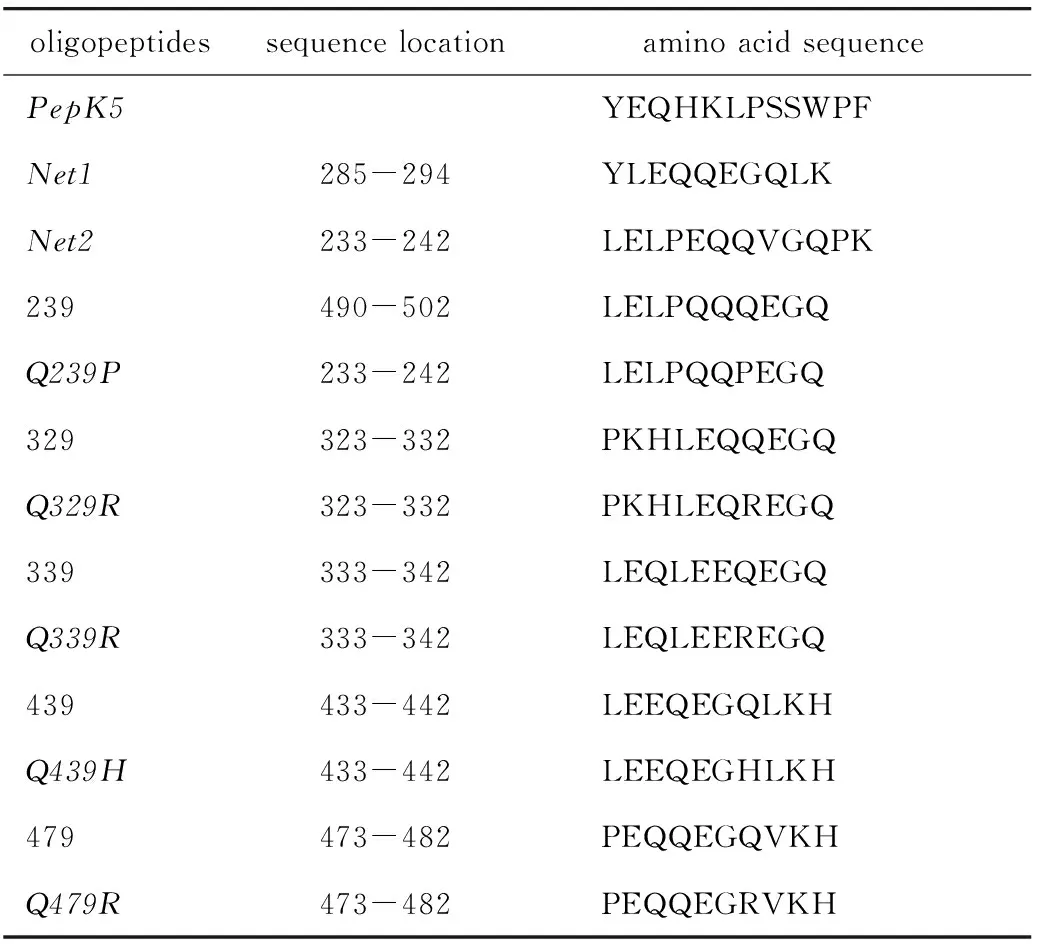
表3 IVL寡肽片段序列Table 3 IVL oligopeptide fragments sequence
为减少内源性IVL与TGase1结合对实验的影响,利用shRNA敲减细胞内源IVL;向培养基中另外添加0.3、0.6、0.9 mmoL/L的Ca2+(即终浓度为0.6、1、1.3 mmoL/L),分别培养2,4,6 d后,提取的裂解液中加入pepK5(终浓度为300 mmoL/L),37 ℃孵育30 min,进行Western blot分析验证内源性TGase1的活性;激活细胞中的TGase1后,收集细胞沉淀,提取细胞总蛋白,分成13组,向每组中加入不同的寡肽,终浓度为300 mmoL/L,37 ℃孵育30 min,进行Western blot分析。
1.3 统计学分析
2 结果
2.1 AEG全外显子组测序和IVL突变的生物信息学分析
对22例山西AEG患者的癌和癌旁组织进行全外显子组测序,发现突变率位于前5位的基因分别是Tp53、Ttn、Muc16、Nalcn和IVL。IVL的突变率为18%,在4例肿瘤样本中发生了5处突变(图1A),皆为错义突变。将TCGA数据库中的196例食管癌样本分为T&T组和T&N组进行差异基因表达分析(图1B)。 T&T组筛选出1 707个差异基因,T&N组筛选出4 221个差异基因,使用Venny网站工具取交集,得到777个共同差异表达基因(图1C)。GO功能分析显示IVL突变与上皮细胞分化、细胞分化的调控、中性粒细胞趋化和肿瘤坏死因子激活受体的活性等生物学过程有关(图1D)。KEGG分析表明差异基因富集到细胞因子与细胞因子受体的相互作用、cAMP、TNF等信号通路中(图1E)。
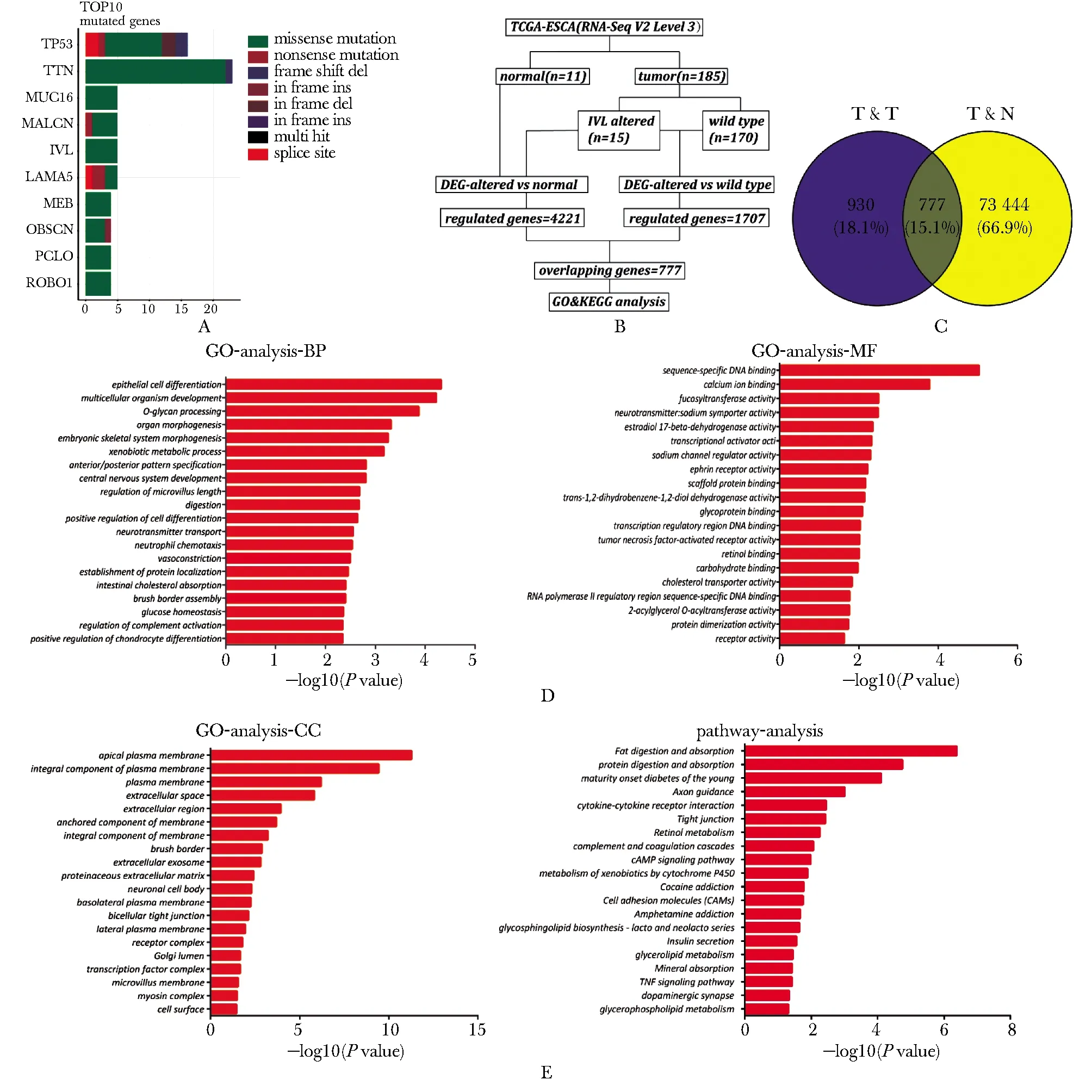
A.gene mutation analysis of the whole genome sequencing results of cancer tissues and adjacent tissues of 22 AEG patients in Shanxi Province;B.data analysis process of 196 cases of esophageal cancer in TCGA database; C.venn diagram method analysis of the common differentially expressed genes of the T&T group and the T&N group;D,E.GO and KEGG analysis of 777 differential genes图1 AEG全外显子组测序及196例食管癌生物信息学分析Fig 1 AEG Whole Exome Sequencing and bioinformatics analysis of 196 cases of esophageal cancer
2.2 过表达IVL抑制食管癌细胞的增殖和迁移
在KYSE150、KYSE30和TE9三种细胞中,KYSE30细胞IVL表达最高,KYSE150的IVL表达最低(图2A)。将过表达质粒GV362-IVL转染KYSE150,经过G418筛选得到稳定过表达IVL细胞株,与NC组相比,IVL过表达组在mRNA和蛋白水平明显上调(图2B,C)。IVL过表达可抑制食管癌细胞的增殖,上调IVL可抑制划痕的愈合速度(图2D,E)。

A.IVL protein expression levels of KYSE150, KYSE30, and TE9 cell lines;B.RNA level of KYSE150; C.protein level of KYSE150 over-expression efficiency; D.MTT test of KYSE150 with IVL over-expression;E.effect of over-expressed IVL on cell migration was verified by scratch healing experiment;*P<0.05,**P<0.01 compared with control group图2 过表达IVL对食管癌细胞增殖和迁移的影响Fig 2 Effect of over-expression of IVL on the proliferation and migration of esophageal cancer
2.3 IVL重复基序第7位氨基酸的突变可能是其蛋白质功能影响的关键因素
3种食管癌细胞中,TE9的TGase1表达水平最高(图3A),shIVL-1318可降低TE9细胞内IVL的 mRNA和蛋白水平(图3B~E)。终浓度1mmoL/L的Ca2+处理TE9细胞4 d后,TGase1活性较好(图3F)。Q439H突变寡肽与TGase1结合能力明显比野生型寡肽弱(图3G)。
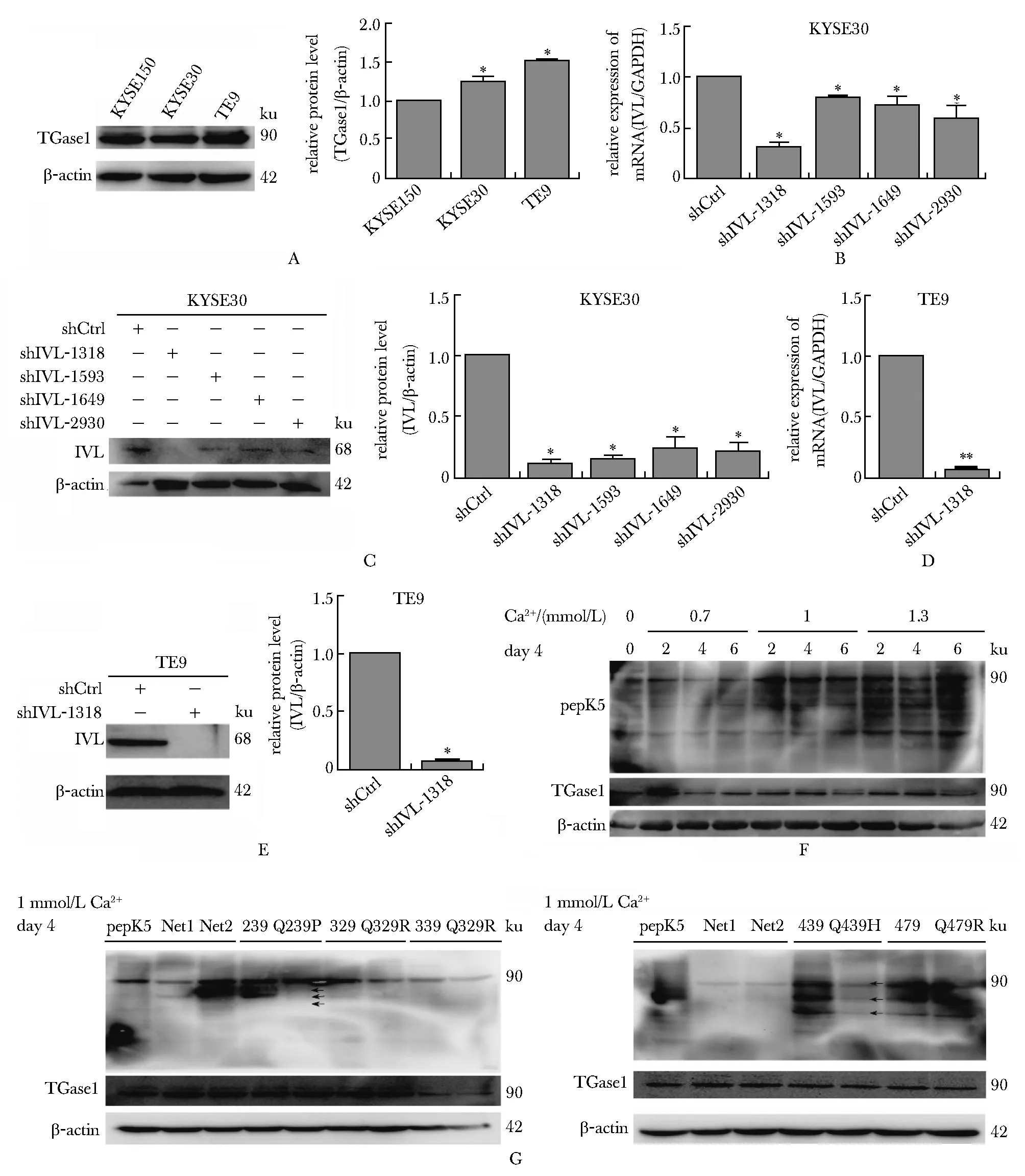
A.TGase1 levels in KYSE150, KYSE30 and TE9 cells;B,C.verification of IVL knockdown in KYSE30 cells, RNA level(B), protein level(C);D,E.effect of SHIVL-1318 plasmid knockdown on TE9 cells was detected, mRNA level(D), protein level(E);F.detection of TGase1 activity at different Ca2+ concentration treatment for different time;G.detectoin of oligopeptides binding with TGase1;*P<0.05,**P<0.01 compared with control group图3 野生型IVL寡肽和突变型IVL寡肽与TGase1结合活性的比较Fig 3 Comparison of binding activity of wild-type IVL oligopeptide and mutant IVL oligopeptide with TGase1
3 讨论
研究表明AEG在国内外发病率逐年升高[11],且多数AEG患者发现晚,病死率高[12]。因此,早期诊断对于提高AEG患者预后显得尤为重要。目前中国AEG的诊断治疗方法以采用内镜活检和手术为主,除靶向治疗及免疫治疗相关指标外,仍无一种分子指标或综合指标可以替代传统的病理诊断地位[13]。本研究通过对22例山西省AEG患者癌和癌旁组织进行全外显子组测序并联合分析TCGA数据,发现山西人群中IVL基因突变率高达18%,而TCGA数据库中排名前10位的突变基因并无IVL基因突变,这种明显的差异预示IVL突变有可能是山西AEG特有的发病原因。
IVL作为早期分化标志蛋白,在上皮细胞中的表达增多会促进分化、抑制增殖[14],这与本文上调IVL后抑制增殖和迁移的结果一致。IVL的蛋白结构中有39个重复序列,重复基序为[LP]-[EKG]-[LHVYQEK]-[PLSQE]-[EQDV]-[QHEKRGA]-Q-[EMVQLP]-[GKLE]-[QHVNLD]。22例食管胃结合部腺癌患者的测序结果和TCGA数据库食管癌中有24处IVL突变,有23处突变(除了Q72H)分布在重复序列中,Q突变占62.5%,重复序列中第7位氨基酸Q最为保守,且TGase1与IVL结合位点也是Q,综上推测重复基序第七位Q的突变可能会影响IVL功能。因此,针对23处突变中有5个发生在重复基序第7位氨基酸的突变设计了10个野生寡肽和突变寡肽去验证这种突变是否会影响与TGase1的结合能力。结果表明突变的Q439H寡肽与TGase1结合能力减弱,证实该突变可能无法通过TGase1参与角质包膜的形成;Q239P寡肽虽然与TGase1结合能力几乎不变, 但是和其他包膜前体蛋白结合能力减弱(IVL还与FLG、LOR、RPPL、SPRR1A等包膜前体蛋白结合[10, 15])。由于这些寡肽并无蛋白质的高级结构,具有完整结构的突变IVL是否与突变的寡肽一样,通过减弱与TGase1或其他包膜前体蛋白结合从而导致角质包膜形成障碍,还需要进一步研究。
本研究发现,山西地区食管胃结合部腺癌患者IVL突变率高达18%,过表达IVL可抑制食管癌细胞中的增殖和迁移,IVL Q439H突变可能影响其与TGase1结合,以上结果为探索山西地区食管胃结合部腺癌的发病机制提供了一种新的参考。
——细胞生长因子

