A型塞内卡病毒VP2蛋白原核表达及免疫原性分析
崔 川,刘佳欢,韩伟建,张俊娟,张义明,李丽敏
(河北农业大学动物医学院,保定 071000)
A型塞内卡病毒(Senecavirus A, SVA)最早于2002年从人胚胎视网膜细胞的培养污染物中分离得到[1],经鉴定分析发现SVA是一种新型的小RNA病毒,国际病毒分类委员会将其归类为“塞内卡病毒属”,并命名为“A型塞内卡病毒”[2]。近年来,越来越多的研究表明SVA与猪原发性水疱病和新生仔猪死亡率升高密切相关[3-6],猪被SVA感染后,表现发热、厌食、跛行等症状,鼻、吻或口腔黏膜会出现完整或破裂的小泡,蹄壁及冠状带出现溃疡性病变,新生仔猪感染后死亡率显著增加。2015年,我国首次分离到SVA中国毒株并测定了其全基因组序列[7],随后湖南省、湖北省、福建省、河南省、黑龙江省、广西省等多个省份均发现了SVA的流行分布[8-13],疫情发展迅猛,给养猪业造成了严重的经济损失。
塞内卡病毒粒子呈二十面体结构,无囊膜,直径为25~30 nm[4]。 基因组为单股正链RNA,全长约7.3 kb,包括666 bp长的5'非编码区、71 bp的3'非编码区、非编码区之间唯一的开放阅读框(opening reading frame, ORF),具有小RNA病毒科病毒基因组的共同特点,即呈L-4-3-4分布[1]。前体蛋白P1可被3C等蛋白酶分解为4个结构多聚蛋白亚基VP4、VP2、VP3、VP1,用于病毒的衣壳的合成[4]。已有研究显示,VP1、VP2和VP3蛋白都可诱导机体产生免疫应答,在抗SVA感染和缓解临床症状中发挥着至关重要的作用,其中VP2蛋白比VP1和VP3蛋白具有更好的免疫原性[14]。Maggioli等[15]证明VP2蛋白作为四种结构蛋白中氨基酸数量最多的蛋白含有SVA的主要中和表位,VP2蛋白产生的中和抗体在控制宿主SVA病毒血症中起重要作用。而且值得注意是的,VP2特异性IgG抗体一直到感染后的第35 d还能被检测到,这相对于VP1、VP3是无法比拟的优势[16]。Dvorak等[17]通过原核表达VP1、VP2、VP3蛋白建立间接ELISA方法检测SVA阳性血清,也证明了抗VP2的抗体反应高于VP1和VP3,在ELISA检测上表现出较高的亲和力,对阳性与阴性的鉴别能力更强。这些证据都表明,无论是在机体抗SVA感染研究,还是临床疾病检测和疫苗研制中,VP2都是不可忽略的关键性靶点。
因此,本试验拟从蛋白结构预测和蛋白表达两个方面对SVA VP2蛋白进行分析,旨在结合模型预测与实际数据,全面、客观地展示SVA VP2蛋白的生物学特性。蛋白结构预测和免疫原性分析为病毒诊断和疫苗的开发奠定坚实的基础。
1 材料与方法
1.1 菌株与试剂SVAVP2基因序列由通用生物公司合成;特异性引物由生工生物工程(上海)有限公司合成。限制性内切酶XhoⅠ和BamHⅠ购自New England Biolabs公司;IPTG、PVDF膜、Anti-His标签单克隆抗体、小鼠IL-2和IFN-γ双抗夹心ELISA试剂盒购自Solarbio公司;预染蛋白质分子质量标准、感受态大肠杆菌BL21(DE 3)购自TransGen Biotech公司;辣根过氧化物酶标山羊抗鼠IgG、DAB显色液购自中杉金桥公司;MONTANIDETMIMS 251C VG佐剂购自SEPPIC公司;HisTrap HP蛋白纯化柱购自GE Healthcare公司。
1.2 SVA VP2基因序列合成通过比较SVA CH-01-2015(GenBank登录号:KT321458.1)、SVV HN16(GenBank登录号:MF893200.1)、CH-ZW-01-2016(GenBank登录号:KX751946.1)、CHhb17(GenBank登录号:MG983756.1)、SVA/HLJ/CHA/2016(GenBank登录号:KY419132.1)的VP2基因,委托通用生物公司合成序列长度为867 bp的SVAVP2基因,并通过XhoⅠ和BamHⅠ限制性内切酶酶切后连接到pET32a(+)质粒,进行酶切和测序验证。
1.3 SVA VP2基因序列分析及蛋白结构预测使用http://web.expasy.org/protparam/ 在线服务器根据SVAVP2基因序列推导出氨基酸序列和理化性质;使用http://bioinf.cs.ucl.ac.uk/psipred/ 在线服务器对SVV VP2蛋白的二级结构进行预测。
1.4 SVA VP2蛋白的表达使用质粒提取试剂盒提取pET32a(+)-SVA-VP2质粒,转化到BL21(DE3)表达感受态细胞中,在100 mg/L AMP LB培养液中扩大培养。以菌液为模板使用SVA VP2特异性引物进行PCR鉴定。检测阳性的菌液百1%接种到LB培养基中,200 rpm、37℃培养至OD600值为0.6~0.8,加入终浓度为1 mmo/L的IPTG诱导表达离心收集菌体,加入细菌裂解液后进行超声裂解。待菌液清亮时,离心后收集上清液及沉淀物。加入SDS上样缓冲液混匀煮沸处理,将样品进行SDS-PAGE电泳,考马斯亮蓝染色后使用凝胶成像系统拍照分析其表达情况。
1.5 SVA VP2蛋白可溶性表达条件的确定对于影响SVA VP2蛋白表达的四种因素分别设置四个水平条件: 诱导表达时间、温度、诱导剂IPTG浓度、培养转速。使用Iatin 正交助手软件设计正交试验,选择L16(45)正交表,得出共16个试验方案(表1)。每组分别收集全菌体和裂解后上清液进行SDS-PAGE电泳,使用DRAFT-alphaview图像处理软件对16组试验进行灰度分析,扣除背景后取所选区域平均灰度,比较表达量以确定最佳表达条件及各因素影响水平。
1.6 SVA VP2蛋白的纯化及Western blot鉴定使用最佳的诱导表达条件对SVA VP2蛋白诱导表达并裂解后收集上清液,充分混匀后0.45 μm滤器过滤。使用UNICORN6软件控制ÄKTA™pure蛋白纯化系统按程序进行Ni柱亲合层析法纯化。纯化的SVA VP2蛋白进行SDS-PAGE电泳,电泳完成后使用转膜仪将凝胶上蛋白转移到PVDF膜,5%脱脂奶粉的TBST 4℃摇床封闭过夜;Anti-His单克隆抗体作为一抗37℃温育1 h;辣根过氧化物酶标记的山羊抗鼠IgG作为二抗,37℃温育1 h;加入DAB显色液,室温避光显色。
1.7 多克隆抗体的制备将纯化的SVA VP2蛋白与MontanideTMIMS 251C VG佐剂按照4∶1的体积比运用双推法充分乳化。初次免疫采用背部皮下多点注射健康獭兔,蛋白免疫剂量为250 μg/只,注射剂量为1 mL;第二次免疫与初次免疫间隔时间14 d,采用肌肉注射,剂量与初次免疫相同。第二次免疫10 d后分离血清稀释100倍作为一抗进行Western blot鉴定,步骤同上。Western blot鉴定阳性后,使用饱和硫酸铵沉淀纯化IgG,将纯化的IgG进行SDSPAGE电泳。
利用间接ELISA方法测定多克隆抗体效价:将重组SVA VP2蛋白以25 ng每孔包被ELISA板,4℃过夜;PBST洗涤后每孔加入5%脱脂奶粉的的PBST,37℃ 封闭1 h;向孔内加入多克隆抗体倍比稀释液37℃ 孵育1 h;各孔加入HRP山羊抗兔IgG,37℃孵育1h;洗涤后,向各孔内加入TMB显色液,室温反应15 min后终止反应,利用酶标仪测定OD450值。
1.8 小鼠血清细胞因子检测按照如上的方法对SVA VP2蛋白进行乳化,初次免疫采用颈背部皮下多点免疫小鼠,蛋白剂量为50 μg/只,注射剂量为0.2 mL;第二次免疫与初次免疫间隔时间14 d,免疫剂量、途径相同。对经两次免疫后第10 d的小鼠采血,并分离血清,使用小鼠IL-2和IFN-γ双抗夹心ELISA试剂盒检测血清中的细胞因子,设置梯度阳性对照(标准品)、阴性对照和空白对照,将待测血清稀释4倍按照说明书进行操作。通过ELISACalc软件绘制标准曲线,对结果进行分析。
2 结果
2.1 基因合成和表达质粒构建鉴定测序显示SVAVP2基因正确合成,且使用XhoⅠ和BamHⅠ对构建pET32a(+)-SVA-VP2重组质粒的双酶切鉴定可将约867 bp的目的片段切下,符合预期结果(图1)。对转化pET32a(+)-SVA-VP2重组质粒的BL21(DE3)单克隆大肠杆菌进行PCR特异性鉴定,扩增后条带大小约为867 bp,说明pET32a(+)-SVA-VP2重组质粒构建成功。

图1 重组质粒pET32a(+)-SVA-VP2的酶切鉴定Fig.1 Enzyme digestion identification of recombinant plasmid pET32a(+)-SVA-VP2
2.2 SVAVP2基因序列分析及蛋白结构预测SVA VP2蛋白由284个氨基酸构成,相对分子质量是50 kDa,等电点为5.03,在动物体内带负电荷,估计半衰期:1.1 h(哺乳动物网状细胞,体外),不稳定指数:34.57,归类为稳定蛋白。
SVA VP2蛋白的二级结构预测结果如图2,分析表明该蛋白含有15%的α螺旋(Helix)、50%的β折叠(Strand)和24%的卷曲(Coil)结构。高比例的α螺旋和β折叠的存在为蛋白的结构提供刚性支撑,这表明VP2蛋白的稳定性较好;无规则卷曲结构是构成酶活性和蛋白质特异功能的主要部位,VP2蛋白上大量的卷曲结构上表明其可能富含抗原表位,有较高的免疫原性。这些为SVA VP2蛋白的成功表达和良好的免疫效果提供了理论支持,VP2蛋白可作为进一步研究的对象。

图2 SVA VP2蛋白的二级结构预测Fig.2 Secondary structure prediction of SVA VP2 protein
2.3 SVA VP2蛋白的诱导表达情况对重组表达菌进行诱导表达,分别对诱导前、诱导后和裂解后上清液、沉淀取样,在相同的条件下对空载体菌株进行诱导作为对照,将样品处理后进行SDS-PAGE电泳。结果可知,经诱导表达后,重组质粒菌株比空载体菌株以及重组质粒菌未诱导多出一条约50 kDa的蛋白条带,且上清液中的蛋白表达量明显多于沉淀,表明SVA VP2蛋白诱导表达成功,且主要为可溶性表达(图3)。
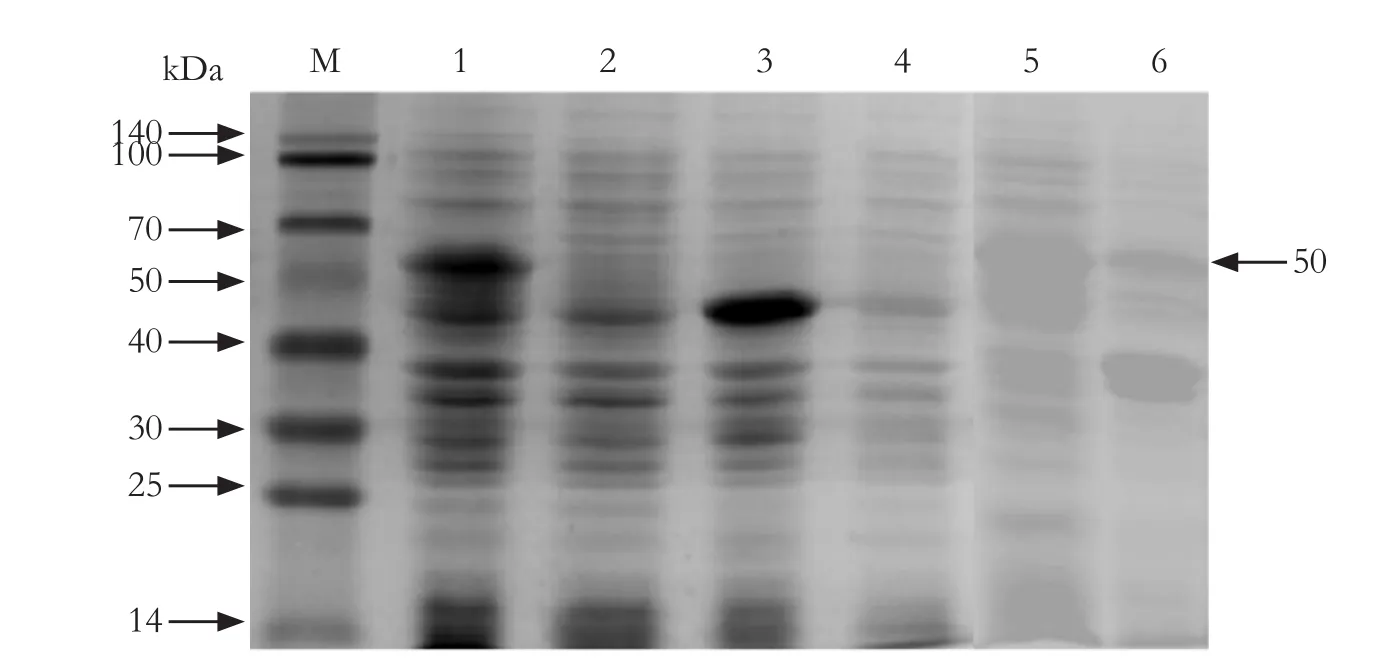
图3 SVA VP2蛋白的表达情况Fig.3 Expression of SVA VP2 protein
2.4 SVA VP2蛋白可溶性表达条件的优化通过灰度分析对正交设计中不同条件SVA VP2诱导表达量进行比较,平均蛋白表达量K1、K2、K3、K4值反映各因素的不同水平对蛋白表达量影响的大小,并以此确定试验的最佳搭配。用各因素各个水平蛋白平均表达量的极差R来反映各因素的水平变动时对实验结果影响的大小。结果可知SVA VP2蛋白可溶性表达最佳诱导条件为培养转速120 rpm、诱导时间8 h、诱导温度30℃、诱导剂IPTG浓度0.5 mmol/L(表1)。本试验中,因素的主次顺序为诱导时间>诱导温度>诱导剂IPTG浓度>培养转速。

表1 正交设计实验方案与数据分析Table 1 Experimental scheme of orthogonal design and data analysis
2.5 SVA VP2蛋白纯化与鉴定结果对诱导表达的蛋白进行纯化,纯化后SDS-PAGE电泳(图4)并使用鼠源抗His标签单克隆抗体进行Western blot鉴定,可见在约50 kDa处出现单一条带,表明SVA VP2纯化成功且均有良好的免疫活性。

图4 SVA VP2蛋白的纯化与Western blot鉴定Fig.4 Purification of SVA VP2 protein and Western blot identification
2.6 兔血清多克隆抗体的鉴定使用二免第10 d后的血清作为一抗Western blot检测,在50 kDa处出现了清晰的条带,表明SVA VP2蛋白引起了兔血液中特异性抗体水平的提高。利用心脏致死量采血,分离血清,将纯化的IgG进行SDS-PAGE电泳,可见纯化效果较好(图5)。采用间接ELISA方法进行VP2特异抗体效价测定,抗体效价为1∶12 800-1∶25 600。
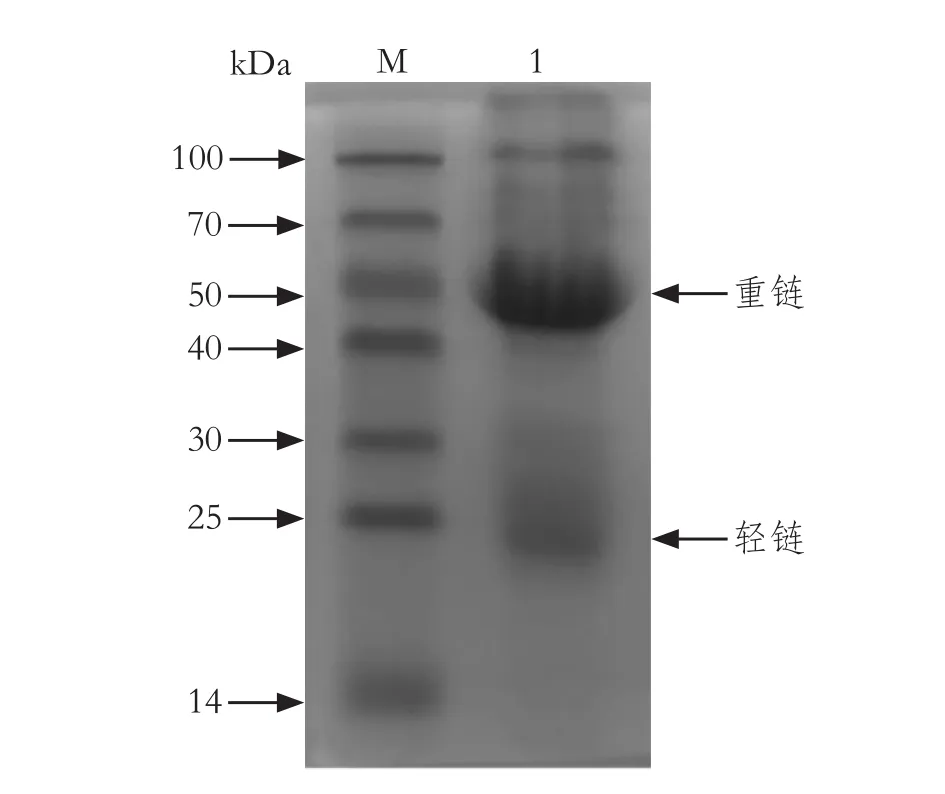
图5 纯化的兔血清中IgG的SDS-PAGE鉴定Fig.5 SDS-PAGE identification of IgG in purified rabbit serum
2.7 小鼠血清细胞因子的检测结果分别以IFN-γ和 IL-2标准品的浓度为横坐标,OD值为纵坐标,使用ELISACalc软件进行4参数Logistic 曲线拟合,绘制各自标准曲线。各标准曲线的R2均大于0.99,可用此标准曲线计算各样品中相应细胞因子的含量。
用ELISA检测试剂盒检测二免后小鼠血清中IFN-γ和IL-2的水平,结果可知,免疫VP2蛋白组与对照组血清中IFN-γ的含量有极其显著性差异(P<0.0001),IL-2的含量显著高于对照组(P<0.001)(图6)。这表明VP2蛋白能诱导IFN-γ和 IL-2的表达与分泌,在小鼠体内具有良好的免疫原性。
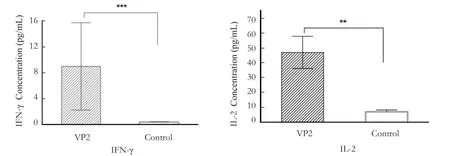
图6 血清中IFN-γ和IL-2的含量Fig.6 Serum IFN-γ and IL-2 levels
3 讨论
塞内卡病毒引起的塞内卡病是猪群中一种新发的传染病,与口蹄疫、猪水疱病、水疱性口炎合称为猪四大水疱性病毒病[16]。相比较其他3种疫病的病原,塞内卡病毒的研究较少,尤其在蛋白免疫原性和表位分析等方面的研究更少。张永宁等[18]通过原核表达系统制备了高效价的兔源VP2蛋白多克隆抗体,本试验也获得了相似的结果;并且,我们将SVA VP2蛋白免疫小鼠,发现VP2蛋白在小鼠体内亦有良好的免疫原性。申珊等[19]利用VP2蛋白建立的间接ELISA方法有良好的特异性、敏感性,结合本研究对VP2蛋白免疫原性的分析结果,提示我们以VP2蛋白以及其单克隆抗体为基础建立更加可靠的竞争ELISA、夹心ELISA方法是完全可行的。目前,对蛋白进行生物信息学分析已经成为很多表位鉴定和蛋白功能研究首选方法,通过一系列的预测可以了解目标蛋白的基本性质,从而为目标蛋白的表达和功能的研究提供参考。本研究对SVA VP2蛋白的一级、二级结构进行了初步分析,为以后单克隆抗体制备和抗原表位的鉴定提供理论依据。
本研究成功表达了可溶性的SVA VP2蛋白,和包涵体蛋白相比,可溶性蛋白富含更多的构象表位,其与天然病毒蛋白的结构更为接近,从而有更好的免疫原性。但是,可溶性蛋白比包涵体蛋白纯化过程更加复杂。本次试验中通过提高样品稀释液中咪唑浓度以及采用梯度洗脱以减少杂蛋白干扰;通过使用β-巯基乙醇和非离子去污剂减少杂蛋白的结缔疏水作用,从而成功纯化了VP2蛋白。本次试验中使用正交设计对可溶性蛋白表达条件进行优化。相对于只改变单一因素的重复试验,正交设计能够均匀分散,齐整可比的研究多因素及多水平对结果的影响,故可以更加准确的确定可溶性表达的最佳条件。
本研究利用大肠杆菌原核表达系统成功表达了可溶性的SVA VP2蛋白,对SVA VP2蛋白的生物学特性进行了初步分析;VP2蛋白在兔子和小鼠体内具有良好的免疫性。上述结果为进一步研究基于SVA VP2蛋白的病毒诊断技术和疫苗开发奠定良好的基础。

