不同温度下蝶豆的生理生化响应
林雪燕,侯健,金睿哲,薛秋华*
(1福建农林大学园林学院,福建福州 350002;2福建农林大学国际学院,福建福州 350002)
蝶豆(Clitoria ternatea)又名蓝蝴蝶、蝴蝶花、蓝花豆,为蝶形花科(Papilionaceae)蝶豆属(Clitoria)植物,原产于印度、印度尼西亚、泰国、越南等热带、亚热带国家,在我国广东、广西、海南、香港、台湾等地有栽培[1,2]。蝶豆的各个器官均可利用,具有较高的药用、食用、观赏和经济价值,其为传统药用植物,其花朵提取物具有抗氧化、抗溶血、抗高血压等药理活性[3],根提取物可抗抑郁和潜在治疗认知功能下降[4];蝶豆花朵含有丰富的水溶性花青素和维生素,其花瓣含有的酚类成分在不同的pH 下可使饮品、糕点调制不同的颜色,是天然的植物染料,可作为绿色功能性保健食品开发[5];其花朵提取的香料可用于卷烟加香[6];常作为饲料牧草种种植[7-8];其对狗牙根、马唐、白花鬼针草的萌发有抑制作用,可作为果园杂草防治植物[9];作为多年生的藤蔓植物被运用在吊盆、垂直绿化上,可快速营造拱门、廊架等园林景观。
温度是影响植物生长的主要环境因子之一,高温或低温均可影响植物生长发育,在全球气候变化的大背景下,极端天气频繁发生,冬春低温寒害、夏季极端高温热害影响植物生长,严重时引起死亡,给农业生产造成损失[10-11]。植物会发生一系列生理生化变化以适应温度变化:抗氧化防御系统中的SOD、POD、CAT 能够清除活性氧自由基,减轻或者避免膜损伤;当温度超过植物生长所能忍耐的温度时,植物细胞产生的活性氧会加剧膜脂过氧化反应,增加的自由基破坏超氧化物酶系统,积累过氧化产物如MDA,植物通过渗透调节物质、光合色素含量变化来调控相关的代谢途径从而降低或消除胁迫的影响[12]。蔡月琴等[13]利用光照培养箱控制温度以研究温度胁迫下宝莲灯(Medinilla magnifica)生理变化,高温下其CAT 活性、相对电导率及MDA、可溶性蛋白、Pro 含量增加,SOD、POD 活性呈下降趋势;低温下其MDA、Pro 含量随温度下降而上升,SOD、POD 活性显著降低。蒋瑶等[14]研究表明野生湖北百合(Lilium brownii)随着温度升高,其MDA 含量上升,相对电导率增加,可溶性糖和Pro 含量升高,CAT 活性先升高后下降。金花茶组植物(Camellia petelotii)在温度下降过程中其相对电导率和温度呈负相关,其MDA、可溶性糖和Pro 含量均先上升后下降[15]。可见,不同植物的生理指标对于温度变化的响应不一致,学者对于植物的生理变化的测量指标较为相似。
国内对蝶豆的研究主要集中在蝶豆的形态描述[7]、繁殖栽培技术[1,2,16]、蝶豆花提取的工艺[6]上,关于其对温度变化的生理生化响应尚未见报道。本研究以盆栽蝶豆幼苗作为研究对象,利用智能光照培养箱控制温度,探明蝶豆内部生理生化对温度的响应,为蝶豆的推广与应用提供理论参考依据。
1 材料与方法
1.1 试验材料
供试材料为蝶豆苗。种子于2020 年11 月采集于广东江门香草小镇。选择大小一致、饱满健康的种子于2021 年2 月17 日温汤浸种催芽,种子萌发后播种至32 孔穴盘中(泥炭∶蛭石=3∶1),待长至2 片真叶时,选择长势一致的幼苗移栽到塑料盆(上口径17 cm,下口径13 cm,高16 cm),种植基质体积配比为菇渣∶园土∶蛭石=1∶1∶1。期间在福建农林大学园林学院下安实验楼天台进行露天栽培管理。
1.2 试验设计
于2021 年5 月选择长势一致(株高为20~25 cm,茎粗3.5~4.0 mm,叶片10~15 片)、生长健壮的蝶豆转入智能光照培养箱(25℃/20℃,12 h/12 h)预处理1 d 后进行温度梯度处理,以25℃(CK)作为对照组,试验温度设置:2℃、5℃、10℃、15℃、30℃、35℃、40℃、45℃,温度处理8 h 后取样。本试验使用光照智能培养箱来控制其他环境对结果的干扰,处理过程光照培养箱相对湿度为60%,光照强度为3000 Lux。每个处理3 个重复。
1.3 指标测定
观察记录蝶豆在不同温度下的叶片形态变化。
测定植物生理生化指标:在不同温度处理后采集植株的顶芽以下第2~5 片叶子裁剪、称量0.2 g于自封袋,迅速放置在液氮中冷冻,并保存在-80℃冰箱中,统一测定生理生化指标。生理生化指标测定的方法参考《植物生理生化实验原理和技术》[17],所有处理指标均重复测定3 次。氮蓝四唑法测定超氧化物酶(Superoxide dismutase,SOD)活性;紫外吸收法测定过氧化氢酶(Peroxidase,CAT)活性,愈创木酚法测定过氧化物酶(Peroxidase,POD)活性;硫代巴比妥酸法测定丙二醛(Malonaldehyde,MDA)含量;电导率法测定细胞膜透性(Cell membrane permeability,CMP);蒽酮比色法测定可溶性糖(Soluble sugar,SS)含量;考马斯亮蓝G-250 法测定可溶性蛋白(Soluble protein,SP)含量;酸性茚三酮染色法测定脯氨酸(Proline,Pro)含量;乙醇浸提法测量叶绿素a(Chlorophylla,Chla)含量、叶绿素b(Chlorophyll b,Chlb)含量、叶绿素总含量(Chlorophyll content,Chla+b)、类胡萝卜素(Carotenoid,Car)含量。
1.4 数据处理与分析
数据整理和制图使用Excel 2016 软件。使用SPSS 20.0 分别对蝶豆温度梯度下不同的生理指标进行单因素方差分析(One-way ANOVA),多重比较采用Duncan 法,差异显著水平为P<0.05。
2 结果与分析
2.1 蝶豆叶片形态观察
蝶豆在不同温度下叶片形态有发生变化,在10~40℃时叶片形态表现正常,无明显变化。低温5℃胁迫下,顶端嫩梢下垂,叶片完好;低温2℃下,顶端嫩梢下垂,嫩叶闭合,放置室温环境下快速恢复。高温45℃下,蝶豆嫩梢下垂,叶片无闭合,生长较为完好。
2.2 不同温度梯度下蝶豆保护酶活性的变化
如图1 所示,在低温或高温处理下,蝶豆SOD活性均呈现先上升后下降的趋势。当温度从25℃降至15℃时,SOD 活性显著上升(P<0.05),15℃处理下的SOD 活性最高,为25℃的1.5 倍。温度从25℃升高至40℃时,蝶豆的SOD 活性显著上升(P<0.05),40℃处理下的SOD 活性有最大值,是25℃的1.5 倍,45℃蝶豆的SOD 活性下降。各试验组的SOD 活性均高于CK 值,且均具有显著差异(P<0.05)。以上结果表明,蝶豆SOD 活性的低温、高温抑制温度分别为15℃和40℃。
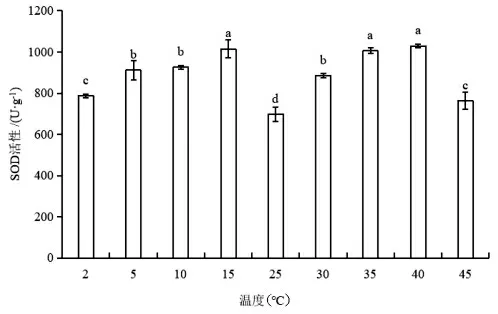
图1 不同温度下蝶豆的SOD 活性
如图2 所示,随着温度降低或升高,CAT 活性先下降后上升,15℃处理下的CAT 活性为CK 的42.2%,具显著差异,15℃下降至5℃的CAT 活性变化平缓(P>0.05),温度从5℃降至2℃时CAT 活性显著上升,为CK 的1.3 倍。温度上升引起CAT酶活性变化,30℃处理下CAT 活性最小,45℃下的活性最大,为CK 的1.5 倍。

图2 不同温度下蝶豆的CAT 活性
如图3 所示,随着温度降低,蝶豆叶片的POD活性呈先下降后上升趋势;5℃下的POD 活性最低,为CK 值的46.6%。随着温度上升,POD 呈先下降后上升的趋势,30℃下的POD 酶活性最低,为CK的60.4%。各梯度温度处理下的蝶豆POD 活性均比CK 的低。
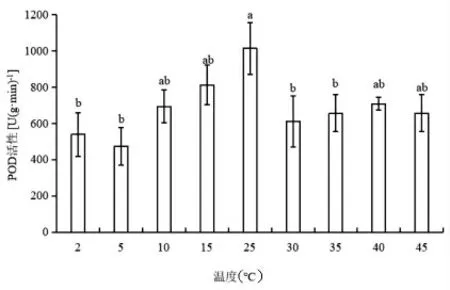
图3 不同温度下蝶豆的POD 活性
2.3 不同温度梯度下蝶豆叶片MDA 含量和相对电导率的变化
如图4 所示,温度下降时MDA 含量呈现先升高后微下降趋势;在5℃下MDA 含量为最大值,为CK 的1.7 倍,2℃、5℃处理无显著差异(P>0.05)。随着温度上升,MDA 含量呈现先下降后上升趋势,在40℃为最小值;当温度从40℃变化至45℃时,MDA 含量迅速上升至CK 值的1.2倍(P<0.05)。蝶豆生长适应为15~40℃。
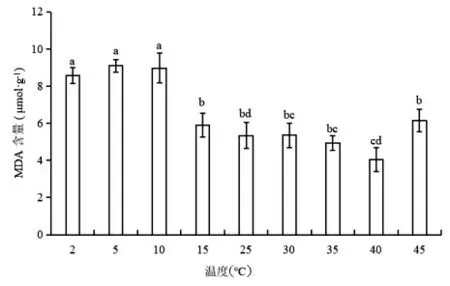
图4 不同温度下蝶豆的MDA 含量
如图5 所示,随着温度降低,细胞膜透性先降低后增加,在15℃有最小值,为CK 的76.2%;温度从10℃降到5℃细胞膜伤害程度变化最大,增幅至CK 的1.4 倍,2℃的细胞膜透性为CK 的1.4 倍,与5℃的差异不显著(P>0.05)。随着温度升高,蝶豆叶片细胞膜透性先降低后升高,在40℃有最小值,细胞伤害最小,为CK 的63.2%;45℃有最大值,细胞伤害最大,细胞膜透性为CK 的2.4 倍。上述结果表明,低温5℃低温处理对蝶豆细胞膜产生显著影响(P<0.05),45℃高温处理叶片膜系统损伤最大。

图5 不同温度下蝶豆的细胞膜透性
2.4 不同温度梯度下蝶豆渗透调节物质含量变化
如图6 所示,低温下蝶豆的可溶性糖含量呈现先上升后下降趋势,在10℃达到最大值,为CK 的1.2 倍;温度下降至5℃时,可溶性糖含量显著下降(P<0.05),2℃和5℃的可溶性糖含量相等,是CK值的1.1 倍。高温下,蝶豆的可溶性糖含量变化趋势同为先上升后下降,30℃下的可溶性糖含量是CK 的1.04 倍;35℃、40℃的可溶性糖含量比CK值高;45℃下的可溶性糖含量显著下降至CK 值的0.7 倍。

图6 不同温度下蝶豆的可溶性糖含量
如图7 所示,随着温度下降,可溶性蛋白含量呈现先上升后下降趋势。可溶性蛋白值含量在15℃有最大值,其含量是CK 的1.1 倍(P>0.05),随后下降。随着温度上升,可溶性蛋白呈先下降后上升趋势,30℃可溶性蛋白含量显著下降,随后上升,45℃的可溶性蛋白为CK 值的1.2 倍。

图7 不同温度下蝶豆的可溶性蛋白含量
如图8 所示,随着温度降低,蝶豆的Pro 含量先上升后下降再上升。温度开始降低时,Pro 含量缓慢上升,10℃处理下Pro 迅速上升至CK 的2 倍含量,随后在低温5℃下Pro 含量降低至CK 的0.8倍,2℃又上升至CK 的1.4 倍。随着温度升高,Pro 含量变化趋势与低温下的大体一致,第一个温度梯度下,Pro 含量上升缓慢,至35℃时,Pro 含量上升至CK 的2.3 倍,随后在40℃Pro 含量显著下降,45℃下Pro 含量又上升至CK 的1.5 倍。
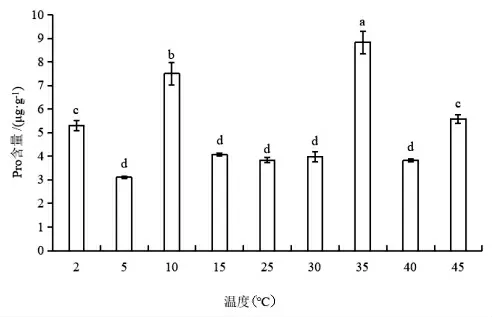
图8 不同温度下蝶豆的Pro 含量
2.5 不同温度梯度下蝶豆光合色素含量变化
如表1 所示,温度下降时蝶豆的Chla、Chlb、Chla+b 呈现先下降后上升趋势,在15℃有最小值,分别与CK 相差0.16 mg/g,0.45 mg/g,0.62 mg/g;类胡萝卜素呈现先上升后下降趋势,在5℃有最大值,为CK 的1.4 倍。随着温度升高,4 个指标变化趋势均为波浪形变化,均在30℃下降至最小值,Chla、Chlb、Chla+b 在35℃上升至最大值,随后下降。5℃、2℃的4 种光合色素含量均较CK 的大,35℃及以上温度的4 种光合色素总体较CK 的大。
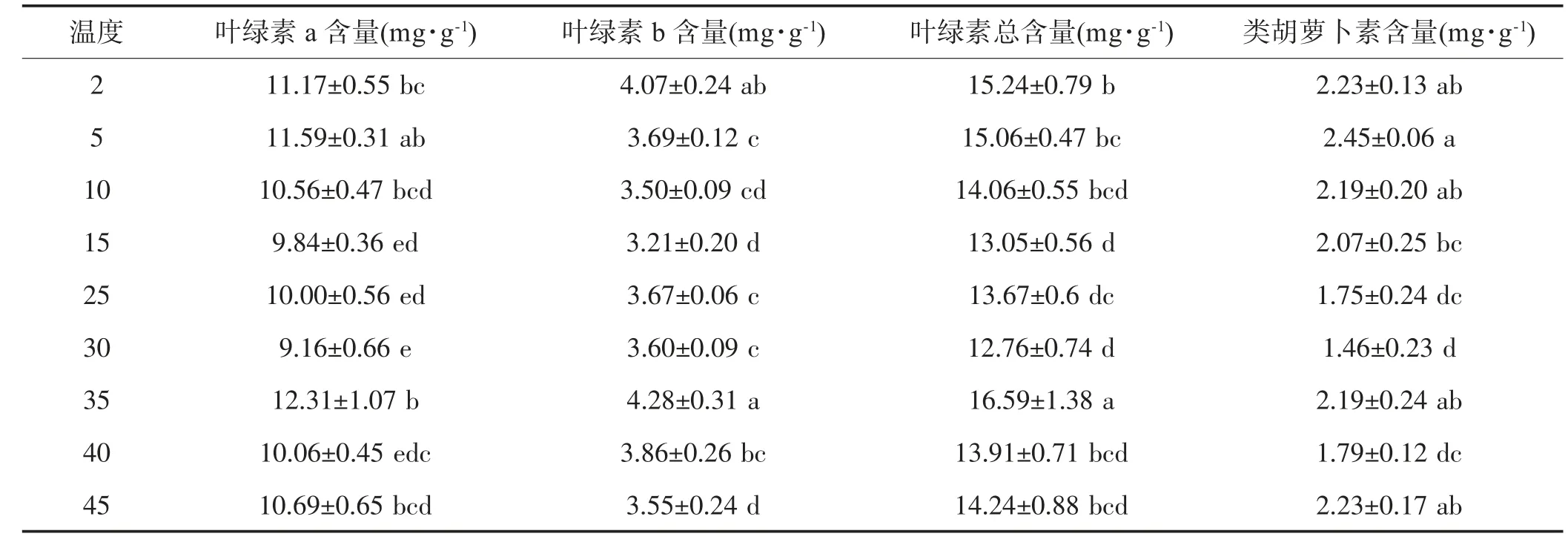
表1 不同温度下蝶豆的光合色素
3 讨论与结论
3.1 讨论
3.1.1 不同温度梯度下蝶豆保护酶活性的变化
植物在遭受逆境时会产生活性氧,自由基含量过多会影响细胞的正常生命活动,需要通过抗氧化防御系统清除[18]。SOD、CAT、POD 是植物体内的抗氧化防御系统的主要抗氧化酶,三者之间具有协同作用,能够有效地清除活性氧自由基,减轻或避免活性氧对脂膜的攻击,防止膜损伤[19]。SOD是植物抗氧化的第一道防线,能够保护细胞免受超氧化物诱导的氧化胁迫[18],SOD 活性升高通常能够说明植物对逆境具有耐受性。温度降低或升高时,蝶豆通过SOD 含量升高消除超氧化物,减轻膜脂过氧化对植物的伤害,当温度持续地降低或者升高超过了蝶豆所能承受的极限时,SOD 表达被抑制,酶活性下降[18]。低温下蝶豆SOD 变化趋势与桃树(Prunus persica)[20]花朵和卫矛属(Euonymus)植物[12]变化趋势一致;高温下蝶豆SOD 变化趋势与鹿角杜鹃(Rhododendron latoucheae)[21]研究结果一致。温度降低或升高,蝶豆CAT 活性均呈先下降后显著升高趋势,可能原因是在温度变化初期蝶豆未受到胁迫,其CAT 敏感度较低,极端温度激发CAT 活性增强来清除过剩的活性氧,从而保护细胞,增强植物的抗逆性[22]。POD 普遍存在于植物中,是植物细胞内活性较高的适应性酶,与植物的呼吸作用、光合作用等密切相关,能够反应植物生长发育特点、体内代谢状况及对外界环境的适应性[18]。正常情况下随着温度下降或升高其变化趋势为先升高后下降、直线下降或先下降后上升[22,23]。在28~43℃的短期高温胁迫下,野生湖北百合的POD 活性呈现先下降后上升趋势[14],本研究中蝶豆的POD 活性在25~45℃内的趋势与其一致。湖北野生百合在部分温度下的POD 活性超过对照组[14],本试验POD 活性均弱于对照组,原因可能是由于不同植物在遭受高温胁迫时的反应机制不一致,还需从分子生物学和遗传学方向上解释。
本试验中,当试验温度从CK 降至15℃时,蝶豆的SOD 活性升高,CAT、POD 活性降低,此时抗氧化防御系统主要由SOD 参与反应;温度从15℃降低至5℃时,SOD、POD 活性均下降,植物中心为保持代谢正常,CAT 活性升高,但是CAT活性弱于对照组,此温度区间主要由SOD 参与调节;在5℃降低至2℃时,虽然POD 活性显著增强(P>0.05),但是活性依旧小于CK 值,此温度区间主要依靠增强CAT 活性消除过氧化产物来适应低温胁迫。在25~30℃之间,温度升高初期SOD 主要参与抗氧化反应;在30~40℃之间,虽然三者活性均增强,但POD、CAT 活性小于对照组,此温度区间主要依靠增强SOD 来适应温度升高的变化;当温度升高至45℃时,仅CAT 活性增强,CAT 主要参与极端高温的抗氧化反应。
3.1.2 不同温度梯度下蝶豆叶片MDA 含量和细胞膜透性的变化
植物受到温度胁迫后,植物产生活性氧自由基进而产生过氧化产物,MDA 为过氧化产物之一。MDA 能够与蛋白质或核酸等形成聚合物破坏细胞膜,细胞内的电解质因为细胞膜透性增大而外渗,表现在可测量的相对电导率上[12,23]。
研究表明,低温下金花茶组植物[15]、红果风铃木(Handroanthus chrysotrichus)[24]、卫矛属[12]植物的MDA 含量呈先上升后下降趋势。本研究也得出类似结果:当处理温度从CK 降至15℃时,蝶豆MDA 含量上升,此时叶片开始有过氧化产物产生,蝶豆对降温处于适应阶段;随着温度下降,植物叶片细胞膜遭受了膜脂过氧化,10℃下蝶豆叶片MDA 含量显著升高,蝶豆过氧化物开始积累,叶片质膜受损;在2℃时MDA 含量些许下降,蝶豆表现出一定的抗性,可能是渗透调节物质的参与保护叶片,减缓了MDA 的生成。在25~40℃之间,MDA 含量降低,说明蝶豆适应此区间温度,能够忍耐40℃高温;但是这种忍耐限度也是有限的,在45℃处理下,蝶豆的MDA 含量骤升,蝶豆幼苗不能适应45℃高温。刘敏和房玉林[25]研究葡萄‘赤霞珠’(Vitis vinifera‘Cabernet Sauvi gnon’)在25~45℃温度下细胞膜透性呈先下降后上升趋势,在40℃有最小值,本试验高温下蝶豆细胞膜透性变化趋势与其一致。
蝶豆在不同温度梯度下的细胞膜透性的变化趋势与MDA 含量的变化趋势总体一致。低温下,10℃下MDA 含量开始积累,5℃下细胞膜透性开始增大,随着抗寒机制的启动,2℃下MDA 含量些许下降,蝶豆对低温具有一定的抵抗能力。40℃下的MDA 含量和细胞膜透性都降到最小,蝶豆能够忍耐40℃高温,可能与蝶豆的原产地有关;蝶豆在45℃处理下的过氧化产物积累,细胞膜被破坏,细胞膜透性显著升高。许多研究表明植物不能耐受45℃的高温[23],低温胁迫对蝶豆叶片的伤害显著强于高温胁迫。
3.1.3 不同温度梯度下蝶豆渗透调节物质含量的变化
植物受到低温胁迫会增加可溶性糖含量[26],当温度降温至10℃,蝶豆叶片增加可溶性糖含量来适应降温,10℃下蝶豆虽然不能通过增加可溶性糖含量来抵御降温,但其含量能够维持在比CK 高的水平以缓解低温对膜系统的伤害;低温下的蝶豆的可溶性糖变化趋势与金花茶组植物的变化趋势较为一致[15]。蝶豆通过可溶性糖积累来适应温度升高,45℃下蝶豆的可溶性糖含量显著下降,蝶豆不能再积累可溶性糖来降低细胞渗透势,缓解高温危害。可溶性蛋白是反映植物抗寒性的重要指标之一,许多植物在低温下的可溶性蛋白含量升高[22],本试验蝶豆的可溶性蛋白含量随着温度降低呈先上升后下降趋势,可能是不同植物在低温下可溶性蛋白的表达形式不一致导致的。高温下蝶豆的可溶性蛋白呈先下降后上升趋势,蝶豆在极端高温高温45℃下能够增加可溶性蛋白含量来调节渗透平衡。Pro 在遭受逆境时会大量积累,研究人员对植物Pro 含量与温度变化关系持有两种观点:一种认为Pro 含量与温度变化无关,一种认为Pro 含量会随着温度降低或升高而上升[24]。温度从CK 降低至15℃时,蝶豆Pro 无明显变化,10℃下Pro 含量跃升,说明10℃是蝶豆低温胁迫初始温度。高温35℃下Pro 含量显著增加,蝶豆迅速积累Pro 以维持35℃下的渗透平衡,减轻逆境伤害;40℃下Pro 含量降低,由于蝶豆本身对高温具有一定的适应能力,所以Pro 含量下降,45℃其含量上升减轻极端高温伤害。
桃树花朵在低温下的可溶性糖和可溶性蛋白先升高后下降[20],Pro 含量先上升后下降再上升,低温下蝶豆3 种渗透调节物质的变化规律与其研究结果一致。温度从CK 升至30℃时,可溶性糖为主要渗透调节物质;35℃下Pro 主要参与渗透调节反应;在40~45℃极端高温下,蝶豆可溶性蛋白、Pro 含量升高来增强细胞渗透调节能力,抵抗高温。
3.1.4 不同温度梯度下蝶豆光合色素含量的变化
叶绿素是植物进行光合作用场所,起捕获光能、吸收光能的作用,是叶片生理活性变化、光合机能大小有关的指标[15,26]。本研究中蝶豆的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量并无持续下降,低温下的蝶豆通过提高叶绿素含量来提高蝶豆的代谢能力。可能因为低温下蝶豆的叶绿素生物合成酶不受限制。前人研究表明叶绿素含量会随温度下降而降低,低温下蝶豆叶绿素变化趋势不一致的具体原因还需从分子机制进一步研究说明。本研究4 种光合色素含量均在35℃有最大值,随后4 种光合色素含量下降,总体较CK 的高,说明温度升高并不减少蝶豆叶绿素合成,其光合色素会出现短暂的上升现象。
3.2 结论
蝶豆幼苗对环境中温度变化较为敏感,能够通过自身调节适应温度的变化,减轻温度胁迫造成的伤害。植物对温度变化受多方面影响,本研究将形态观察与生理生化指标相结合了解蝶豆对不同温度梯度的响应,初步认定蝶豆的最适生长温度为15~40℃,蝶豆适应短期2~5℃的低温处理。综合分析结论如下:短期的重度低温和高温均会对显著抑制蝶豆的生长,蝶豆在低温5℃以下会出现嫩梢下垂、叶片闭合现象,高温45℃出现嫩梢下垂现象,蝶豆对低温反应较高温的敏感。温度在5~40℃期间时,SOD 是清理超氧化物的主要抗氧化酶,低温2℃、高温45℃下CAT 为主要的抗氧化酶,SOD、CAT 可作为温度变化下蝶豆的关键抗氧化指标。10℃开始蝶豆已有过氧化物产生,低温5℃下蝶豆细胞膜开始受损,蝶豆能够忍耐40℃高温,45℃下蝶豆的细胞膜被破坏。蝶豆通过调节可溶性糖、可溶性蛋白、Pro 等共同作用,降低或消除温度变化对自身的伤害,并增加光合色素含量来提高代谢能力。试验中,低温下SOD、MDA、细胞膜透性、可溶性糖含量、可溶性蛋白含量变化趋势表现出了较好的一致性;高温下CAT、POD、MDA、细胞膜透性、可溶性蛋白含量表现出了较好的一致性,试验结果较为可靠。

