糖尿病周围神经病变患者干眼的临床特征分析
刘 佳,高亚强
0引言
《中国干眼专家共识:定义和分类(2020年)》中将糖尿病列为干眼发生的系统性危险因素[1]。慢性高血糖、糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)、胰岛素水平下降、微血管病变、系统性高渗以及继发的炎症和免疫反应都会对糖尿病患者的干眼促发产生重要的影响。其中DPN是2型糖尿病(type 2 diabetes mellitus,T2DM)患者最常见的慢性并发症[2]。Tavakoli等[3]观察到DPN患者的角膜敏感度显著下降,并与糖尿病外周神经的损伤程度相关。Messmer等[4]和Ferdousi等[5]也支持这一发现,应用共聚焦显微镜观察角膜神经纤维长度、密度和神经丛密度的下降均与DPN的严重程度相关。国内外多项研究[6-7]已报道T2DM和干眼的联系,但对于DPN患者干眼的特点少有报告。本研究通过对T2DM周围神经病变合并泪膜异常患者的干眼症状评分、泪膜各项指标检查、睑板腺缺失面积进行分析,探索其临床特征,旨在为DPN患者的干眼早期干预提供参考,以期进一步优化T2DM干眼的诊断依据,达到早发现、早治疗的目的。
1对象和方法
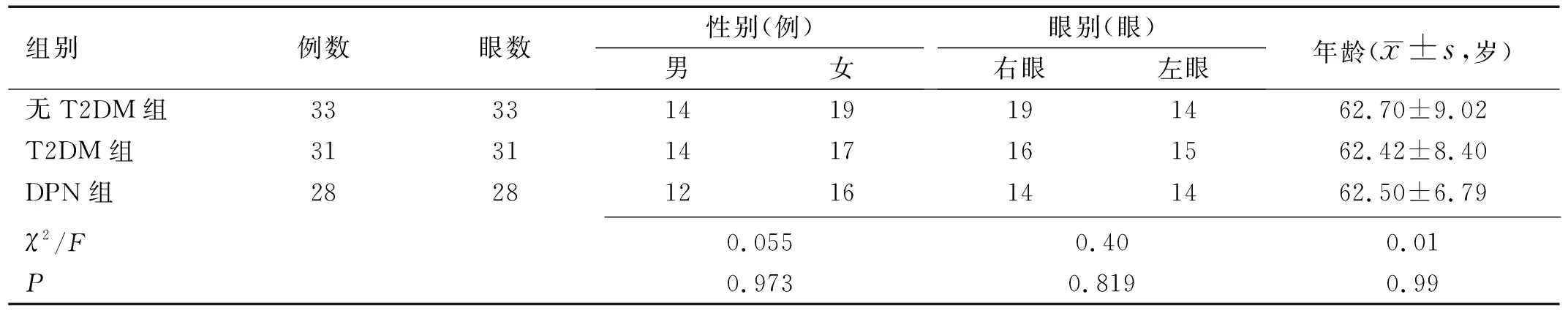
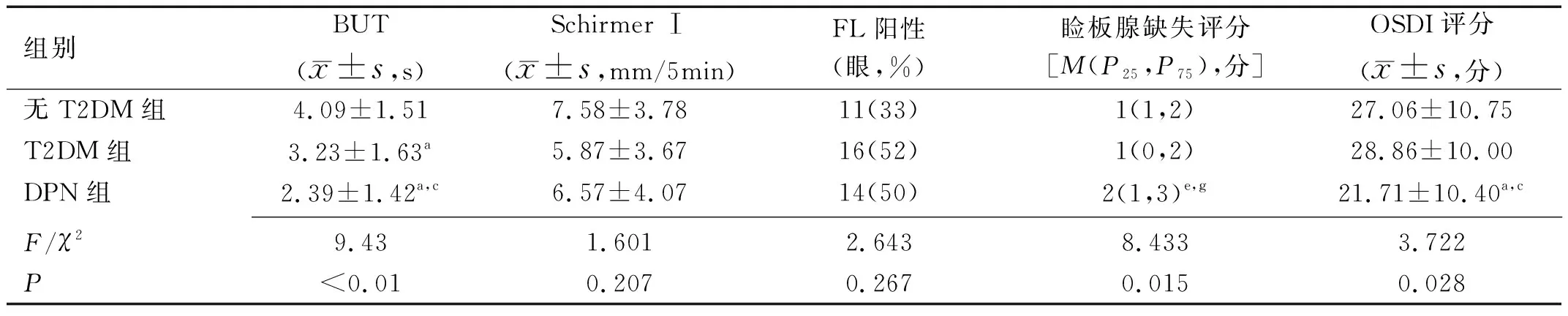
1.1对象病例对照研究。收集2020-11/2021-06入住于我院内分泌科且存在泪膜异常的T2DM患者59例59眼,以是否存在DPN分为T2DM组和DPN组,T2DM组31例31眼,男14例,女17例,平均年龄62.42±8.40岁;DPN组28例28眼,男12例,女16例,平均年龄62.50±6.79岁。两组患者血糖均控制平稳,规律应用口服药物或胰岛素控制血糖。并选取同期于眼科住院,符合泪膜异常标准且无糖尿病等全身病史及其他影响眼表状况的相关疾病者33例33眼作为无T2DM组,其中男14例,女19例,平均年龄62.70±9.02岁。纳入标准:(1)根据《中国干眼专家共识:检查和诊断(2020年)》[8]中泪膜异常的诊断标准为:1)荧光染色泪膜破裂时间(fluoresce in break up time, BUT)≤5s或泪液分泌试验(SchirmerⅠ)≤5mm/5min;2)5s 1.2方法所有入组者均完成以下检查,根据《中国干眼专家共识:检查和诊断(2020年)》[8]建议,检查顺序依次为:(1)眼表疾病指数(ocular surface disease index,OSDI)量表:指定过去1wk为回忆期,包括“眼部症状”“视觉功能”“环境触发因素”三个部分,共12项,每项根据频次评为0~4分,发生的频次越高得分越高,所有评分之和与答题数的比值乘以25即为最后分值[11];(2)睑缘及眼表裂隙灯检查;(3)BUT:常温避光室内环境下荧光素试纸条用抗生素滴眼液湿润,接触下眼睑睑缘,嘱患者瞬目3次后向前平视,记录末次瞬目至角膜出现首个黑斑的时间,重复测量3次取平均值;(4)角结膜荧光素钠染色(fluorescent, FL)评分:同上述BUT方法染色后1min,钴蓝滤光片下观察。≥5个点为染色阳性[8];(5)Schirmer Ⅰ试验:无表面麻醉,安静暗光环境下将试纸置入双眼下结膜囊的中外1/3,嘱患者轻轻闭眼,5min后测量试纸湿长;(6)红外线睑板腺照相:应用眼表综合分析仪通过红外摄像系统分别对上下眼睑结膜面进行拍摄,拍摄的照片自动经过Meibo-Scan增强对比模式处理,睑板腺表现为白色纹路,其余部分为灰色背景。根据睑板腺缺失面积评分:0分为睑板腺无缺失;1分为睑板腺缺失≤1/3;2分为睑板腺缺失>1/3且≤2/3;3分为睑板腺缺失>2/3[12]。 2.1各组一般情况的比较本研究共入选泪膜异常的患者92例92眼,各组间性别、眼别、年龄差异均无统计学意义(P>0.05),见表1。 表1 各组一般情况的比较 2.2各组泪膜指标的比较各组间BUT结果差异有统计学意义(F=9.43,P<0.01)。无T2DM组、T2DM组和DPN组两两比较差异均有统计学意义(P<0.05);各组间Schirmer Ⅰ及FL阳性率差异无统计学意义(P>0.05),见表2。 表2 各组临床指标的比较 2.3各组睑板腺缺失评分的比较各组间睑板腺缺失评分差异有统计学意义(χ2=8.433,P<0.05),两两比较,T2DM组与无T2DM组差异无统计学意义(P>0.0167),DPN组与无T2DM组、T2DM组差异均有统计学意义(P<0.0167),见表2。 2.4各组OSDI量表评分的比较各组间OSDI量表评分差异有统计学意义(F=3.722,P<0.05),两两比较,T2DM组与无T2DM组差异均无统计学意义(P>0.05),DPN组与无T2DM组、T2DM组差异均有统计学意义(P<0.05),见表2。 干眼是临床常见的一类眼表疾病,严重的影响人们的生活和视觉质量。近年来受老龄化、糖尿病、空气污染、使用视频终端等危险因素增高的影响,干眼在我国的发病率也随之逐年上升。我国现有流行病学研究显示,干眼在我国的发病率约21%~30%[13]。糖尿病作为干眼的系统性危险因素,患病率从1980年的0.67%飙升至2017年的11.2%[9]。一项长达10a针对2766例糖尿病患者的随访调查结果显示,半数以上糖尿病患者合并干眼[6]。 DPN是T2DM最常见的慢性并发症,发病率可达50%~80%[2]。关于DPN的发病机制尚未明确,目前认为是血管损伤、代谢紊乱、神经营养因子缺乏共同造成了神经纤维的脱髓鞘和变性,这种周围神经的改变也表现于角膜神经。Messmer等[4]应用共聚焦显微镜观测到糖尿病患者的角膜基底下神经纤维密度的降低和神经弯曲度的增加与DPN的严重程度相关。角膜作为泪腺功能单位(lacrimal function unit,LFU)的重要组成部分,角膜神经在维持LFU的完整性及角膜正常功能中起到了至关重要的作用,参与泪液分泌调节、调控脂质成分、角膜营养等多个过程,角膜神经的受损可在多个环节促进干眼的发生与发展[14]。Dogru等[15]观察到DPN患者的角膜敏感性均低于正常,并认为角膜神经的改变为DPN的末梢神经表现。同时他的研究也显示DPN患者的BUT和Schirmer Ⅰ较不伴有DPN的T2DM患者有统计学意义的减低,结膜鳞状上皮化生程度显著增高[15]。本研究的T2DM组、DPN组的BUT,与无T2DM组相比均出现降低,且DPN组的BUT均值较T2DM组进一步降低,差异有统计学意义,说明伴发T2DM的干眼患者泪膜稳定性更差,且随着糖尿病周围神经病变的发生而进一步加重。但Schirmer Ⅰ试验与FL阳性率在各组间未观察到统计学意义,与Dogru等[15]的结果不一致,是否与样本量有关仍需进一步验证。 目前国内外多项研究表明[6-7,16-18],T2DM合并干眼患者较普通干眼患者泪膜稳定性更差、角膜上皮缺损程度更高、睑板腺功能更差,本研究的T2DM组较无T2DM组的BUT降低也证实这一差异。但关于症状的严重程度多项研究的意见表现出不一致。部分研究[7,17]发现糖尿病相关干眼患者症状更重,相应的眼表症状评分也更高。而也有研究[16,19]认为糖尿病相关干眼患者虽然表现严重的眼表体征,症状评分却没有出现相应的上升,甚至下降。干眼的症状除受患者的耐受性、文化程度及外界环境等因素的影响外,还与角膜周围神经的知觉敏感性密切相关。OSDI量表是临床应用最广泛的干眼症状问卷,可以很好的评估症状发生的频率、环境触发因素和视觉相关的生活质量。本研究中虽然DPN组患者泪膜稳定性更差、睑板腺缺失更重,患者的OSDI量表评分不仅没有随着症状的加重而升高,反而出现下降,且与T2DM组、无T2DM组相比的差异均具有统计学意义。不伴有DPN的T2DM患者较无T2DM组OSDI量表评分仅轻度升高,差异无统计学意义。DeMIll等[19]的研究基于DPN严重程度分组,发现随着DPN严重程度增加,泪液渗透压升高,但OSDI评分却反而下降,与本研究结果相似。结合多项研究[3-5]显示DPN患者的角膜敏感性下降较不伴有DPN的2型糖尿病患者更明显,推测角膜敏感性的下降可能正是本研究中DPN患者OSDI量表评分不高反低的原因,但这一推测仍需进一步研究论证。 本研究存在不足之处:T2DM对干眼的影响是长期的、多因素的[20],需进一步扩大样本量,长期随访跟踪,取得更客观、更完整的临床资料,进一步探索血糖水平、DPN严重程度、药物影响等多方面对DPN患者干眼的影响。 本研究发现,虽然DPN患者的干眼严重程度高于T2DM患者及无T2DM组,但由于角膜敏感性的下降,部分DPN患者干眼的症状往往被掩盖,患者可能已患有严重的干眼但并没有眼干、眼涩等眼表不适的主诉。因此,对DPN患者不仅要注重糖尿病视网膜病变的筛查,对他们眼表的定期评估也同样重要。防止因患者缺如症状延误眼表疾病的治疗,使干眼进入恶性循环,发展为重症难治性干眼甚至角膜溃疡等眼表损伤。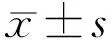
2结果
3讨论
- 国际眼科杂志的其它文章
- Assessment of macular vascular network after panretinal photocoagulation in the patients with diabetic retinopathy by OCTA
- Study on the sequence of morphological and angiographic changes due to intraocular pressure elevation in the optic nerve head
- 傅里叶域光学相干断层扫描仪测量角膜上皮厚度参数鉴别早期圆锥角膜
- 内质网应激在年龄相关性黄斑变性中的研究进展
- 加替沙星和左氧氟沙星对急性细菌性结膜炎有效性与安全性的Meta分析
- 地塞米松诱导的人小梁网基因表达谱变化及生物信息学分析

