酸奶弱后酸化菌株摇瓶增菌工艺及发酵罐扩培试验
赵丽娜,巩俊明,张 娜,李 晨,5,田洪涛,2,5*,王妙姝,康红艳,罗云波
(1 河北农业大学食品科技学院 河北保定 071001 2 国家北方山区农业工程技术研究中心 河北保定 071001 3 保定学院生物化工与环境工程学院 河北保定 071001 4 河北新希望天香乳业有限公司 河北保定 071001 5 河北省益生功能性乳制品技术创新中心 河北保定 071001 6 中国农业大学食品科技与营养工程学院 北京 100083)
近年来,随着乳酸菌与健康关系研究的深入,发酵食品越来越多的健康功能被揭示,发酵乳制品行业快速崛起,成为全球发展最快的高附加值行业之一[1-3]。随之,发酵乳制品的生产技术受到极大关注,而发酵剂制备是其核心技术之一。传统人工型液态发酵剂存在弊端,20世纪初,国外开始研究高效直投式发酵剂,至20世纪60年代后逐渐商品化。而我国在高效直投式发酵剂方面研究起步较晚,长期被国外企业垄断,主要依赖进口,价格异常昂贵[4-5]。高效直投式发酵剂在酸奶中应用时普遍存在后酸化的问题,原因是保加利亚乳杆菌是主要的产酸菌株,在长期高温发酵、低温贮存的过程中,菌株继续发酵产酸,进而导致发酵乳制品贮藏期质量不稳定,保质期缩短[6]。目前,国外研究出一些弱后酸化效果显著的菌株,然而均受专利保护。目前,我国主要在工艺水平上控制酸奶后酸化,不能从根本上解决问题。研制开发具有自主知识产权的弱后酸化高效直投式发酵剂,是解决酸奶后酸化问题的关键。
制备弱后酸化高效直投式发酵剂的关键技术主要包括:弱后酸化乳酸菌株的选育、廉价增菌培养基的筛选、细胞增菌培养;菌体细胞浓缩分离;高效保护剂筛选与干燥工艺;高效直投式发酵剂的贮藏稳定性等。本实验室研究人员前期对弱后酸化乳酸菌株进行选育,并对选育的菌株进行廉价增菌培养基的筛选。关于乳酸菌细胞增菌培养技术,考虑到乳酸菌生长繁殖速度较快,采用分批式培养,对培养设备要求简单,易于控制。为获得高浓度细胞培养物,采用分批补料式培养,主要有化学中和法、缓冲盐法、膜渗析法。化学中和法可获得高密度菌体,简便易行,是目前应用最广泛的一种方法,然而,当乳酸与碱液反应产生乳酸氨或乳酸钠等盐类物质达到一定浓度时,也会抑制菌体生长繁殖[7-8]。缓冲盐的缓冲作用有一定范围,发酵菌液不能达到很高的菌体浓度,高盐浓度会对乳酸菌菌体生长产生抑制作用[7]。膜渗析法是目前最先进的方法,培养效果最好,然而设备投资大,多次过滤耗能大,对超滤膜材料和操作要求较严格,同时在培养过程中易感染噬菌体,工业上应用并不广泛[4,7-9]。本实验室新选育的弱后酸化菌株生长特性是否发生改变? 该菌株究竟适宜采用何种培养方法?需要用产率和转化率指标来衡量,并通过试验探明。
针对以上问题,选用选育并优化组合的优良弱后酸化乳酸菌菌株及廉价胡萝卜汁复合增菌培养基,通过300 mL 三角瓶水平的摇瓶分批式培养,采用单因素和正交优化试验研究培养温度、培养方式、培养基起始pH 值、接种量对弱后酸化菌株生长的影响。通过50 L 发酵罐分批补料式扩大培养试验研究调节pH 值、流加葡萄糖补料以及既调节pH 值又流加葡萄糖补料对弱后酸化菌株生长的影响。通过优化后酸化乳酸菌的增殖培养条件,为高效直投式发酵剂产业化提供技术依据。
1 材料与方法
1.1 试验材料
1.1.1 试验菌种 弱后酸化保加利亚乳杆菌(Lactobacillus bulgaricus)Lb-s1 rp-1:本试验室(河北农业大学食品科技学院发酵工程试验室)前期自行选育。
1.1.2 原料 胡萝卜,购自本市大型超市,用于制作胡萝卜汁复合增菌培养基。
1.1.3 培养基
1) MRS 培养基[10]液体用于菌种的活化,固体用于活菌计数;
2) 胡萝卜汁复合增菌培养基 挑选新鲜、完好、大小适中的胡萝卜→洗净→切片(厚度2 mm)→煮沸 (料∶水=1∶1,100 ℃,10 min)→打浆(10 min)→过虑(100 目滤布,2 遍)→磨浆(胶体磨,10 min)→添加促生长物质(0.3%大豆蛋白胨、1.0%蛋白胨、0.5%酵母膏、0.5%碳酸钙)→调糖度 (2~3 Bix°)→调pH 值→灭菌(115 ℃,20 min)→冷却至37 ℃备用,用于摇瓶分批式培养试验和发酵罐分批补料式扩大培养试验。
1.1.4 主要仪器设备 YXQ-LS-18SI/22L 手提式湿热灭菌锅,上海东亚压力容器公司;SHP-250 型生化培养箱,上海精宏实验设备有限公司;JM-80F 型胶体磨,江苏丹徒县纪中电器五金厂;FOM-Z150-2 打浆机,镇江市丹徒区纪中电器厂;STARTER 2100 实验室pH 计,奥豪斯(OHAUS)仪器(上海)有限公司;50 L 全自动发酵罐,上海迪比尔生物工程有限公司;阿贝折光仪,上海欢奥科技有限公司;78-1 磁力加热搅拌器,金坛市杰瑞尔电器有限公司。
1.2 试验方法
1.2.1 实验室摇瓶分批式培养试验 首先通过单因素实验研究培养温度、培养方式、培养基起始pH 值、接种量对实验室摇瓶分批式培养菌种增菌的影响,然后对有交互作用的因素条件进行正交优化,最后在正交优化试验得到的最佳工艺条件下培养菌种进行验证试验。
1) 培养温度对菌种增菌的影响 弱后酸化保加利亚乳杆菌Lb-s1 rp-1 经MRS 液体培养基活化后,以体积分数0.6%(约3×106CFU/mL)接入灭菌的300 mL 三角瓶(装液量200 mL)、pH 值为6.5~7.0 的胡萝卜汁复合增菌培养基中,分别置于32,37,42 ℃恒温、静置培养12 h,定时取样检测活菌数,绘制生长曲线。
2) 培养方式对菌种增菌的影响 菌株活化后,以体积分数0.6%(约3×106CFU/mL)接种量分别接入灭菌的300 mL 三角瓶(装液量200 mL)和灭菌的250 mL 厌氧瓶 (即输液瓶,装液量200 mL,装液过程中通过Hungate 厌氧系统充氮除氧)、pH 值为6.5~7.0 的胡萝卜汁复合增菌培养基中,于37 ℃分别进行转速80 r/min 摇床培养(三角瓶)、静置培养(三角瓶)、厌氧培养(厌氧瓶)8 h,检测活菌数。
3) 培养基起始pH 值对菌种增菌的影响 用2 mol/L Na2CO3溶液经磁力搅拌器将胡萝卜汁复合增菌培养基pH 值分别调至5.5,6.0,6.5,7.0,7.5 梯度系列,分装300 mL 三角瓶(装液量均为200 mL),115 ℃灭菌20 min 冷却备用。菌株活化后,每株菌以体积分数0.6%(约3×106CFU/mL)接种量分别接入不同pH 值的三角瓶胡萝卜汁复合增菌培养基中,37 ℃静置培养8 h,检测活菌数。
4) 接种量对菌种增菌的影响 菌株活化后,分别以体积分数0.4%,0.6%,0.8%,1.0%,1.2%接入灭菌的300 mL 三角瓶(装液量200 mL)、pH 值为6.5 的胡萝卜汁复合增菌培养基中,37 ℃静置培养12 h,定时取样检测活菌数,绘制生长曲线。
5) 菌株摇瓶增菌工艺正交优化试验 考虑增菌因素之间存在交互协同作用,在单因素实验中选择培养温度、培养基起始pH 值、接种量为主要因素,利用L9(33)正交试验优化弱后酸化保加利亚乳杆菌Lb-s1 rp-1 菌株的摇瓶增菌工艺条件,因素水平见表1。

表1 Lb-s1 rp-1 摇瓶增菌工艺正交优化试验中各因素水平表Table 1 Factor level table of Lb-s1 rp-1 in orthogonal optimization experiment of shake flask enrichment process
6) 验证试验 根据菌株摇瓶增菌工艺正交优化试验得到的最佳增菌工艺条件培养弱后酸化保加利亚乳杆菌Lb-s1 rp-1,对正交试验结果进行验证。
1.2.2 50 L 发酵罐分批补料式扩大培养试验 根据实验室摇瓶分批式培养试验得到的最佳增菌工艺,利用胡萝卜汁复合增菌培养基对弱后酸化保加利亚乳杆菌Lb-s1 rp-1 进行50 L (30 L 培养基)全自动发酵罐扩大培养试验,以分批式扩大培养为对照,设置3 种补料方式:①用2 mol/L 的Na2CO3溶液调节培养基恒定pH 值为5.5;②在对数生长末期6 h 时补加1.5 mol/L 葡萄糖溶液使发酵罐中葡糖糖质量浓度保持20 g/L;③既用2 mol/L 的Na2CO3溶液调节培养基恒定pH 值为5.5,又在对数生长末期6 h 时补加1.5 mol/L 葡萄糖溶液。定时取样检测活菌数,绘制生长曲线。
1.3 检测方法
1.3.1 乳酸菌活菌计数 参照GB 4789.35-2016平板计数法[11],每个试验均重复3 次。
1.3.2 pH 值的测定 采用OHAUS Starter 2100 pH 计直接测定,每个试验均重复3 次。
1.4 试验数据统计分析方法
试验数据采用SPSS Statistics 17.0 进行方差分析及多重比较。
2 结果与分析
2.1 试验室摇瓶分批式培养试验
2.1.1 培养温度对菌种增菌的影响 温度是影响微生物生长繁殖的重要因素之一,通过影响蛋白质、核酸等生物大分子的结构和功能以及细胞结构来影响微生物的生长、繁殖和新陈代谢,不同微生物最适生长温度随着培养基成分、培养条件和菌体生长阶段变化而改变[9,12]。根据1.2.1(1)节的试验方法,探究不同培养温度对弱后酸化保加利亚乳杆菌Lb-s1 rp-1 生长的影响,结果见图1。
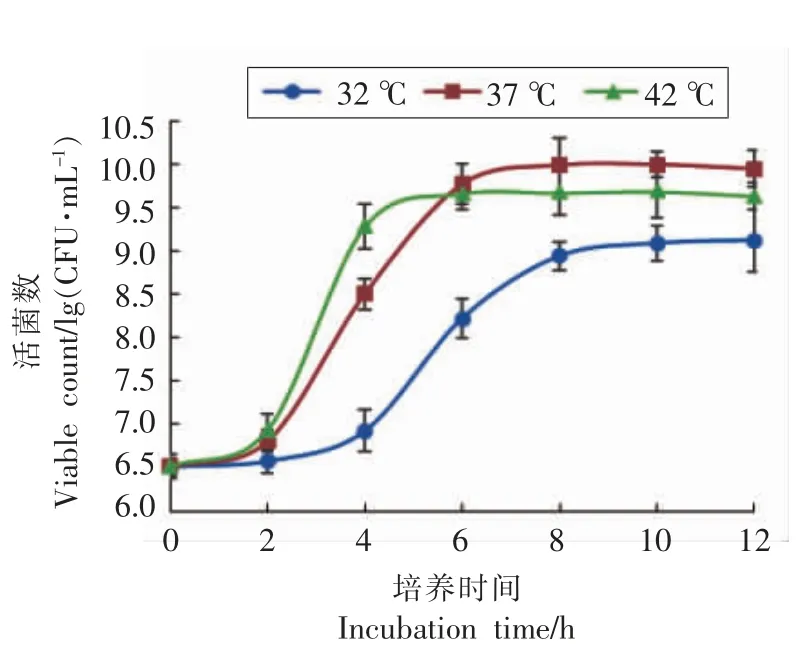
图1 Lb-s1 rp-1 在胡萝卜汁复合增菌培养基中不同温度培养生长曲线Fig.1 Growth curve of Lb-s1 rp-1 in carrot juice complex enrichment medium at different temperatures
图1可知,菌株在胡萝卜汁复合增菌培养基中,分别于32,37,42 ℃恒温静置培养,到达对数生长末期或稳定初期的培养时间分别为9,7,5 h,稳定期活菌数分别为1.33×109,9.98×109,4.89×109CFU/mL,37 ℃培养的活菌数显著高于32 ℃和42 ℃培养(P<0.05)。原因是在一定范围内,当温度升高时,细胞内的酶催化和化学反应速率都会加快,菌体生长也会加快,同时营养物和代谢物的溶解度提高,细胞膜流动性增大,有利于营养物质的吸收和代谢产物的排除。然而,当超过一定温度后继续升温,会使蛋白质和核酸等受到不可逆的损害,从而抑制菌体生长代谢,甚至导致死亡[13]。确定培养温度37 ℃作为下一步正交优化试验的主要因素与基准水平。
2.1.2 培养方式对菌种增菌的影响 供氧情况影响培养基的氧化还原电位值,可使乳酸菌的代谢途径发生改变,这对菌种的生长尤为重要[12]。因此,根据1.2.1(2)节的试验方法,采用不同的培养方式研究对弱后酸化保加利亚乳杆菌Lb-s1 rp-1生长的影响,结果见图2。
图2可知,菌株在胡萝卜汁复合增菌培养基中,37 ℃分别进行摇床培养(转速为80 r/min)、静置培养、厌氧培养8 h 后,活菌数分别为2.02×1010,1.93×1010,3.23×107CFU/mL,静置培养和厌氧培养的活菌数极显著高于摇床培养 (P<0.01),而且静置培养和厌氧培养的活菌数差异不显著(P>0.05)。结果表明,培养方式对弱后酸化保加利亚乳杆菌Lb-s1 rp-1 的生长影响很大,静置培养和厌氧培养优于摇床好氧培养。
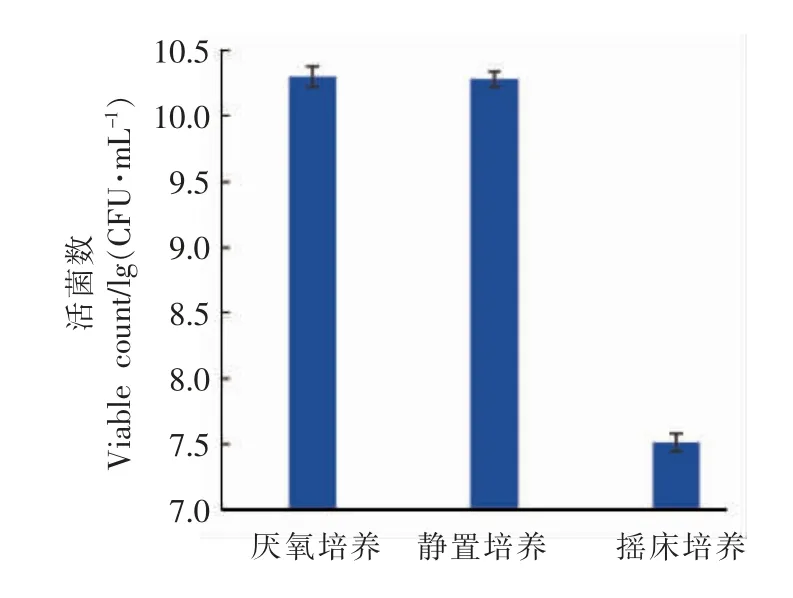
图2 Lb-s1 rp-1 在不同培养方式下稳定期的活菌数Fig.2 Number of Lb-s1 rp-1 viable bacteria in the stationary phase of different culture methods
本研究结果与古元懿[8]、蔡毅等[14]研究结果相符,这主要是由于保加利亚乳杆菌基因组中缺少超氧化物歧化酶,导致其在有氧条件下的生长较差,只有在发酵培养基中的氧含量较低的情况下,才能快速生长[15]。根据本试验结果,为简化工艺操作,节省能源,降低生产成本,减少设备投资,确定弱后酸化保加利亚乳杆菌Lb-s1 rp-1 采用静置培养方式。
2.1.3 培养基起始pH 值对菌种增菌的影响 培养基起始pH 值也是影响菌株活菌数量的关键因素之一,合适的起始pH 值能缩短菌株生长的延滞期,较快的进入对数生长期,不同菌株的最适生长pH 值范围也不同[16]。因此,根据1.2.1(3)节的试验方法,研究培养基不同起始pH 值对弱后酸化保加利亚乳杆菌Lb-s1 rp-1 生长的影响,结果见图3。
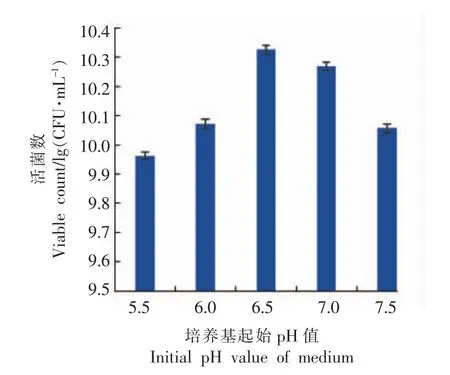
图3 Lb-s1 rp-1 在不同起始pH 值培养基中稳定期的活菌数Fig.3 Number of Lb-s1 rp-1 viable bacteria in stationary phase at different initial pH media
图3可知,菌株在起始pH 值为5.5,6.0,6.5,7.0,7.5 的胡萝卜汁复合增菌培养基中,37 ℃摇床培养8 h 后,活菌数分别为9.17×109,1.18×1010,2.12×1010,1.86×1010,1.14×1010CFU/mL,在起始pH值为5.5~7.5 的范围内,活菌数随着pH 值的增大先升高后降低,pH 值为6.5 时,活菌数最高,显著高于其它起始pH 值(P<0.05)。可能由于pH 值从多方面影响着微生物的生命活动,不仅影响胞内、外酶的生物活性,还影响微生物对营养物质的吸收,以及改变培养基中化合物离子化程度,从而促进或抑制菌株的生长繁殖。因此,确定培养基起始pH 值为6.5 作为下一步正交优化试验的主要因素与基准水平。
2.1.4 接种量对菌种增菌的影响 不同的接种量对菌体活性影响不同,从而影响菌体适应能力和生长速率[13]。因此,根据1.2.1(4)节的试验方法,研究不同接种量对弱后酸化保加利亚乳杆菌Lb-s1 rp-1 生长的影响,结果见图4。
由图4可知,菌株分别以0.4%,0.6%,0.8%,1.0%,1.2%的接种量在胡萝卜汁复合增菌培养基中37 ℃静置培养,通过检测活菌数,到达对数生长末期的培养时间分别为10,9,7,6,5 h;稳定期活菌数分别达到2.09×1010,2.13×1010,2.18×1010,2.28×1010,2.20×1010CFU/mL。结果表明,接种量对菌种到达对数生长末期的时间有显著影响(P<0.05),对稳定期的活菌数无显著影响(P>0.05)。接种量较低会延长菌体的延滞期,接种量较高菌体会较快进入对数生长期,进而较快进入菌体稳定期,在稳定期菌体容易发生自溶现象[16]。因此,选择1.0%的接种量作为下一步正交优化试验的主要因素与基准水平。
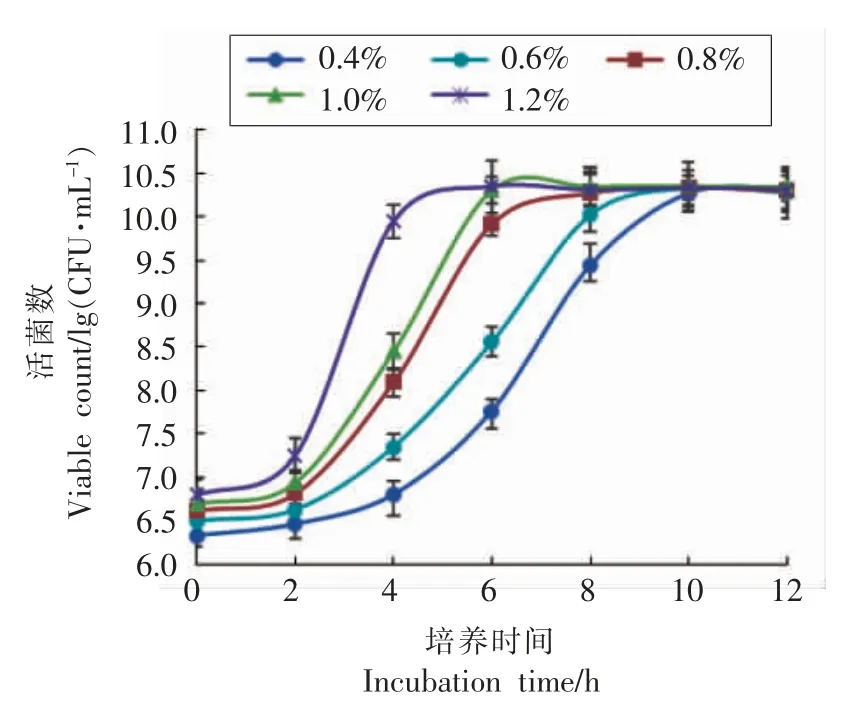
图4 Lb-s1 rp-1 在胡萝卜汁复合增菌培养基中不同接菌量培养生长曲线Fig.4 Growth curve of Lb-s1 rp-1 in carrot juice complex enriched medium with different inoculation amount
2.1.5 菌株摇瓶增菌工艺正交优化试验 根据1.2.1(5)节的试验方法进行弱后酸化保加利亚乳杆菌Lb-s1 rp-1 摇瓶增菌工艺正交优化试验,结果见表2。

表2 Lb-s1 rp-1 摇瓶增菌工艺正交优化试验结果Table 2 Orthogonal optimization test results of Lb-s1 rp-1 in shake flask enrichment process
表2表明,三因素对菌株的影响顺序为:培养温度(A)>接菌量(C)>起始pH 值(B),通过对活菌数极差分析得到菌株的最佳增菌培养条件为:A2B2C3,即培养温度37 ℃、起始pH 值6.5、接菌量1.0%。
2.1.6 验证试验 根据1.2.1(6)节的试验方法对弱后酸化保加利亚乳杆菌Lb-s1 rp-1 摇瓶增菌工艺条件正交优化试验结果进行验证试验,结果见图5。
本实验室前期研究结果[17]:未经过弱后酸化选育的保加利亚乳杆菌Lb-s1 在番茄复合汁增菌培养基中,37 ℃恒温培养18 h,活菌数达到2.25×1010CFU/mL。与本研究结果图5所示:保加利亚乳杆菌Lb-s1 rp-1 在最佳增菌培养条件下,6 h 到达对数生长末期,稳定期活菌数为2.28×1010CFU/mL。对比表明:经过弱后酸化选育后,稳定期活菌数无显著性差异(P>0.05),到达对数末期的时间极显著缩短(P<0.01)。
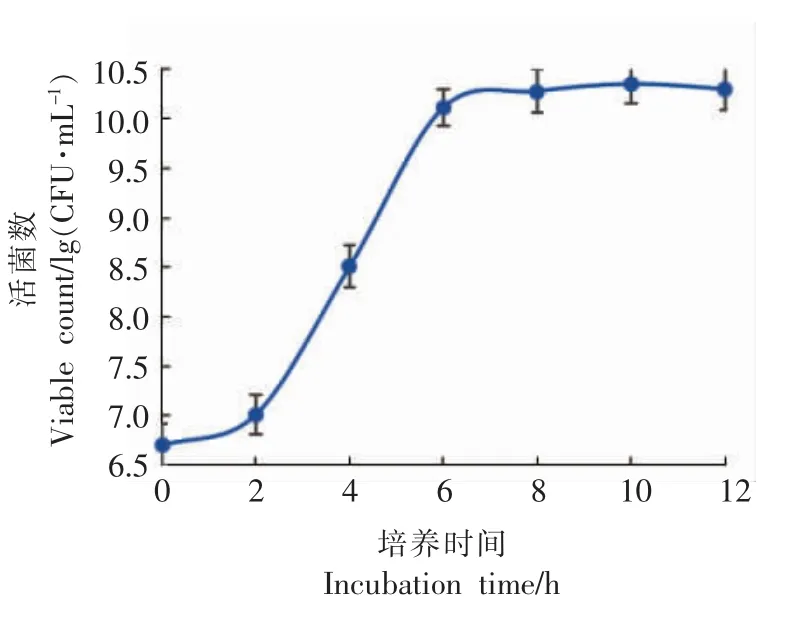
图5 Lb-s1 rp-1 在最佳增菌培养条件下生长曲线Fig.5 Growth curve of Lb-s1 rp-1 under optimal culture conditions
进一步证明保加利亚乳杆菌Lb-s1 经过弱后酸化选育之后,其细胞生长特性大大提高,细胞生长量未发生显著改变。因此,优化的摇瓶分批式培养工艺是可行的,可为下一步研究50 L 全自动发酵罐分批补料式扩大培养工艺奠定基础。
综上所述,弱后酸化保加利亚乳杆菌Lb-s1 rp-1 实验室摇瓶分批式培养最佳增菌工艺条件为:培养温度37 ℃、培养基起始pH 值6.5、接菌量1.0%、静置培养,在此工艺条件下培养该菌株,6 h到达对数生长末期,稳定期活菌数为2.28×1010CFU/mL。
2.2 50 L 发酵罐分批补料式扩大培养试验
根据1.2.2 节的试验方法对弱后酸化保加利亚乳杆菌Lb-s1 rp-1 进行50 L 发酵罐分批补料式扩大培养优选试验,结果如图6所示。
图6可知,按照摇瓶分批式培养试验得到的最佳增菌工艺将弱后酸化保加利亚乳杆菌Lb-s1 rp-1 在50 L 发酵罐中分批式扩大培养,6 h 到达对数生长末期,活菌数为2.35×1010CFU/mL。通过3 种补料方式,即调节pH 值、补料、调节pH 值与补料,到达对数生长末期的时间分别是8,6,8 h,稳定期活菌数分别是2.29×1010,2.39×1010,2.48×1010CFU/mL。表明:调节pH 值可以显著延长该菌株对数生长期(P<0.05),补料对该菌略有增菌作用,然而,经过生物统计分析,3 种补料方式对菌株稳定期活菌数均无显著影响(P>0.05)。原因可能是该菌株6 h 即可到达对数生长末期,属于生长较快的微生物,培养基的营养物质也快速被消耗掉,单纯补充葡萄糖单一碳源,无法满足菌株继续快速生长的营养需求。因此,综合考虑菌株培养成本、设备要求、操作简便程度以及产率,采用50 L 发酵罐分批式扩大培养弱后酸化保加利亚乳杆菌Lb-s1 rp-1 的工艺是可行的,同时也为下一步产业化菌体培养工艺提供了依据。
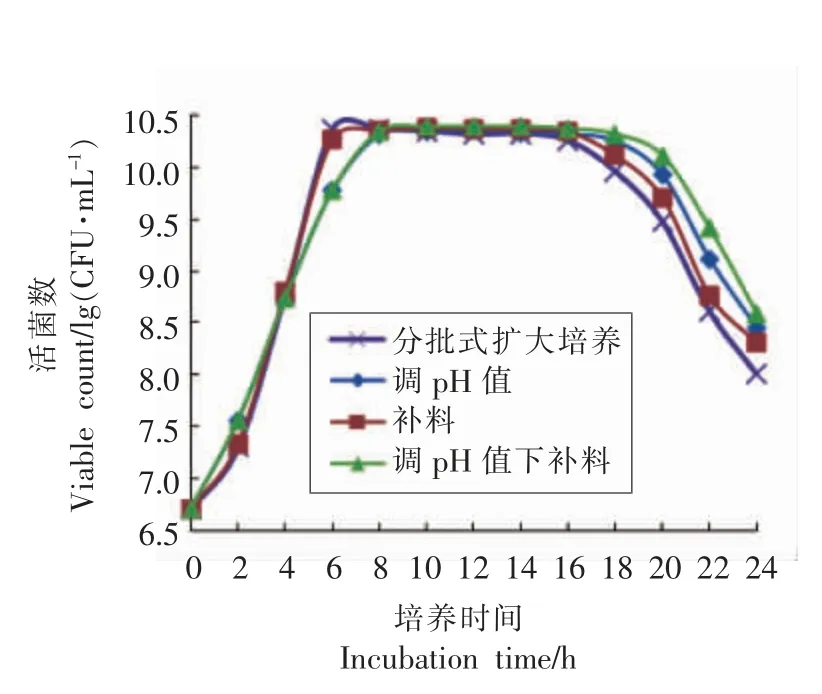
图6 Lb-s1 rp-1 在50 L 发酵罐中不同方式下生长曲线Fig.6 Growth curve of Lb-s1 rp-1 under different methods in 50 L fermenter
3 讨论与结论
目前国内外弱后酸化保加利亚乳杆菌的选育技术主要有诱变育种、原生质体融合、基因工程技术。传统的诱变育种虽然存在工作量大、耗时长等问题,然而选育的弱后酸化菌株安全性有保证,而且没有原生质体融合技术的弊端[18]。本实验室前期通过硫酸新霉素诱变育种法筛选得到弱后酸化保加利亚乳杆菌Lb-s1 rp-1,该菌株传至第8 代仍具有弱后酸化性能,具有遗传稳定性。培养基为乳酸菌提供菌体生长、繁殖、代谢所需要的碳源、氮源、无机盐和生长因子,试验室所用的MRS 培养基成本较高,成分较多,配制繁琐,并不适用于工业生产,筛选廉价增殖培养基是降低成本的关键环节。本实验室从2000年初就开始了对乳酸菌廉价增殖培养基的研究,已经针对不同菌株研制出菊芋汁[19]、番茄汁[17]、麦芽汁[20]、冬瓜汁[21]等复合增菌培养基,目前,本实验室的这项技术已非常成熟。然而,国内还没有关于弱后酸化保加利亚乳杆菌廉价增殖培养基的研究报道,本实验室对弱后酸化保加利亚乳杆菌Lb-s1 rp-1 进行了的廉价增菌培养基的筛选工作,得出胡萝卜汁复合增菌培养基为最佳增殖培养基。
庞启亮等[22]研究的可以延缓后酸化的保加利亚乳杆菌H+-ATPase 缺陷型菌株在筛选的最适宜增殖培养基上,活菌数为1.44×109CFU/mL;姜庆玲等[23]对德氏乳杆菌保加利亚亚种的培养基及培养条件进行了优化,经优化后活菌数达6.07×109CFU/mL;程艳宇等[24]研究得出保加利亚乳杆菌LB在增殖培养基中,活菌数可达1.09×109CFU/mL。本研究得出弱后酸化保加利亚乳杆菌Lb-s1 rp-1实验室摇瓶分批式培养,最高活菌数达2.28×1010CFU/mL,远高于现有报道结果。与弱后酸化选育前相比,菌株稳定期活菌数无显著差异(P>0.05),说明保加利亚乳杆菌Lb-s1 经过弱后酸化选育之后,细胞生长量未发生显著改变,因此,本文优化的摇瓶分批式培养工艺是可行的,可为下一步研究50 L 全自动发酵罐分批补料式扩大培养工艺奠定基础。
由于摇瓶培养与发酵罐培养的环境条件有很大不同,因此不能直接使用摇瓶培养工艺进行发酵罐培养,需要在摇瓶培养工艺的基础上进一步考察适宜发酵罐培养的条件。康婕等[25]研究得出保加利亚乳杆菌在5 L 发酵罐中扩大培养的活菌数最大达到5.5×108CFU/mL;刘洋[26]对保加利亚乳杆菌进行1 L 的放大培养试验,结果显示,活菌数最高可达1.8×109CFU/mL;李佳[27]在5 L 全自动发酵罐中对保加利亚乳杆菌LB5 的高密度培养条件进行了优化,优化后活菌数达到2.7×109CFU/mL;本研究对弱后酸化保加利亚乳杆菌Lb-s1 rp-1在50 L 发酵罐分批补料式扩大培养试验中,得到的活菌数达1010CFU/mL,远高于已报道的研究结果。综合考虑菌株培养成本、设备要求、操作简便程度以及产率,采用50 L 发酵罐分批式扩大培养弱后酸化保加利亚乳杆菌Lb-s1 rp-1 的工艺是可行的,可为弱后酸化保加利亚乳杆菌高效直投式发酵剂产业化提供菌体增殖培养技术。
综上所述,本文对自行选育的弱后酸化保加利亚乳杆菌Lb-s1 rp-1 在优化的胡萝卜汁复合增菌培养基上,进行实验室摇瓶分批式培养优选试验、50 L 发酵罐分批补料式扩大培养优选试验,在最佳的培养方式下得到较高的活菌数,为工业化生产弱后酸化保加利亚乳杆菌高效直投式酸奶发酵剂中提供细胞廉价增殖培养技术,也为研究其它弱后酸化益生乳酸菌的细胞培养技术提供参考借鉴。

