TgAb、Tg、TSH水平对临床鉴别诊断良恶性甲状腺结节的价值
谢美华 黄河 李肇暖
甲状腺结节是甲状腺细胞异常增生后在甲状腺组织中出现的团块,可分为甲状腺良性结节与恶性结节两种[1]。流行病学调查结果表明[2],甲状腺结节能发生在任何年龄段人群中,超声检查发现甲状腺结节发生率20.0%~76.0%,患者发病多与缺碘、退行性变、遗传及甲状腺炎症等有关。多数情况下甲状腺结节无任何症状,且患者甲状腺功能正常,仅部分患者表现为颈部疼痛、咽喉部异物感或压迫感等,增加临床诊疗及鉴别难度[3]。刘丽华[4]研究表明,甲状腺癌生物学特征多变、起病隐匿,仅以细胞、影像检查并不能完全的确定。血清抗甲状腺球蛋白抗体(thyroglobulin antibody,TgAb)是较为重要的抗甲状腺自身抗体,其靶抗原甲状球蛋白(thyroglobulin,Tg)是甲状腺滤泡上皮细胞合成和分泌的一种大分子糖蛋白,为合成甲状腺激素的重要前体蛋白[5];而促甲状腺激素(thyroid-stimulating hormone,TSH)为腺垂体分泌的促甲状腺生长和代谢机能的激素,表达水平常与甲状腺癌患者预后、复发等有关[6]。本研究以甲状腺结节患者为研究对象,探讨TgAb、Tg及TSH指标对良恶性甲状腺结节鉴别诊断价值,现报道如下。
1 资料与方法
1.1 一般资料
选择三明市第二医院2021年1月—2022年1月甲状腺结节患者97例为研究对象,根据病理组织检查结果分为良性组和恶性组。良性组76例,男性23例,女性53例,年龄32~75岁,平均(50.39±6.41)岁;身体质量指数(body mass index,BMI)18~29 kg/m2,平均(22.15±3.26)kg/m2;疾病类型:甲状腺肿21例,腺瘤伴结节性甲状腺肿39例,甲状腺腺瘤16例。恶性组21例,男性7例,女14例,年龄33~74岁,平均(50.43±6.41)岁;BMI 19~30 kg/m2,平均(22.42±3.31)kg/m2。疾病类型:髓样癌5例,滤泡状癌12例,乳头状癌4例。两组患者的一般资料相比,差异无统计学意义(P>0.05),具有可比性。本研究获得医院伦理委员会批准。
1.2 纳入及排除标准
纳入标准:(1)符合甲状腺结节诊断标准,并经病理检查确诊。(2)能配合完成血液标本采集及相关指标检测。(3)病情稳定,能进行沟通与交流。(4)未行放、化疗、免疫及手术治疗。
排除标准:(1)其他部位肿瘤。(2)自身免疫疾病。(3)血液疾病、肝肾功能异常。(4)中途放弃诊疗或中转上一级医院者。
1.3 方法
(1)血液标本采集。抽取空腹静脉血3 mL,待血液凝固后离心10 min(离心机购自安徽中科中佳科学仪器有限公司,型号:KDC-1044),离心速度为4500 rpm。
(2)检测方法。取上述分离后的血液标本,采用电化学发光法(全自动电化学发光免疫分析仪,型号:罗氏Cobas e601,德国罗氏诊断公司)测定两组血清TgAb及Tg水平,采用化学发光法检测两组血清TSH水平(全自动化学发光免疫分析仪,型号:贝克曼COULTER DXI800,贝克曼库尔特美国股份有限公司);比较两组TgAb、Tg、TSH测定水平;TgAb参考值范围:0~115 IU/mL,Tg参考值范围:3.5~77 ng/mL;TSH参考值范围:0.34~5.91μIU/mL;以测定值超过参考值范围上限为阳性,对TgAb、Tg及二者联合阳性率进行比较,上述所有操作严格遵循仪器、试剂盒说明书完成。
(3)诊断鉴别效能。绘制受试者工作特征曲线( receiver operating characteristic curve,ROC曲线),分析TgAb、Tg、TSH及三者联合检测在良恶性甲状腺结节中的鉴别效能(灵敏度与特异度)。
1.4 观察指标
比较TgAb、Tg、TSH水平与TgAb、Tg及联合阳性率;绘制ROC曲线,分析TgAb、Tg、TSH及联合检测在良恶性甲状腺结节中的鉴别效能。
1.5 统计学方法
采用SPSS 24.0进行数据处理和统计分析,计量资料中符合正态分布的数据以(±s)表示,组间比较采用t检验;计数资料以n(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 TgAb、Tg及TSH水平比较
恶性组TgAb、Tg及TSH水平均高于良性组(P<0.05)。见表1。
表1 两组TgAb、Tg及TSH水平比较 (±s)

表1 两组TgAb、Tg及TSH水平比较 (±s)
2.2 两组TgAb、Tg及二者联合阳性率比较
恶性组TgAb、Tg、TgAb+Tg阳性率高于良性组(P<0.05)。见表2。
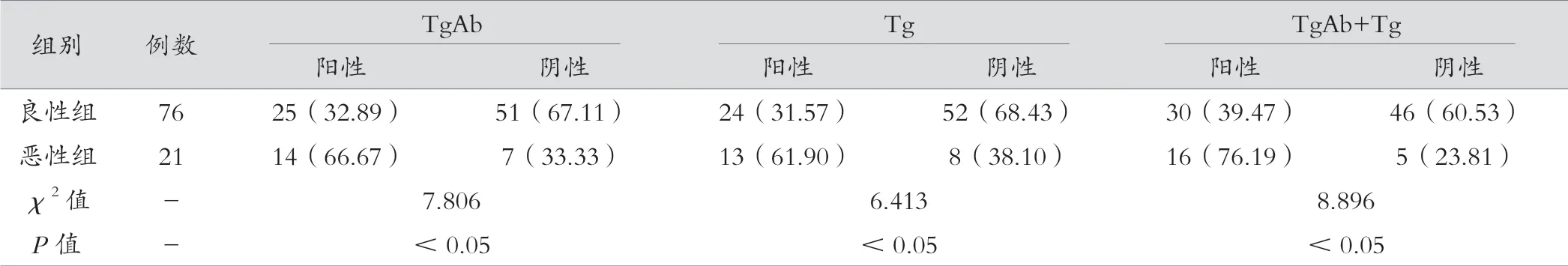
表2 两组TgAb、Tg及二者联合阳性率比较[例(%)]
2.3 TgAb、Tg及TSH在良恶性甲状腺结节中的鉴别效能
ROC曲线结果表明,TgAb、Tg及TSH联合检测在良恶性甲状腺结节中灵敏度、特异度高于单一TgAb、Tg及TSH指标。TgAb+Tg+TSH联合检测的ROC曲线下与坐标轴围成的面积(area under curve,AUC)值最大,后依次为TgAb+Tg、TgAb、Tg、TSH。见表3和图1。
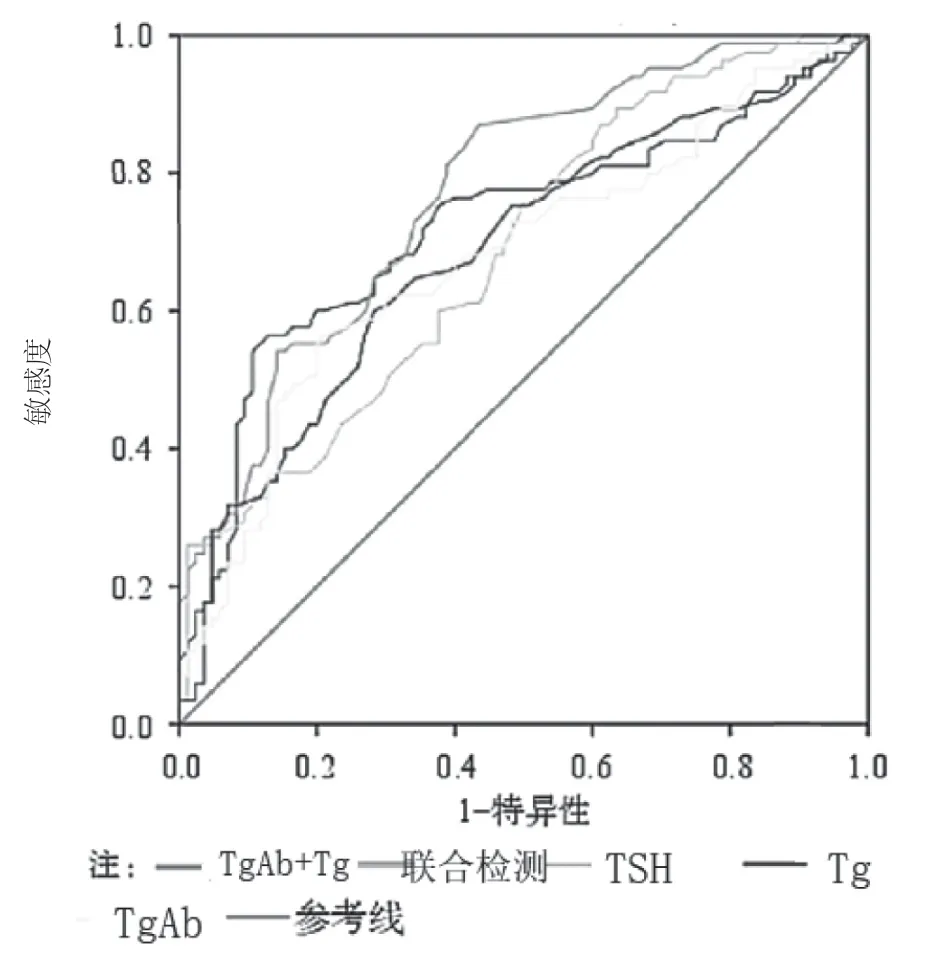
图1 TgAb、Tg、TSH及联合检测在良恶性甲状腺结节中鉴别诊断ROC曲线
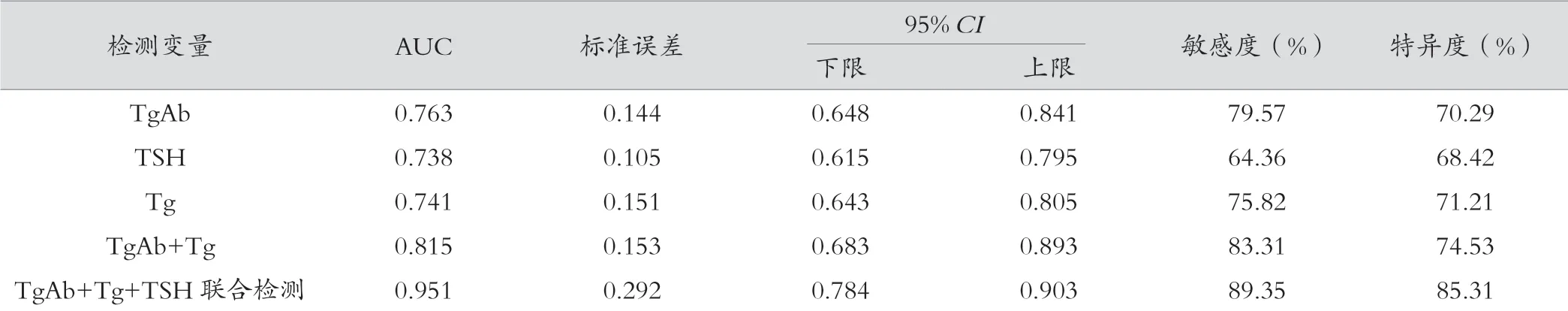
表3 TgAb、Tg及TSH在良恶性甲状腺结节中的鉴别效能
3 讨论
甲状腺癌是临床上发生率较高的恶性肿瘤,患者起病隐匿、病理进程较慢,且不同类型甲状腺癌恶性程度、生物学特征存在差异,导致临床对于良恶性甲状腺结节的鉴别诊断难度较大[7]。病理组织检查是目前诊断良恶性甲状腺结节的“金标准”,能确诊及分期;但考虑到由于该项的检查具有一定的创伤性,且该方法可重复性不佳,对患者耐受性与依从性产生影响,也不适用于甲状腺结节定期监测及疗效观察。而采集静脉血检测相关甲状腺激素及甲状腺自身抗体等则可补充上述不足。因此,对甲状腺结节患者血液相关指标进行检测,在临床上获得更为准确的辅助诊断,更有重要的作用[8]。
Tg是一种大分子糖蛋白,在人体中主要由甲状腺滤泡上皮细胞合成及分泌,甲状腺手术患者,通过加强血清Tg水平监测,能评估患者治疗效果及预后。对于正常人而言,Tg表达水平相对较低或在人体中处于动态平衡状态。但是对于甲状腺结节患者,尤其是恶性甲状腺结节患者,随着病灶组织的不断生长,将会直接损伤甲状腺的正常组织解剖结构与功能[9]。同时,恶性甲状腺结节生长过程中可诱导炎症反应,加快甲状腺组织的坏死,激活甲状腺上皮细胞,并在最终释放出大量的Tg,导致血清中Tg水平升高[10]。本研究中,97例甲状腺结节患者经病理组织检查确诊良性结节76例,占78.35%;确诊恶性结节21例,占21.65%。恶性组TgAb、Tg及TSH水平均高于良性组(P<0.05)。本研究结果可见,TgAb、Tg及TSH水平在恶性甲状腺结节中表达异常,能为临床诊疗提供一定的参考依据。TgAb是自身免疫性甲状腺疾病患者血清中常见的自身抗体之一,而Tg是TgAb的靶抗原。有研究表明,Tg与TgAb相互结合后,通过细胞膜表面能与IgFc片段结合,Fc受体(the Fc receptor )与结合的抗体相互作用,可激活自然杀伤细胞(natural killer cell,NK),直接攻击和杀伤靶细胞,从而使甲状腺细胞受到破坏,导致甲状腺功能异常,进而诱发各种甲状腺疾病[11]。马磊等[12]研究表明,TgAb表达水平与甲状腺组织的损伤存在紧密的联系,能在一定程度上确定患者是否患有甲状腺疾病。本研究中,恶性组TgAb、Tg、TgAb+Tg阳性率高于良性组(P<0.05)。研究结果可见,TgAb及TgAb+Tg在恶性甲状腺结节患者中阳性率较高。由于TgAb是自身免疫性甲状腺疾病患者常见的自身抗体,主要源于甲状腺内淋巴细胞,多为IgG型,TgAb的产生有赖于自身抗原Tg的持续存在,同时具有较高水平的TgAb,将会对血清Tg检测结果产生影响,可能导致Tg假阴性结果,使得Tg单项指标并不能作为良恶性结节的鉴别指标,更常作为恶性结节术后患者随访监测肿瘤复发的辅助指标。因此,预测良恶性甲状腺结节并对患者进行鉴别诊断时,TgAb、TgAb+Tg检测价值更高。而TSH属于人体腺垂体分泌的一种激素,能刺激上皮细胞活性,亦可控制、调节甲状腺功能作用,是临床上甲状腺疾病诊断的重要指标。杨坤等[13]研究表明,TSH在人体中能与TSH相关受体相互结合,刺激腺苷酸环化酶生物学活性,可引起环磷酸腺苷水平升高,增加甲状腺癌的发生。因此,对于恶性甲状腺结节患者,将会引起体内TSH水平持续升高,其水平能预测复发率、病死率,为临床治疗方案的拟定提供参考依据。本研究中,ROC曲线表明,TgAb、Tg及TSH联合检测用于良恶性甲状腺结节患者中的鉴别诊断灵敏度、特异度高于单一TgAb、Tg及TSH指标,TgAb+Tg+TSH联合检测的AUC值最大,后依次为TgAb+Tg、TgAb、Tg、TSH,从本研究结果看出,TgAb、Tg及TSH联合检测能提高良恶性甲状腺结节患者的诊断鉴别效能,有助于对恶性甲状腺结节的临床早期诊断。因此,临床上对于疑似恶性甲状腺结节患者,应加强患者TgAb、Tg及TSH水平测定,发挥多项检测指标的联合作用,必要时行病理组织检查,帮助其早期确诊,指导患者后续治疗。
综上所述,TgAb、Tg及TSH在恶性甲状腺结节中表达异常,且甲状腺恶性结节患者常伴有TgAb联合Tg阳性率升高,三者联合检测能获得较高的鉴别诊断效能,可为临床诊疗提供一定的参考依据。由于纳入的恶性甲状腺结节病例数量较少、疾病类型不足,本研究可能有局限性,由此为了获得更为符合实际的结果下,还需扩大数量及类型,增加随访,进一步论证TgAb、Tg及TSH检测对良恶性甲状腺结节的临床鉴别诊断价值。

