常山碱盐斑马鱼胃肠道毒性及其评价*
李思迪,叶祖光,曾星铫,周明高,谭晓文,范泰平,谭欣欣,盛益华
(1.吉首大学药学院,湖南 吉首 416000;2.中国中医科学院中药研究所,北京 100700;3.湘西自治州民族中医院,湖南 吉首 416000;4.吉首大学医学院,湖南 吉首 416000)
目前疟疾在全球尤其是一些不发达地区流行形势依然十分严峻,急需研发抗疟新药和探索新的药物治疗方案.常山是我国中医药宝库中经典的抗疟药物,其抗疟疗效卓著.常山为虎耳草科植物黄常山(RadixDichroae)的干燥根[1].中医认为,常山苦、辛、寒,归肝、脾、心经,常用于寒热往来、日疟、间日疟、新久疟疾、老痰积饮等症[2].现代研究证实,常山具有抗阿米巴原虫、抗钩端螺旋体、抗病毒、抗肿瘤、抗心律失常、降压、催吐以及兴奋子宫平滑肌等作用,临床上主要用于治疗疟疾、鸡球虫、蓝氏贾第鞭毛虫病等疾病.常山是中医重要的抗疟中药之一,在明、清以前大多数中药抗疟方剂均以常山为主药,但由于常山具有强烈的致呕吐副作用,在明、清时期,人们建立了以小柴胡汤为主的“和法”来治疗疟疾,以期代替以常山为主的“峻烈”的抗疟中药方剂.虽然小柴胡汤减少了毒副作用,但其抗疟疗效明显不如常山.现代化学研究表明,常山具有良好的抗疟疾活性[3],其主要的活性成分是常山碱和异常山碱,其中常山碱的活性比奎宁高100倍.Kobayashi等研究发现常山碱、异常山碱抗恶性疟原虫的EC50值分别为2.0×10-7,1.6×10-7mol/L;抗疟原虫的EC50分别为7.6×10-11,2.9×10-10mol/L.常山碱、异常山碱及衍生物体外抗两种恶性疟原虫活性(FCR-3和K1)均比对照药品氯喹和青蒿素好,其中常山碱的EC50分别为7.0×10-10(FCR-3),1.2×10-9(K1)mol/L,异常山碱的EC50值分别为3.4×10-9(FCR-3),1.8×10-9(K1)mol/L,而氯喹的EC50分别为1.8×10-9(FCR-3),1.3×10-7(K1)mol/L[4-5].常山抗疟疗效显著,但具有强烈的致呕吐副作用[6],在《中华人民共和国药典》(2005年版一部)中被列为有毒药材.目前有关常山致呕吐毒性机制研究较为匮乏,这限制了常山药物的发展.
因此有必要利用能快速评价并筛选常山减毒增效目的药物品种及剂量的斑马鱼作为模式动物,本研究通过系统分析常山主要活性成分对消化道的毒性作用,明确常山主要活性成分的毒性剂量特点、消化道蠕动影响、消化道毒性表型以及组织病理特征,为常山消化道毒性方面的探索提供新的可靠的模式动物、药物筛选及机制研究的思路,以期克服其毒副作用.
1 材料与方法
1.1 实验动物
以自然成对交配方式繁殖的AB系斑马鱼共660尾,其中180尾用于10%致死浓度(LC10)和最大非致死浓度(MNLC)测定实验,180尾用于肠蠕动抑制作用评价实验,150尾用于肠道毒性表型观察实验,150尾用于肠道病理组织学检查实验.每个实验每个浓度组为30尾,年龄为受精后5天(5 dpf).AB系斑马鱼饲养于28 ℃的养鱼用水中(水质:每1 L反渗透水中加入200 mg速溶海盐,电导率为480~510 μS/cm,pH值为6.9~7.2,硬度为53.7~71.6 mg/L CaCO3).实验动物使用许可证号为:SYXK(浙)2012-0171.饲养管理符合国际AAALAC认证的要求.
1.2 实验药物
常山碱盐,白色粉末,纯度为98%,由中国中医科学院中药研究所提供,置于4 ℃干燥器内保存.使用时现配现用,溶剂为超纯水.
1.3 仪器与试剂
解剖显微镜(Szx7,Olympus,Japan);与显微镜相连的相机(TK-C1481EC);精密电子天平(CP214,Ohaus,America);六孔板(Nest Biotech,Shanghai,China);甲基纤维素(Aladdin,Shanghai,China).
1.4 实验分组
(1)LC10和MNLC测定实验
实验1组:正常对照组
实验2组:常山碱盐2.5 mg/L
实验3组:常山碱盐5 mg/L
实验4组:常山碱盐10 mg/L
实验5组:常山碱盐20 mg/L
实验6组:常山碱盐40 mg/L
(2)肠蠕动抑制作用评价实验
实验1组:正常对照组
实验2组:模型对照组
实验3组:常山碱盐0.5 mg/L(1/10 MNLC)
实验4组:常山碱盐1.67 mg/L(1/3 MNLC)
实验5组:常山碱盐5 mg/L(MNLC)
实验6组:常山碱盐10 mg/L(LC10)
(3)肠道毒性表型观察实验
实验1组:正常对照组
实验2组:常山碱盐0.5 mg/L(1/10 MNLC)
实验3组:常山碱盐1.67 mg/L(1/3 MNLC)
实验4组:常山碱盐5 mg/L(MNLC)
实验5组:常山碱盐10 mg/L(LC10)
(4)肠道组织病理学检查实验
实验1组:正常对照组
实验2组:常山碱盐0.5 mg/L(1/10 MNLC)
实验3组:常山碱盐1.67 mg/L(1/3 MNLC)
实验4组:常山碱盐5 mg/L(MNLC)
实验5组:常山碱盐10 mg/L(LC10)
1.5 实验指标检测
1.5.1 常山碱盐对斑马鱼的LC10和MNLC测定 随机选取5 dpf正常野生型AB品系斑马鱼180尾于六孔板中,每孔30尾,分别水溶给予不同质量浓度的常山碱盐:2.5,5,10,20,40 mg/L,每孔药液容量为3 mL,同时设置正常对照组(养鱼用水处理组).用常山碱盐处理斑马鱼24 h至6 dpf,统计各实验组斑马鱼累计死亡数量,使用Origin统计学分析软件,绘制最佳的“死亡率-浓度”效应曲线,得出常山碱盐对斑马鱼的LC10(10%致死浓度)和MNLC(最大非致死浓度).
1.5.2 常山碱盐对斑马鱼肠蠕动抑制作用评价 对5 dpf正常野生型AB品系斑马鱼喂饲2%蛋黄粉3 h,建立斑马鱼肠蠕动抑制作用评价模型.随机选取180尾模型斑马鱼于六孔板中,每孔30尾,分别水溶给予不同质量浓度的常山碱盐:1/10 MNLC(0.5 mg/L)、1/3 MNLC(1.67 mg/L)、MNLC(5 mg/L)和LC10(10 mg/L),每孔药液容量为3 mL,同时设置模型对照组和正常对照组(未喂食正常斑马鱼).常山碱盐处理斑马鱼18 h后,将各实验组斑马鱼进行整体染色和脱色,每组随机选取15尾斑马鱼在显微镜下拍照并采集数据,分析统计斑马鱼肠道染色强度平均值(M),定量评价常山碱盐对斑马鱼肠蠕动的抑制作用,计算公式为:肠蠕动抑制率(%)=(M(药物处理组)-M(模型对照组))/(M(模型对照组)-M(正常对照组))×100%.统计学分析采用方差分析和Dunnett’s T-检验,P<0.05表明数据具有统计学意义.
1.5.3 常山碱盐对斑马鱼肠道毒性表型评价和组织病理学检查 随机选取150尾5 dpf正常野生型AB品系斑马鱼于六孔板中,每孔30尾,分别水溶给予不同质量浓度的常山碱盐:1/10 MNLC(0.5 mg/L)、1/3 MNLC(1.67 mg/L)、MNLC(5 mg/L)和 LC10(10 mg/L),每孔药液容量为3 mL,同时设置正常对照组;实验设置两个平行,分别为平行1和平行2.在平行1实验中,用常山碱盐处理斑马鱼24 h至6 dpf,在显微镜下观察每个实验组斑马鱼肠道有无异常,包括肠腔大小、肠腔颜色、肠道褶皱数量,并统计各指标发生率;在平行2实验中,用常山碱盐处理斑马鱼24 h至6 dpf,将每个实验组斑马鱼用4%多聚甲醛固定,固定后将斑马鱼转移到体积分数70%乙醇中,切片、HE染色,进行肠道组织病理学检查.
1.6 统计学分析

2 结果
2.1 MNLC和LC10测定结果
如表1所示,常山碱盐对斑马鱼的MNLC和LC10约为5 mg/L和10 mg/L.

表1 常山碱盐处理斑马鱼后死亡率
2.2 肠蠕动抑制作用
模型对照组肠道染色强度(0.85)与正常对照组(0.55)比较,P<0.001,提示模型构建成功.用0.5,1.67,5,10 mg/L质量浓度常山碱盐处理斑马鱼后,可见斑马鱼肠道内容物含量明显增加,其肠道染色强度M分别为0.93,1.03,1.08,1.09,肠蠕动抑制率分别为27.78%,61.11%,77.11%,80.89%;常山碱盐实验组与模型对照组比较,P<0.001,常山碱盐各质量浓度对斑马鱼肠蠕动均有较明显的抑制作用.详见表2和图1.
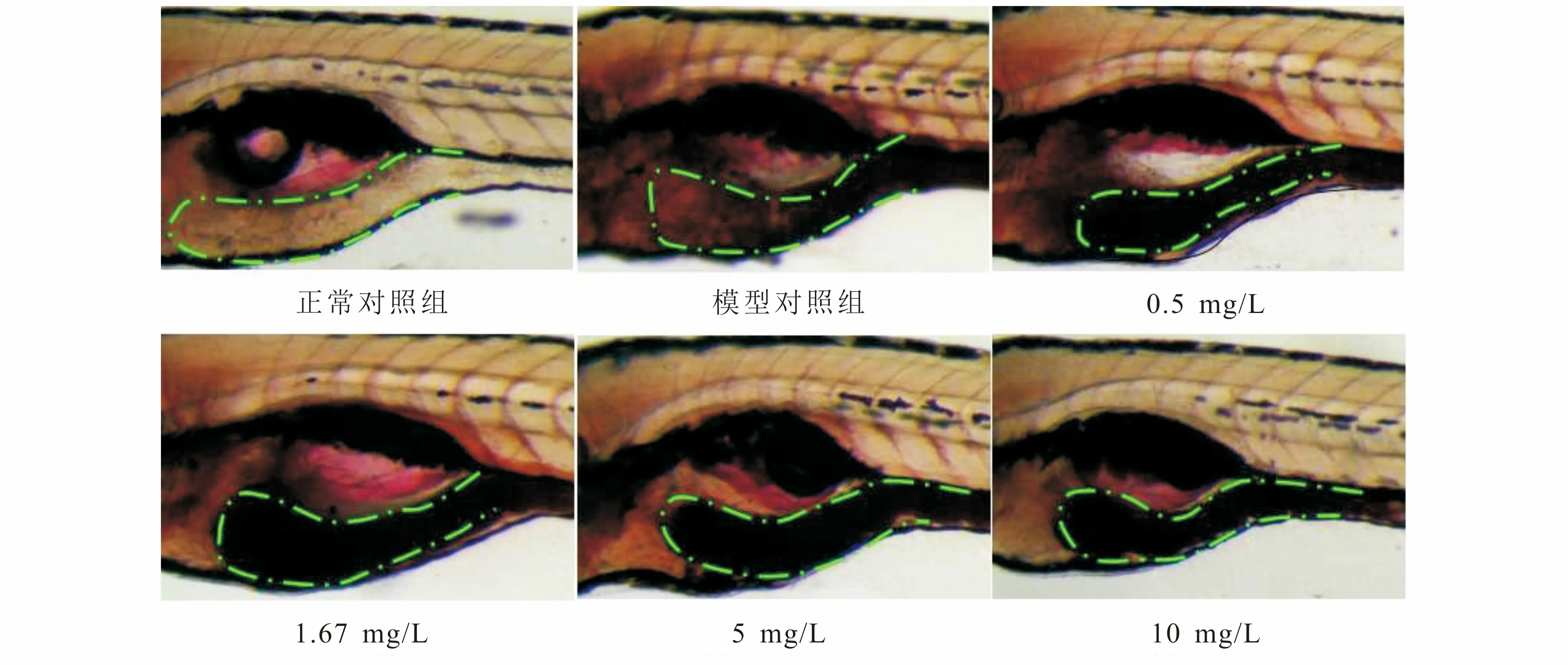
图1 常山碱盐对斑马鱼肠蠕动的抑制作用Fig. 1 Inhibition of Intestinal Peristalsis by Dichroa Alkali Salt in Zebrafish
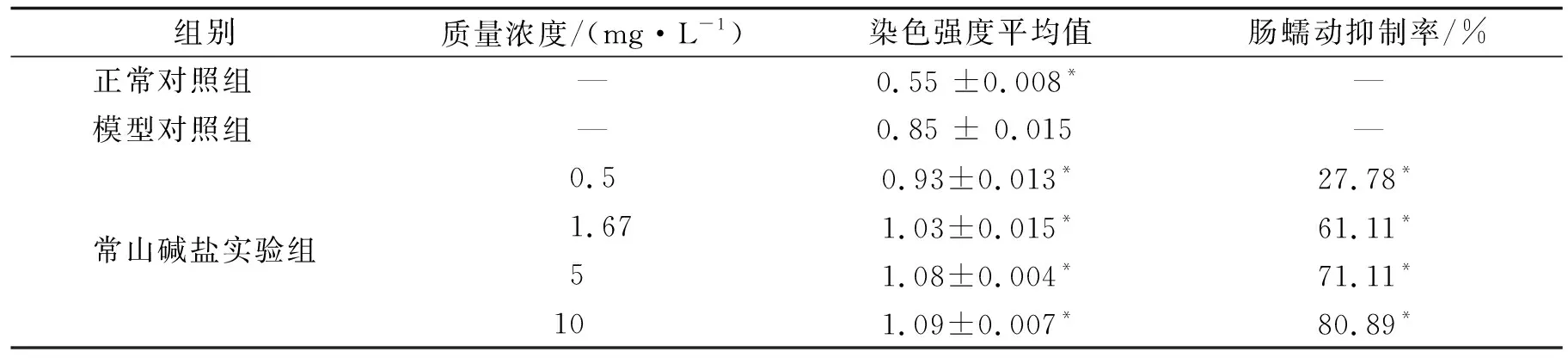
表2 常山碱盐对斑马鱼肠道蠕动和抑制作用评价(n=15)
2.3 肠道毒性表型观察和肠道病理组织学分析
2.3.1 肠道毒性表型观察 在0.5,1.67,5,10 mg/L质量浓度常山碱盐处理条件下,斑马鱼肠道褶皱减少或消失,肠道黏膜细胞变性,肠腔模糊,肠腔变窄,且严重程度和发生率呈较明显的浓度正相关性.其中0.5 mg/L质量浓度常山碱盐实验组有3.3%(1尾)斑马鱼肠腔变黑,其他指标未见显著异常;1.67 mg/L质量浓度常山碱盐实验组有26.7%斑马鱼肠道变黑,其他指标未见明显异常;5和10 mg/L质量浓度常山碱盐实验组斑马鱼肠道出现褶皱减少或消失,肠道黏膜细胞变性、肠腔模糊,肠腔变窄等异常变化.5 mg/L质量浓度实验组斑马鱼肠腔变黑、肠腔变窄和肠褶皱异常发生率分别为63.3%,73.3%,73.3%;10 mg/L质量浓度实验组斑马鱼肠腔变黑、肠腔变窄和肠褶皱异常发生率分别为85.2%,92.6%,96.3%;而正常对照组斑马鱼肠腔正常,可见淡黄色胆汁,肠道褶皱清晰(图2、图3和表3).

图2 常山碱盐诱发斑马鱼肠道毒性表型Fig. 2 Typical Figures of Phenotype with Intestinal Toxicity Induced by Dichroa Alkali Salt in Zebrafish

图3 常山碱盐诱发斑马鱼肠道毒性表型局部放大Fig. 3 Typical Enlarged Figures of Phenotype with Intestinal Toxicity Induced by Dichroa Alkali Salt in Zebrafish
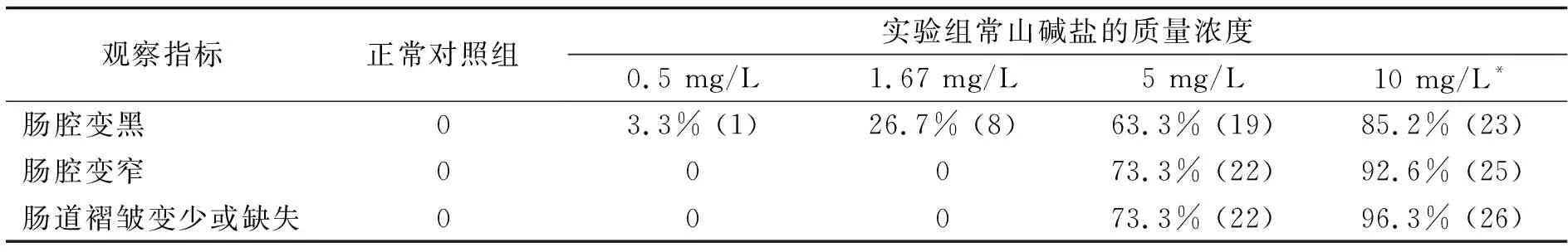
表3 斑马鱼常山碱盐肠道毒性表型观察指标发生率(n=30)
2.3.2 肠道病理组织学观察 在0.5,1.67,5,10 mg/L质量浓度常山碱盐处理条件下,斑马鱼出现肠道黏膜破坏(坏死、脱落),肠腔消失等现象,严重程度呈现出较明显的浓度正相关性.其中0.5,1.67 mg/L质量浓度实验组斑马鱼肠道组织结构未见显著异常;5 mg/L质量浓度实验组斑马鱼肠道褶皱减少,肠黏膜水肿;10 mg/L质量浓度实验组斑马鱼肠道黏膜破坏(坏死、脱落),肠腔消失;而正常对照组斑马鱼肠道结构清晰(图4、图5).

图4 斑马鱼常山碱盐肠道毒性病理切片(10×10倍)Fig.4 Pathological Sections of Intestinal Toxicity of Zebrafish Treated with Different Concentrations of Dichroa Alkali Salt (10×10 times)

图5 斑马鱼常山碱盐肠道毒性病理切片(10×40倍)Fig. 5 Pathological Sections of Intestinal Toxicity of Zebrafish Treated with Different Concentrations of Dichroa Alkali Salt (10×40 times)
3 讨论
中药常山是传统中医临床治疗疟疾的首选药物,但在发挥显著的药效的同时又常常伴随着毒性[7].虽然常山抗疟作用较好,但是其严重的消化系统毒性,尤其是呕吐的毒性作用,使得其在用于临床治疗疾病时安全窗口窄,最终无法对其进行进一步开发利用并成药,其中缺乏用于毒性评价及毒性拮抗药物筛选的可靠模式动物是该药物毒性难以准确评估的主要原因.以往常山毒性评价的常用实验动物为大小鼠,属于啮齿类动物,没有呕吐反射,不能用于恶心呕吐的实验研究,因此将大小鼠用于常山胃肠毒性评价并不十分准确可靠.后来人们改用了鸽子呕吐模型,但近年来由于禽流感的发生,实验动物鸽子也不能稳定供应[8].二十世纪末期以来,斑马鱼作为一种新颖的脊椎类模式动物快速进入了新药筛选、新药研发领域,并已在欧美国家得到越来越广泛的应用[9].2009年,欧洲一家斑马鱼技术服务公司获得了FDA以及EMA的GLP认证,标志着斑马鱼新药筛选与评价技术已得到国际上权威部门的认可.OECD也已经制订了多个用斑马鱼评价化学品安全性的指导原则.中国也将斑马鱼技术列入“重大新药创制”专项中的关键技术开发项目[10].目前,辉瑞、诺华、默克、罗氏、葛兰素史克、阿斯利康等跨国医药巨头都已经在使用斑马鱼新药筛选技术进行药物开发.与传统的体外实验方案和哺乳动物模型相比,斑马鱼药物筛选平台具有可靠、快速、高效、低廉等优点,能够缩短新药研发周期、降低新药研发成本、鉴别新药的毒性、提高新药研发成功率[11].本研究应用斑马鱼作为模式动物对常山碱盐毒性进行评价研究,测得常山碱盐对斑马鱼的LC10和MNLC约为10 mg/L和5 mg/L,并进行了肠蠕动抑制评价、肠道表型和肠道病理组织学观察.在0.5,1.67,5,10 mg/L质量浓度常山碱盐处理条件下,斑马鱼肠道内容物含量明显增加,肠蠕动抑制率分别为27.78%,61.11%,77.11%,80.89%;肠道毒性表型和病理组织学观察发现,在0.5,1.67,5,10 mg/L质量浓度常山碱盐处理条件下,斑马鱼肠道褶皱减少或消失,肠道黏膜细胞变性,肠道黏膜破坏,肠腔模糊,肠腔变窄,且严重程度和发生率呈较明显的浓度正相关性.综上,常山碱盐存在明确的胃肠道毒性,斑马鱼可作为模式动物应用于消化道毒性药物的致毒作用研究,本研究结果为后期探究常山碱盐等消化道致毒的关键分子机制提供了重要的技术保障.

