黄连治疗新冠肺炎的作用机理
——基于网络药理学方法和分子对接技术*
冯必钧
(吉首大学药学院,湖南 吉首 416000)
新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)是一种由严重急性呼吸道综合征冠状病毒2型(SARS-CoV-2)引发的传染病,具有传播速度快、感染性强、致死人数多等特点.COVID-19是单链的RNA beta冠状病毒,其基因组编码为结构蛋白,非结构蛋白和辅助蛋白[1].COVID-19的症状多种多样,通常包括发烧,咳嗽,疲劳,呼吸困难以及嗅觉或味觉丧失,大多数患者(81%)感染后会出现轻至中度症状(轻度肺炎),14%患者出现严重症状(如呼吸困难,缺氧或影像学上肺部受累超过50%),5%患者出现更为严重的症状(如呼吸衰竭,休克或多器官功能障碍)[2].目前,国内外学者还未发现针对COVID-19的特异性治愈方法[3].传统中药(Traditional Chinese Medicine,TCM)的临床验证表现良好,是许多严重疾病(如严重急性呼吸道综合症(SARS))的补充治疗方法[4].许多临床实践结果表明,中药在COVID-19的治疗中也起着重要作用[5].连花清瘟胶囊,金花清感颗粒,血必净注射液,清肺排毒汤,化湿败毒方,宣肺败毒方,简称“三药三方”,均被证实对COVID-19治疗有效[6].研究表明,金花清感颗粒可有效缩短COVID-19患者的核酸检出时间,促进肺炎性渗出物的吸收[7].有学者研究了使用连花清瘟胶囊治疗COVID-19的安全性和有效性,他们发现连花清瘟胶囊能够改善COVID-19的临床症状[8].此外,有研究证实了,血必净注射液可有效改善重症COVID-19患者的炎症指标[9].清肺排毒汤是张仲景研制的中药复方,具有抗病毒,抗炎,免疫调节和退烧等多种药效功能,临床证明清肺排毒汤对COVID-19有良好的治疗作用.黄连(Coptischinensis)是一种在中国被广泛用于治疗肠胃炎的草药,最早在《神农本草经》中便有记载,书中记载的黄连主要用于治疗寒热互结,湿热中阴,痞满呕吐等症.2019年COVID-19爆发时,网传双黄连口服液可以治疗COVID-19,但没有确切的证据.中药黄连的成分较为复杂,因此在发挥药效的过程中往往有多种成分共同参与其中.目前,没有单独用黄连治疗COVID-19的相关报道,也没有学者研究黄连治疗COVID-19的作用机理,因而探寻一种全面综合分析和解释黄连治疗COVID-19机理的方法具有重要意义.
网络药理学是利用系统生物学和计算机技术,构建“疾病-基因-靶点-药物”相互作用网络,分析药物活性成分及靶点在网络模块中的相互作用,了解相关通路网络存在的潜在机制,解释药物作用于人体的奥秘.分子对接能够预测小分子配体与适当目标靶标结合位点的结合构象,其结合行为的表征在药物的合理设计以及阐明基本的生化过程中起着重要作用[11-12].基于此,本研究采用网络药理学和分子对接的方法,筛选出中药黄连的成分,探究其治疗COVID-19的潜在作用靶点及作用机制,以期为临床上使用中药黄连治疗或辅助治疗COVID-19提供理论依据.
1 材料与方法
1.1 数据库及软件
中草药系统药理学平台(TCMSP)(https:∥tcmspw.com/tcmsp.php),Uniprot数据库(https:∥www.uniprot.org/),GeneCards(https:∥www.genecards.org/),OMIM(https:∥www.omim.org/),功能蛋白联系网络(STRING)数据库(https:∥string-db.org/),R语言软件Rx64.4.0.3(https:∥www.r-project.org/),R语言部分插件来源于Bioconductor(https:∥www.bioconductor.org/).
1.2 中药黄连的活性成分和作用靶点
利用中药系统药理数据库和分析平台,结合中药整合药理学平台检索中药黄连的所有活性成分.根据研究结果,以口服生物利用度(oralbioavailability,OB)不小于30%,类药性(drug likeness,DL)不小于0.18作为药物化学成分的筛选条件,得到黄连的生物活性成分.用Uniprot将黄连(TCMSP数据库中收录)有效活性成分的靶点“蛋白名”统一转换为“基因名”.
1.3 COVID-19的疾病靶点
将“COVID-19”作为检索词,在GeneCards、OMIM数据库中检索,限定物种为“人类(Homo sapiens)”,获得疾病的相关靶点.
1.4 药物与疾病共同靶点的筛选
使用R语言软件取黄连活性成分作用靶点和COVID-19疾病靶点的交集,获得药物与疾病的共同靶点,并绘制韦恩图.
1.5 “药物—活性成分—疾病—靶点”互作网络的构建
利用Cytoscape 3.7.2软件构建“药物—活性成分—靶点—疾病”互作网络,网络图中以“节点(node)”代表药物、活性成分、疾病和靶点,“边(edge)”代表以上节点之间的相互关系.使用的R包通过R和Bioconductor网站下载.
1.6 药物与疾病互作网络的构建
将药物与疾病的共同靶点上传至STRING11.0数据库中,选取Multiple protein,选择研究物种为“Homo sapiens”,构建共同靶点PPI网络,网络中“node”代表不同靶点,“edge”代表不同靶点之间的相互关系.所用R包通过R和Bioconductor网站下载.
1.7 ClueGO生物功能分析和KEGG通路富集分析
通过R语言的“clusterProfiler”包对药物与疾病的共同靶点进行GO分析,即对黄连作用于COVID-19的靶点进行GO功能富集分析,结果以条形图呈现.此外,应用R语言软件对以上共同靶点进行KEGG通路富集分析,定义P<0.05,Q<0.05.同时根据富集因子值进一步分析核心通路的富集程度,以探究中药黄连治疗COVID-19的潜在作用机制.
1.8 分子对接
从黄连的有效成分中选取标志性成分与其治疗COVID-19的主要靶点进行分子对接,从RCSB数据库(https:∥www.rcsb.org/)下载相关蛋白的结构,使用Pymol软件去除其溶剂分子与配体,从pubchem数据库(https:∥pubchem.ncbi.nlm.nih.gov/)中下载配体化合物结构,使用Auto Dockvina进行分子对接.
2 结果
2.1 黄连活性成分及其相关靶点
从TCMSP数据库搜索黄连的活性成分以及相关靶点,以OB不小于30%和DL不小于0.18作为筛选条件,筛选出黄连的活性化合物14个,见表1.TCMSP数据库收录了黄连的成分作用靶点共596个.利用Uniprot将靶点名称转化为标准的基因名,剔除重复非人源以及无标准基因名的靶点,最终获得黄连有效活性成分作用靶点235个.

表1 黄连的活性成分
2.2 COVID-19疾病相关基因
通过GeneCards和OMIM数据库检索到与COVID-19相关的基因共341个,其中GeneCards数据库搜索到COVID-19靶点基因339个,OMIN数据库搜索到COVID-19相关靶点基因2个.
2.3 黄连作用于COVID-19的潜在靶点
使用R软件获取中药黄连的潜在作用靶点与疾病靶点之间的交集基因,得到8个药物与疾病的互作基因(图1),分别是EGFR,VEGFA,IL10,IL6,POR,HMOX1,PLAT,CRP.将8个互作基因定义为黄连治疗COVID-19的“关键靶点”.
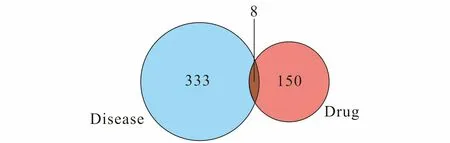
图1 药物与疾病靶点韦恩图Fig.1 Venn Diagram of Drugs and Disease Targets
2.4 “药物—活性成分—靶点—疾病”相互作用网络
将获得的黄连治疗COVID-19的8个“关键靶点”以及药物的活性成分导入Cytoscape 3.7.2软件中,构建“药物—活性成分—靶点—疾病”互作网络,见图2.在网络图中,六边形代表药物黄连,三角形代表黄连所含的活性成分,菱形代表疾病COVID-19,椭圆形代表药物活性成分所作用的靶点映射到疾病的靶点,图2中共包含节点11个,其中代表黄连活性成分的节点1个,代表作用靶点的节点10个,节点与节点之间的连线(17条边)代表“药物—活性成分—疾病—靶点”的作用关系.网络图分析结果表明,黄连有效成分中的槲皮素是该网络中自由度最高的成分,是治疗COVID-19的主要活性成分.
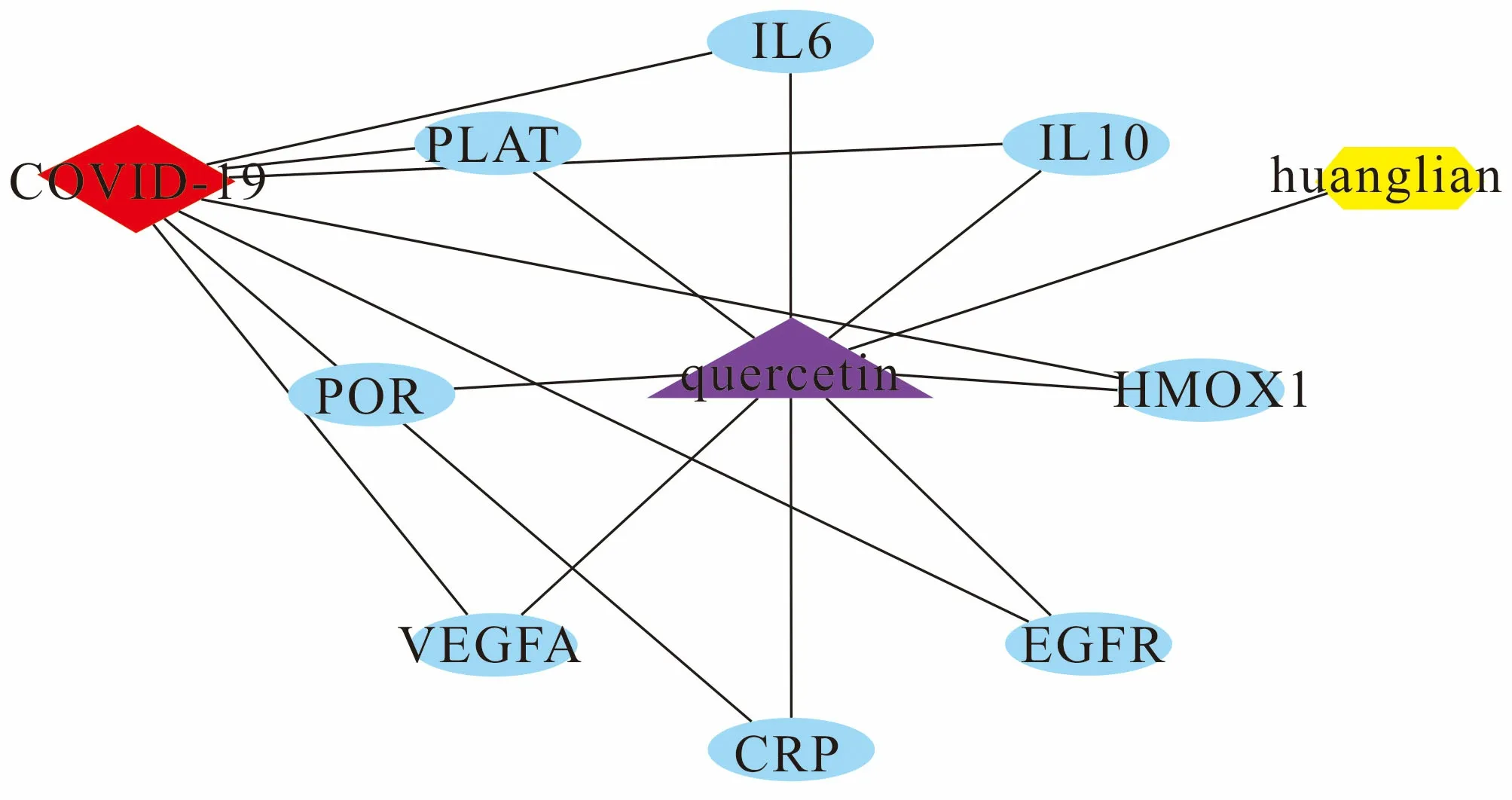
图2 “药物—活性成分—疾病—靶点”互作网络Fig. 2 "Drug-Active Ingredient-Disease-Target" Interaction Network
2.5 关键靶点的PPI网络
在STRING数据库中导入药物黄连作用于疾病的8个靶点基因,获取蛋白相互作用的PPI网络图,如图3所示.图中含有8个节点和17条互作边,平均节点4.25,其中边代表作用靶点之间的关联,节点代表作用靶点.在该网络中,圆形节点表示药物和疾病相互作用的靶点,每条边代表靶点之间的靶向相互作用关系.在该网络中起主导作用的核心基因是VEGFA,IL6,POR,PLAT,它们位于PPI网络的中心位置.说明中药黄连活性成分槲皮素与它们有较高的结合活性,可作为黄连治疗COVID-19的潜在靶点.
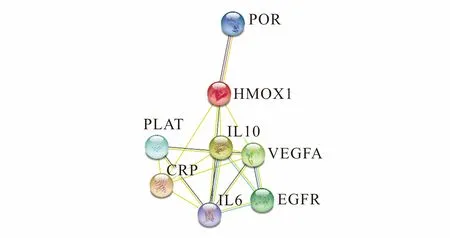
图3 黄连治疗COVID-19关键靶点的PPI网络图Fig. 3 PPI Network Diagram of the Key Targets of Coptis chinensis Treatment of COVID-19
2.6 靶点的GO功能富集分析
使用R软件对黄连作用于COVID-19的靶点进行GO功能富集分析.GO富集分析发现,有22个具有统计学意义(P<0.05)的生物过程,通过对8个交集靶点进行功能富集,以GO功能为纵坐标,以在GO上富集的基因数为横坐标,以矫正P值(红色的深浅)为标值,对前20个GO基因富集做GO功能富集条形图,见图4.由图4可知,基因主要在生长因子受体结合、生长因子活性、细胞因子活性、细胞因子受体结合、受体配体活性、信号转导受体激活剂、氧化还原酶活性(作用于成对供体,结合或还原分子氧)等功能上富集,在这些功能上富集的基因主要有VEGFA,IL6,POR,PLAT.结果表明,黄连可能主要通过VEGFA,IL6,POR,PLAT等基因调节生长因子受体结合、生长因子活性、细胞因子活性、细胞因子受体结合等功能进而达到治疗COVID-19的目的.
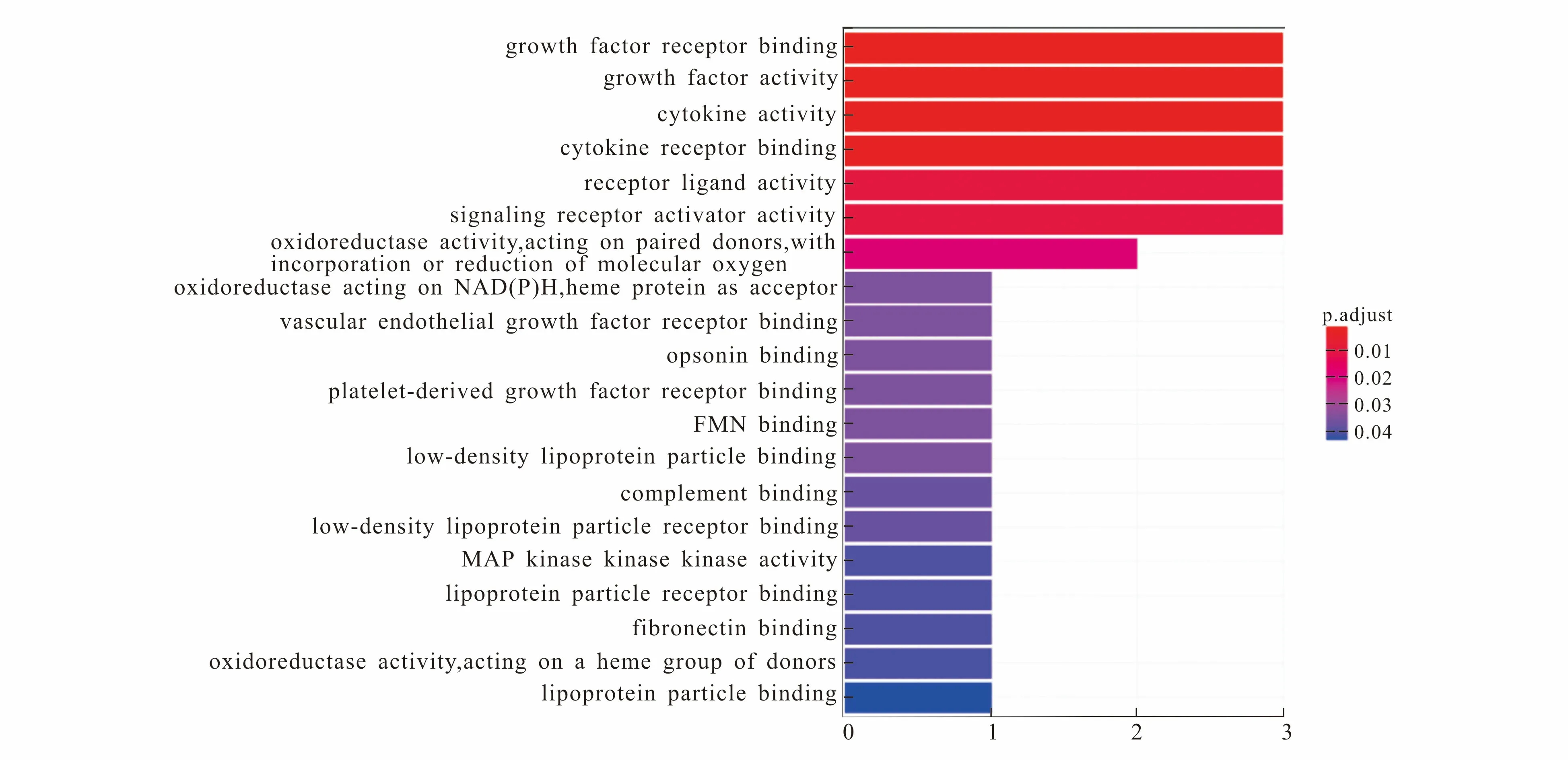
图4 黄连治疗COVID-19的主要生物学过程(前20个)Fig. 4 Main Biological Process of Coptis chinensis Treatment of COVID-19 (Top 20)
2.7 靶点的KEGG通路富集分析
KEGG通路富集分析得到34条信号通路(P<0.05),排除广泛通路后,表2中列出了排名前20的信号通路.由表2可知,共同靶点主要富集于HIF-1信号通路、EGFR酪氨酸激酶抑制剂耐药、FoxO信号通路、流体剪切应力与动脉粥样硬化、JAK-STAT信号通路、PI3K-Akt信号通路等相关信号通路上.基因在HIF-1信号通路中富集图见图5(图中红色框内的基因表示在本通路调控网络中的药物与疾病互作基因),此通路调节与血管生成有关的VEGF的表达,调节与血管张力有关的HMOC1的表达.基因在EGFR信号通路中的富集图见图6(图中红色框内的基因表示在本通路调控网络中的药物与疾病互作基因),此通路调节炎性细胞因子IL6的表达,表皮生长因子EGFR的表达,调节表皮间质的转化,细胞的生长、增殖、生存和血管的生成.基因在JAK-STAT信号通路中的富集图见图7(图中红色框内的基因表示在本通路调控网络中的药物与疾病互作基因),此通路促进细胞因子与细胞因子受体的结合,调节细胞的凋亡、生存和细胞周期.基因在FoxO信号通路中的富集图见图10(图中红色框内的基因表示在本通路调控网络中的药物与疾病互作基因),此通路促进炎性因子IL-6,IL-10和表皮生长因子EGFR的表达,调节细胞周期,细胞的凋亡、自噬、氧化应激及DNA的修复和代谢,以此达到治疗COVID-19的目的.
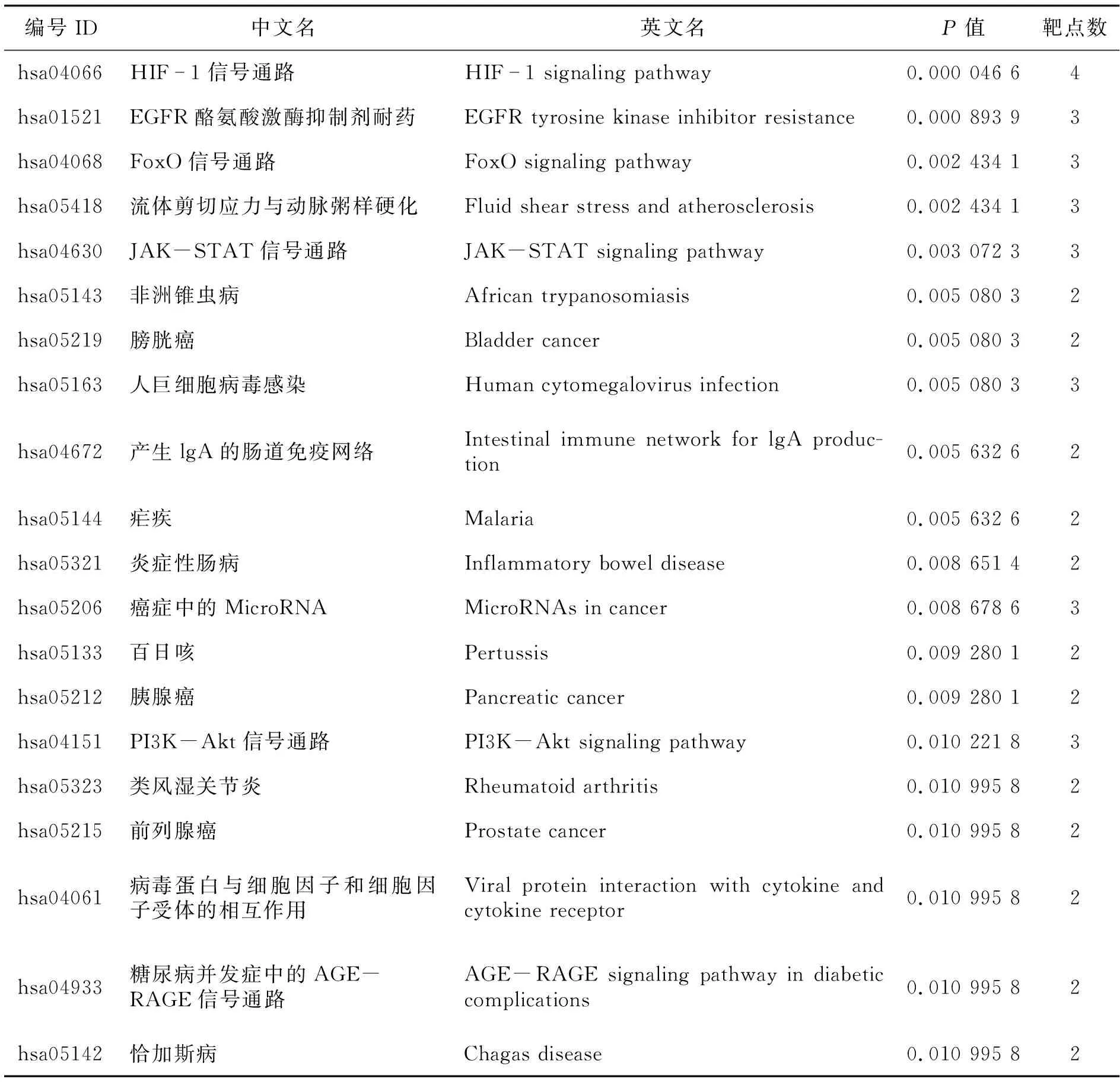
表2 靶点通路富集结果(前20个)
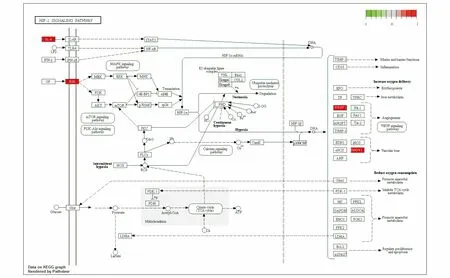
图5 基因在HIF-1信号通路中富集图Fig. 5 Gene Enrichment Map in the HIF-1 Signaling Pathway
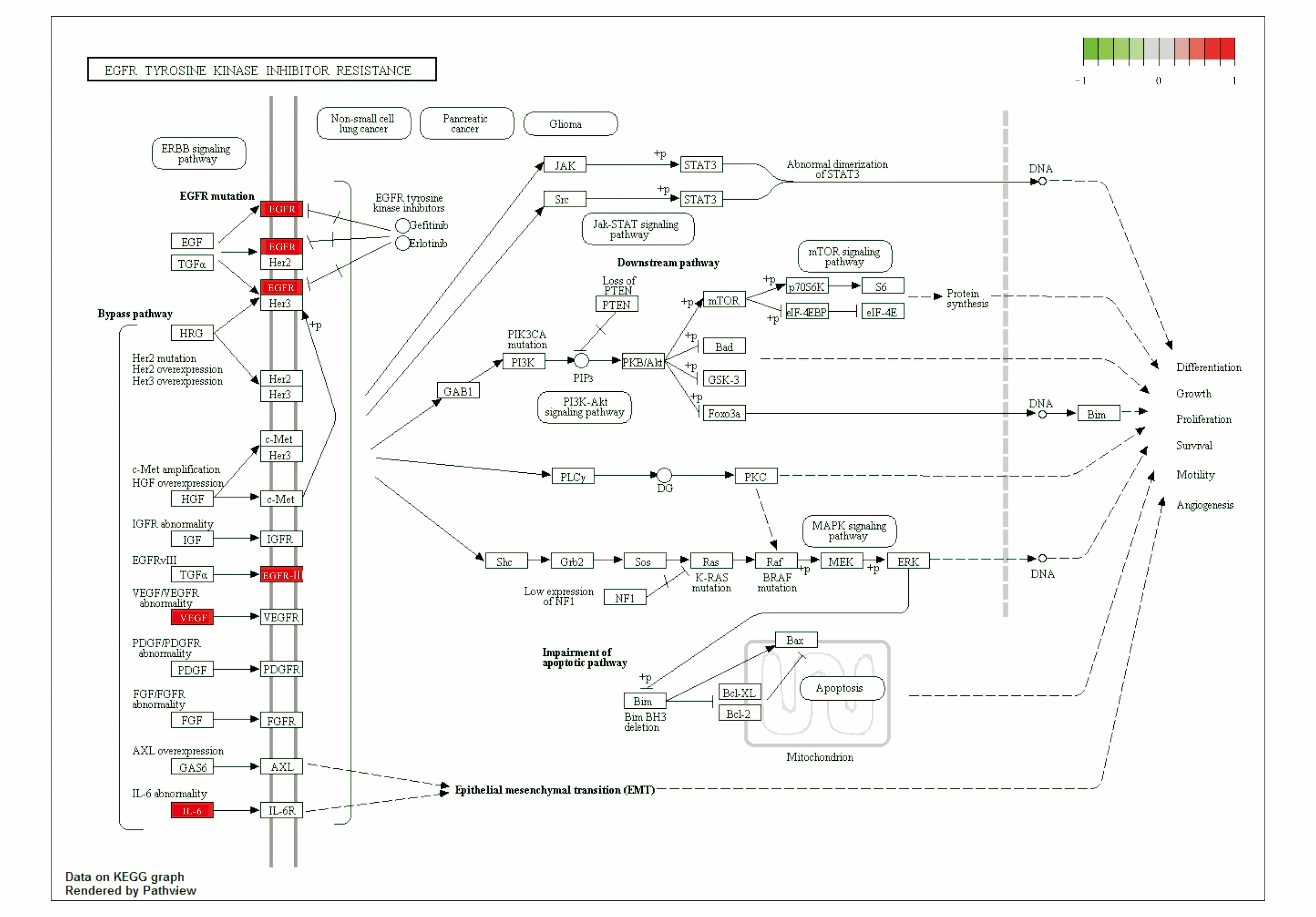
图6 基因在EGFR信号通路中的富集图Fig. 6 Enrichment Map of Genes in the EGFR Signaling Pathway

图7 基因在JAK-STAT信号通路中的富集图Fig. 7 Enrichment Map of Genes in JAK-STAT Signaling Pathway

图8 基因在FoxO信号通路中的富集图Fig. 8 Gene Enrichment Map in FoxO Signaling Pathway
2.8 黄连活性成分与其治疗COVID-19的主要靶点蛋白的分子对接结果
用黄连活性成分榭皮素分别与其治疗COVID-19的主要靶点VEGFA,IL6,POR,PLAT对接,最佳结果如表3所示.结果表明:榭皮素与PLAT不能形成氢键,但能与IL6,POR和VEGFA形成氢键,榭皮素和VEGFA,IL6,POR,PLAT的结合能均小于-5 kcal/mol,因此,它们可能在黄连治疗COVID-19中起主要作用.

表3 黄连活性成分与其治疗COVID-19的主要靶点蛋白的分子对接结果
3 讨论
本研究通过对黄连有效活性成分的挖掘,发现黄连中主要活性成分榭皮素为“药物—成分—疾病—靶点”网络中的核心节点,是该网络中自由度最高的成分.据报道,榭皮素是一种多酚类化合物,其生理作用包括抗氧化,抗炎,抗病原和免疫调节.动物和体外研究表明,榭皮素对免疫活性有影响,包括嗜中性粒细胞趋化性增强,巨噬细胞吞噬作用,NK细胞裂解活性和促有丝分裂原刺激的淋巴细胞增殖.榭皮素可调节与细胞因子产生有关的某些基因的表达[14].榭皮素具有抗病毒和抗菌特性,包括抑制甲型流感病毒H1N1,H3N2和抑制H5N1的侵入[16],这提示榭皮素在治疗COVID-19中可能发挥着重要作用.
PPI网络显示,VEGFA,IL6,POR,PLAT位于PPI网络的中心位置.说明中药黄连活性成分与它们有较高的结合活性,这些靶点可作为黄连治疗COVID-19的潜在靶点.IL-6是白介素超家族的主要成员[17],既可作为促炎性细胞因子,又可作为抗炎性肌因子[18].成骨细胞分泌IL-6以刺激破骨细胞形成.许多血管的中膜介质中的平滑肌细胞也产生IL-6作为促炎性细胞因子.IL-6作为抗炎性肌动蛋白的作用是通过其对TNF-α和IL-1的抑制作用以及IL-1ra和IL-10的激活而介导的.IL-6可以用作严重COVID-19感染的炎性标志物[18].IL-6作为肌肉因子具有广泛的抗炎功能[19].RAC-α丝氨酸/苏氨酸-蛋白激酶是一种酶,在人中编码AKT1基因.该酶属于丝氨酸/苏氨酸激酶的AKT亚家族[20].VEGF是急性肺损伤和急性呼吸窘迫综合征的关键因素,缺氧和严重炎症会增加VEGF的水平,在COVID-19患者中显著升高.VEGF的低氧上调通常通过ACE2的上调来抵抗[21].
通过对黄连有效成分作用的关键靶点进行生物学过程富集分析,基因主要在生长因子受体结合、生长因子活性、细胞因子活性、细胞因子受体结合、受体配体活性、信号转导受体激活剂、氧化还原酶活性(作用于成对供体,结合或还原分子氧)等功能上富集,显示黄连可能通过VEGFA,IL6,POR,PLAT等基因调节生长因子受体结合、生长因子活性、细胞因子活性、细胞因子受体结合等功能,进而治疗COVID-19.在KEGG富集分析中,证实黄连对HIF-1信号通路、EGFR酪氨酸激酶抑制剂耐药信号通路、FoxO信号通路具有调控作用.基因通过HIF-1信号通路,调节与血管生成有关的VEGF的表达,调节与血管张力有关的HMOC1的表达;通过EGFR酪氨酸激酶抑制剂耐药信号通路,调节表皮间质的转化,细胞的生长、增殖、生存和血管的生成;通过JAK-STAT信号通路,促进细胞因子与细胞因子受体的结合,调节细胞的凋亡、生存和细胞周期;通过FoxO信号通路,促进炎性因子IL-6、IL-10和表皮生长因子EGFR的表达,调节细胞周期,细胞的凋亡、自噬、氧化应激及DNA的修复和代谢,达到治疗COVID-19的目的.
基因通过HIF-1信号通路治疗COVID-19的可能机制是HIF-1α激活轻度缺氧条件下的信号通路,减少了ACE2和TMPRSS2的表达,并增加了表面的ADAM17水平肺泡细胞,因此降低了SARSCoV-2的侵袭性.相反,HIF-1α的蛋白质靶标参与了严重的缺氧诱导的促炎细胞因子的表达激活,以及随后的COVID-19炎症过程和细胞因子风暴期.此外,适量的间歇性缺氧可以减轻促炎过程[22].在哺乳动物中,FOXO3a通过诱导DNA修复来调节细胞对应激的抵抗力,从而可能影响生物体的寿命[23].最近的研究表明,IL-6-JAK-STAT3轴与COVID-19发生的严重程度密切相关[24].因此,对于COVID-19的治疗可以选择从黄连的有效成分入手,探究是否可以通过某些关键靶点和通路发挥作用.
在此基础上,本研究特别选用黄连的榭皮素分别与VEGFA,IL6,POR,PLAT对接.为了进一步合理验证黄连治疗COVID-19的药效物质基础,在进行分子对接时,以结合能不超过-5.0 kJ/mol作为筛选标准,榭皮素与VEGFA,IL6,POR,PLAT的对接结合能均符合筛选标准,说明榭皮素可能直接作用于COVID-19的靶点从而治疗COVID-19.
本研究黄连榭皮素与POR对接的结果与Derosa等[25]的发现基本一致,即榭皮素可抑制POR,榭皮素在理论上具有干扰SARS-CoV-2复制的能力.DI等[26]分子对接研究表明,槲皮素可抑制3CLpro,PLpro和S蛋白.最近有研究证实,榭皮素是一种有效的3CLpro抑制剂.迄今为止,未见有榭皮素与PLAT,VEGFA,IL6分子对接的报道,本研究首次完成了榭皮素与PLAT,VEGFA,IL6的分子对接,对接结果显示,榭皮素与PLAT,VEGFA,IL6均有较好的对接,其结合能均在-6.4 kcal/mol以下.本研究结果为进一步研究COVID-19的靶点PLAT,VEGFA,IL6提供了理论基础.

