微塑料对樱桃萝卜生长的影响
崔 敏, 高 冉, 余松国, 陈学海, 喻雨霏, 李 嘉
微塑料对樱桃萝卜生长的影响
崔 敏, 高 冉, 余松国, 陈学海, 喻雨霏, 李 嘉*
(扬州大学环境科学与工程学院, 扬州 225127)
为探究微塑料对蔬菜生长发育的影响,以菜地土壤中普遍存在的聚乙烯(polyethylene, PE)和聚丙烯(polypropylene, PP)为目标污染物,以根菜类蔬菜樱桃萝卜(L. var.)为供试蔬菜,基于种子萌发试验和土培试验初步探究了不同粒径、不同浓度的微塑料对萝卜生长发育的影响。结果表明:PE和PP对萝卜种子的发芽率无显著影响,仅5 g·L-1的PP对萝卜幼苗芽长具有显著(< 0.05)抑制作用;两种微塑料均能附着在萝卜幼苗根表面,并显著(< 0.05)抑制幼苗根的伸长,且该抑制作用随着微塑料粒径减小、浓度升高而增强。土培条件下,PE和PP并未影响萝卜叶片光合色素的合成;PE对萝卜叶鲜重、根茎鲜重无显著影响,但PP造成萝卜产量显著(< 0.05)降低,表明不同类型微塑料对萝卜生长的影响不同。推断其原因是PE和PP对土壤结构和肥力的影响不同,从而导致萝卜的生物量产生了不同的表现。
微塑料;樱桃萝卜;根长;光合色素;鲜重
微塑料是指粒径小于5 mm的塑料类污染物,包括纤维、薄膜、颗粒和不规则碎片等形貌类型[1]。调查显示,微塑料广泛分布于海洋和陆地系统中[2-4]。其中,土壤被认为是微塑料的主要“汇”,每年排入土壤中的微塑料量远大于海洋[5]。由于微塑料在环境中的数量巨大,降解缓慢,能够附着或释放有毒物质,容易被生物误食继而沿食物网传递,并对生物健康产生毒害作用[6-9],微塑料污染已经成为备受关注的环境问题。
设施蔬菜具有反季节上市、产值高等优点,在我国多个地区得到推广。为了保证设施蔬菜高效生产,通常需要利用塑料膜搭建温室大棚以维持温度。这些塑料材料在紫外线辐射、风力及机械力作用下逐渐裂解形成微塑料并进入设施菜地。Yu等[10]在寿光市蔬菜基地检测到微塑料的浓度为310 ~ 5 698 个·kg-1;Zhang等[11]调查发现,云南某施菜地中微塑料的丰度超过40 000 个·kg-1;Chen等[12]调查了武汉某菜地中微塑料的含量,其最高浓度为12 560 个·kg-1。这表明设施菜地已成为微塑料污染的重灾区。在乡村振兴战略背景下,设施蔬菜产业是增加农民收入的有效途径。因此,研究微塑料对蔬菜生长的影响具有现实意义。
目前,包括小麦()[13]、水稻(L.)[14]、玉米(L. var. Jubilee)[15]、菜豆 (L.)[16]、黄瓜(L.)[17]、蚕豆(()[18]和生菜(L.)[19]在内的多种植物对不同种类微塑料的响应已有研究和报道。例如,相同试验条件下,聚氯乙烯(polyvinyl chloride, PVC)对西葫芦(L.)的毒性强于聚乙烯(polyethylene, PE)、聚丙烯(polypropylene, PP)和聚对苯二甲酸乙二醇酯(polyethylene terephthalate, PET)[20];Li 等[21]的研究表明聚苯乙烯(polystyrene, PS)纳米微球能被黄瓜根系吸收并在叶片中降解产生苯环,影响光合色素和糖代谢;粒径较大的微塑料(>1 μm)无法被植物根系吸收,但可能附着在根系上堵塞细胞壁孔洞甚至造成根系损伤[15, 22];廖苑辰等[13]指出水培条件下PS对小麦()的生长抑制作用强于土培,他们认为PS在水环境中能与小麦根系充分接触,从而通过干扰根系对水分的吸收抑制小麦生长;Lozano等[23]发现聚酯(polyester, PES)微纤维能影响植物群落结构。此外,有研究表明微塑料能刺激植物生长。例如,李贞霞等[17]发现PVC能提高黄瓜(L.)根系活力;Pignattelli等[24]通过土培试验证实PE、PP和PVC 能促进独行菜()叶片中光合色素的合成;De souza Machado等[25]通过土培试验发现PES通过改变土壤结构和水动力,显著促进了洋葱()鳞茎的生长。综上所述,微塑料对植物的生长既有促进作用也有抑制作用,且微塑料对植物的影响取决于微塑料属性、植物种类及环境介质。为了准确评估设施菜地中微塑料的生态风险,亟需加强不同属性微塑料对蔬菜生长发育影响的研究。
本研究选取根菜类蔬菜樱桃萝卜(L. var.)为供试蔬菜,选取菜地土壤中检出率较高的PE和PP为供试的微塑料,基于种子萌发试验和土培试验初步探究了不同粒径、不同浓度的微塑料对樱桃萝卜生长发育的影响,以期为评估微塑料对蔬菜生长发育的影响提供基础数据。
1 材料与方法
1.1 材料
PE(商品标注30目、300目和1 000目)和PP (1 000目)粉末购自中联塑化科技有限公司;分别利用30目(600 μm)、50目(300 μm)、300目(48 μm)、500目(25 μm)、1 000目(13 μm)和2 000目(6.5 μm)的标准筛对购买的微塑料样品进行筛分,得到粒径为300~600 μm、25~48 μm、6.5~13 μm的PE和粒径为6.5~13 μm的PP样品。为便于区分,将300~600 μm的PE表示为PE-L;将25~48 μm的PE表示为PE-M;将6.5~13 μm的PE表示为PE-S;将6.5~13 μm的PP表示为PP-S。樱桃萝卜种子购自青县兴运蔬菜良种繁育中心;过氧化氢(30%)和丙酮购自国药集团化学试剂有限公司,吐温20、碳酸钙和石英砂购自阿拉丁生化科技股份有限公司,所用试剂均为分析纯;陶瓷花盆(口径22 cm)购自淘宝网。
1.2 方法
1.2.1 微塑料悬浮液制备 参照连加攀等[26]的方法制备微塑料悬浮液,称取1 g微塑料样品置于烧杯中,加入100 mL超纯水和0.1 mL吐温20;用铝箔纸覆盖烧杯口,随后将其超声30 min以促进微塑料分散,得到浓度为10 g·L-1的微塑料悬浮液。取适量10 g·L-1的微塑料悬浮液,用含0.1%吐温20的超纯水对其进行稀释便得到浓度为0.1、1和5 g·L-1的微塑料悬浮液,将稀释后的微塑料悬浮液超声30 min。
1.2.2 种子前处理 将供试樱桃萝卜种子置于2%过氧化氢溶液中浸泡消毒30 min,随后用超纯水冲洗5次以去除残留的过氧化氢。将消毒后的种子置于超纯水中浸泡,2 h后取出种子开展试验。
1.2.3 种子萌发试验 在直径为9 cm的玻璃培养皿中放置一张定性滤纸,按照设定浓度向培养皿中加入不同浓度(0.1、1、5和10 g·L-1)的PE-S或PP-S、5 g·L-1不同粒径(PE-S、PE-M和PE-L)的微塑料悬浮液5 mL,空白组加入5 mL含有0.1%吐温20的超纯水。用镊子挑选均一饱满的供试种子均匀放置在培养皿中,每个培养皿10粒并设置3组平行。用石蜡封口膜密封培养皿,随后采取平移轻放的方式将培养皿转移至光照培养箱(GXZ常州海博)中培养7 d,培养条件为:25 ℃,12 h光照/12 h黑暗。
1.2.4 土培试验 供试土壤取自扬州大学试验田,土壤风干后过20目标准筛。按照表1中土壤与微塑料的质量分数,分别称取适量土壤和微塑料样品置于不锈钢盆中,反复搅拌至混匀,随后转移至陶瓷花盆中。每种处理方式设置3组平行,共计21盆。浇透水后,自然条件下培养7 d。选取浸泡消毒的萝卜种子进行播种,每盆10粒,将花盆置于塑料大棚中培养,每天按照最大饱和持水量60%进行浇水。培养7 d后进行间苗,每盆留1株长势相近的幼苗。培养35 d后,收获萝卜进行分析。

表1 土培试验中微塑料与土壤的添加情况
注:“-”表示无。
1.3 生长指标测定
形态学指标:种子萌发试验结束后统计各培养皿中种子的发芽数量(种子露白即为发芽),计算发芽率,发芽率=(7 d内种子的发芽数量/种子总数)×100%;用超纯水冲洗幼苗,随后用滤纸吸干水分,用天平称量幼苗鲜重,用刻度尺测定芽长和根长,并计算抑制率,抑制率=(空白组–处理组)/(空白组)×100%;土培试验结束后,分别称量萝卜根茎和叶片鲜重。
光合色素含量:光合色素的测定参照张蜀秋[27]的方法。土培试验结束后,称取0.5 g 新鲜萝卜叶片置于研钵中剪碎,加入适量碳酸钙和石英砂,加入3 mL丙酮(80%)后研磨成匀浆,再加入10 mL丙酮(80%),继续研磨至组织变白,静置5 min。将组织匀浆全部过滤到25 mL容量瓶中,用80%丙酮定容至刻度线。利用紫外可见分光光度计(UV-2450, SHIMADZU, Japan)测定663 nm、646 nm和470 nm波长下的吸光度值,根据下列公式计算3种色素的含量(mg·g-1)。
叶绿素a(Chla)浓度=12.21×663﹣2.81×646
叶绿素b(Chlb)浓度=20.13×646﹣5.03×663
类胡萝卜素(Car)浓度=(1 000×470﹣3.27×Chla﹣104×Chlb)/229
色素含量=0.025×/
式中:表示不同波长下的吸光度值;表示光合色素的浓度(mg·L-1);为萝卜叶片的质量(g)。
1.4 数据分析
利用Excel 2016和Origin 2015软件对数据进行分析和作图;利用Origin 2015软件对各组数据之间的差异性进行单因素方差分析,< 0.05被定义为显著性差异。
2 结果与分析
2.1 微塑料对樱桃萝卜发芽率的影响
发芽率是评估微塑料对植物种子毒性的重要指标。不同微塑料暴露下樱桃萝卜种子的发芽率如图1所示。种子萌发试验结果表明,萝卜种子的发芽率为93.3% ~ 100%,整体发芽率非常高,表明PP和PE两种微塑料不会影响萝卜种子的发芽率。但是,土培条件下2种微塑料对萝卜种子的发芽率产生了一定的抑制作用,这与张彦等[28]报道的结果类似,他们发现小麦(L.)种子在含有PP或PE微塑料土壤中的发芽率降低。如图1(d)所示,萝卜种子的发芽率随着微塑料粒径的减少而降低,当PE微塑料的粒径为6.5 ~ 13 μm时,萝卜种子的发芽率降至83.3%,抑制率为16.7%,这表明土壤中微塑料粒径越小,其对萝卜种子的发芽率影响越明显。如图1(e)所示,萝卜种子在含有0.20%()PE-M微塑料的土壤中发芽率最低,仅为76.7%,表明低浓度的PE-M对萝卜的发芽率抑制更明显。随着土壤中PE-M比重的增加,萝卜种子的发芽率得到一定程度的恢复,这与前人报道的结果相一致[26, 28]。这可能是因为微塑料在高浓度条件下发生了团聚反应,阻碍了其与种子的结合,从而减轻了其发芽胁迫[26]。另外,张秀玲等[29]指出,添加少量的微塑料会增加土壤孔隙度,但大量的微塑料积累会阻塞土壤孔隙。因此,随着土壤中微塑料比重的增加,土壤孔隙减少,微塑料很难迁移至种子表面,从而对种子发芽率的影响减弱。
2.2 微塑料对樱桃萝卜幼苗根长和芽长的影响
微塑料对樱桃萝卜幼苗根长的影响如图2所示。PE微塑料的粒径越小,其对樱桃萝卜幼苗根长的抑制率越高;粒径较大的PE-L也能显著(< 0.05)抑制萝卜幼苗根伸长(图2(a))。与对照组(CK)相比,在0.1 g·L-1的PE-S暴露下,樱桃萝卜幼苗根的生长受到抑制,但无统计学差异(> 0.05);当PE-S浓度达到1 g·L-1时,萝卜幼苗的根长显著(< 0.01)降低,表明较低浓度的PE-S微塑料即可显著抑制樱桃萝卜根伸长。随着微塑料浓度继续增加(>1 g·L-1时),PE-S对萝卜幼苗根长的抑制率逐步增加(图2(b))。该结果与叶子琪等[18]报道的结果一致,他们发现PE能抑制蚕豆()幼苗的根长,且抑制作用随着PE浓度的升高而增强。浓度为0.1 g·L-1的PP-S即可显著(< 0.05)抑制萝卜幼苗根的伸长(图2(c))。但是,随着PP-S浓度继续增加(1 ~ 10 g·L-1),其对樱桃萝卜幼苗根长的抑制率趋于平衡;同时,在0.1~5 g·L-1浓度范围内PP-S对根长的抑制率(22.04% ~ 35.38%)要大于PE-S(12.92% ~ 33.38%),这表明微塑料对樱桃萝卜幼苗根长的影响因塑料类型而异。总体而言,微塑料暴露条件下樱桃萝卜幼苗的根长均受到不同程度的抑制,且抑制程度与微塑料的粒径、浓度和类型有关。
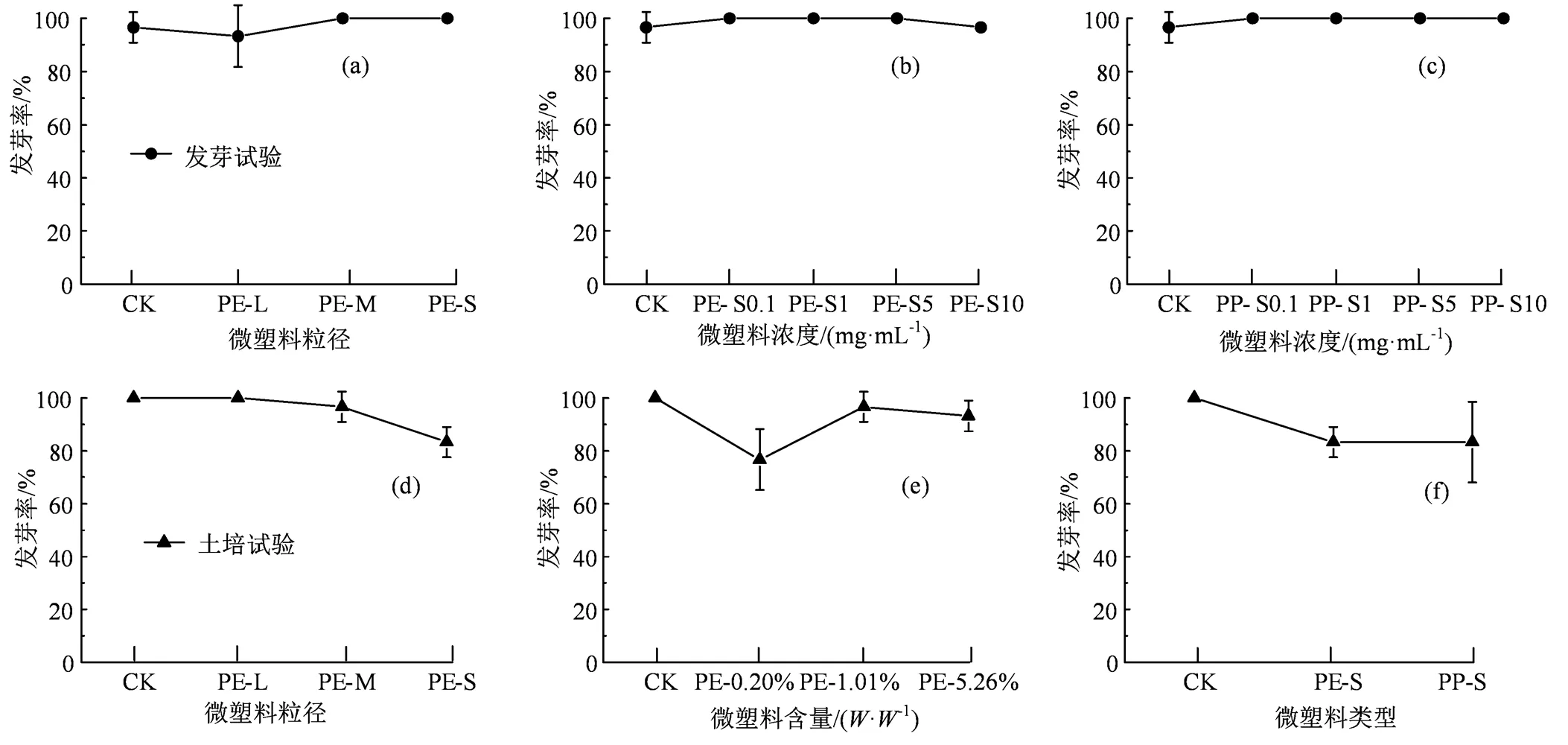
(a)—(c)为种子萌发试验,(d)—(f)为土培试验。
Figure 1 Germination percentage of radish seeds in different treatment groups
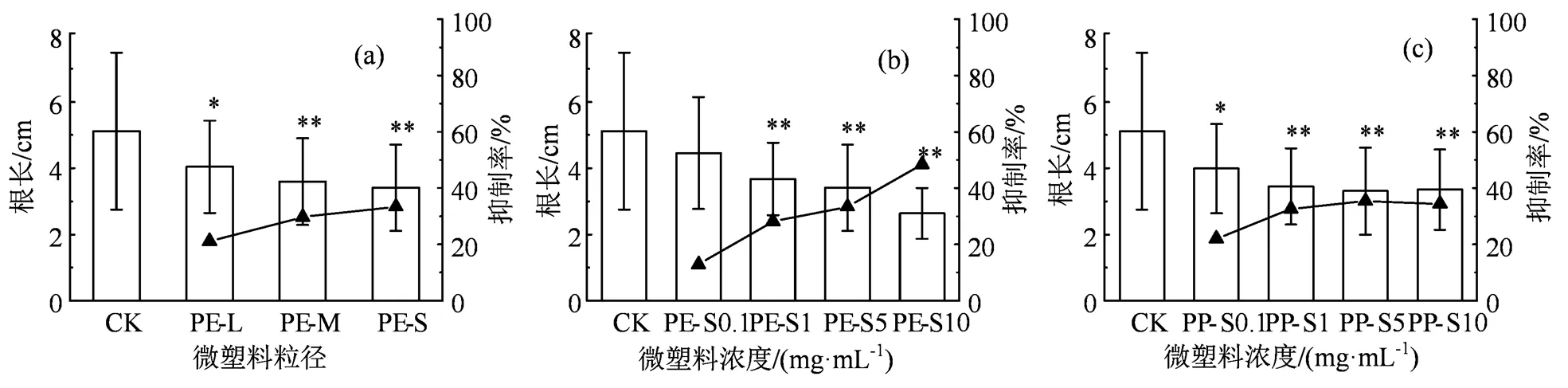
与CK相比有显著性差异,*表示P < 0.05,**表示P < 0.01,下同。
Figure 2 Effects of PE with different particle sizes (a), PE with different concentrations (b) and PP with different concentrations (c) on the root length of radish seedlings

图3 PP(a)和PE(b)微塑料附着在樱桃萝卜根系的显微镜照片(红圈中为部分附着的微塑料)
Figure 3 Micrographs of PP (a) and PE (b) microplastics attached to radish root(partially attached microplastics are circled in red)
Jiang等[30]通过激光共聚焦扫描显微镜发现,0.1 μm的微塑料在豌豆(L.)根部富集,并堵塞营养运输的细胞壁孔道;Kalčíková等[22]报道,30 ~ 600 μm的微塑料能附着在浮萍()根系表面,通过机械损伤阻碍根生长;Dong等[14]指出,微塑料能对水稻(L.)根系造成机械损伤而产生活性氧,影响水稻的正常代谢。由此可推断,樱桃萝卜幼苗根长变短可能与PE和PP附着在根系表面有关。为了验证这一推论,本文利用显微镜对萝卜幼苗根部进行了观察。结果(图3)显示,PP和PE两种微塑料均能附着在樱桃萝卜根外壁及根毛上,且数量巨大。这可能会干扰根部细胞对营养物质的吸收甚至造成根系损伤,最终阻碍根部发育,导致根长变短。
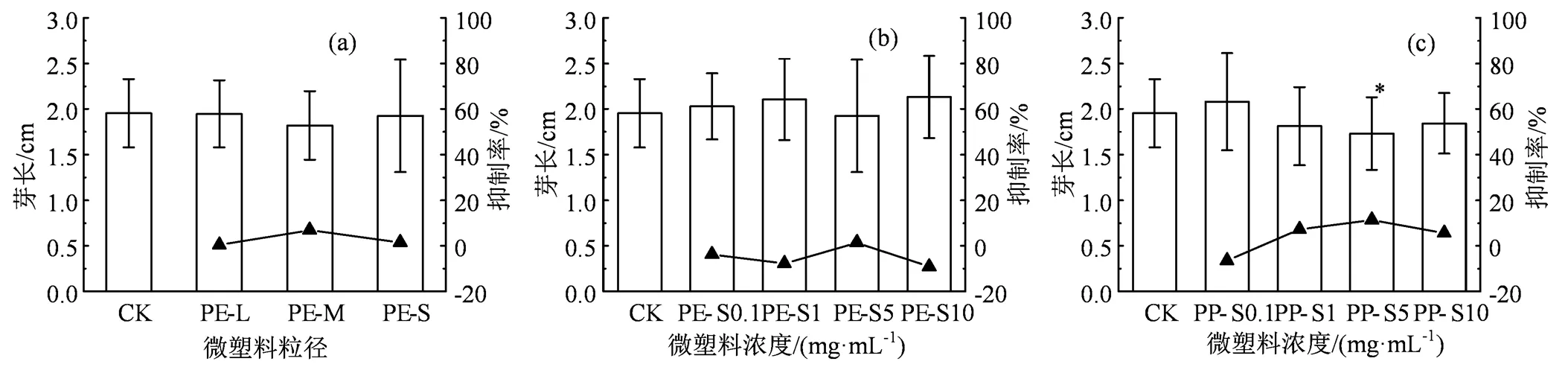
图4 不同粒径PE(a)、不同浓度PE(b)和不同浓度PP(c)微塑料对樱桃萝卜幼苗芽长的影响
Figure 4 Effects of PE with different particle sizes(a), PE with different concentrations (b) and PP with different concentrations(c) on coleoptile length of cherry radish seedlings
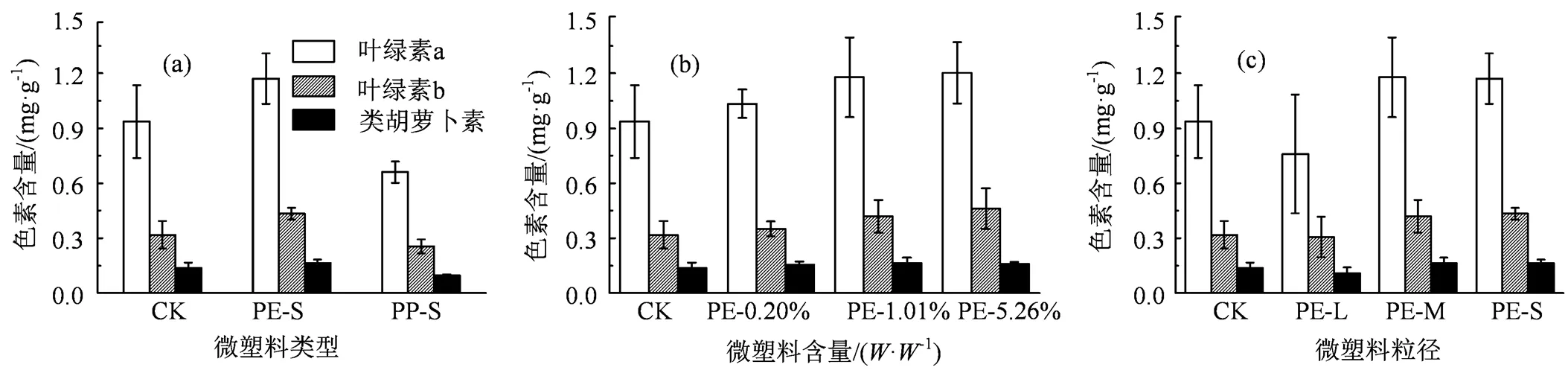
图5 不同类型(a)、不同浓度(b)和不同粒径(c)微塑料对樱桃萝卜叶片光合色素的影响
Figure 5 Effects of microplastics with different types (a), different concentrations (b) and different particle sizes (c) on photosynthetic pigments in cherry radish leaves

图6 不同类型(a)、不同浓度(b)和不同粒径(c)微塑料对樱桃萝卜生物量的影响
Figure 6 Effects of microplastics with different types (a), different concentrations (b) and different particle sizes (c) on cherry radish biomass
如图4(a)和4(b)所示, PE微塑料对樱桃萝卜幼苗的芽长无显著(> 0.05)影响,且PE微塑料对芽长的影响与PE的粒径大小、浓度之间并无相关性。较高浓度的PP(>1 g·L-1)对樱桃萝卜芽长产生了一定的抑制作用,抑制率为5.6% ~ 11.5%(图4(c)),但仅5 g·L-1的PP对樱桃萝卜幼苗芽长具有显著(< 0.05)抑制作用。相对而言, PE-S和PP-S微塑料均在5 g·L-1时对樱桃萝卜幼苗芽长的抑制最明显,且PP对芽长的抑制强于PE。种子萌发试验结果表明,PP和PE两种微塑料对樱桃萝卜幼苗芽长的影响较弱。
2.3 微塑料对樱桃萝卜光合色素的影响
光合色素在植物光合作用中发挥着重要作用,其含量是衡量植物光合能力强弱的直接指标。土培条件下微塑料对萝卜叶片光合色素的影响如图5所示。与对照组(CK)相比,向土壤中添加不同类型、不同比重或不同粒径的微塑料均不会显著(> 0.05)影响萝卜叶片光合色素的含量。在含有1.01%()PP-S微塑料的土壤里,萝卜叶片中的叶绿素a、叶绿素b和类胡萝卜素分别较对照组(CK)降低了29.6%、19.4%和29.5%,但也不具有统计学差异(> 0.05)。这表明在本研究设定的浓度范围内(0.20% ~ 5.26%),PE和PP微塑料对萝卜叶片中光合色素的合成无影响。Mateos-Cárdenas等[31]发现,PE微塑料能附着在浮萍(L.)表面,但不会影响叶绿素a的含量;Qi等[32]通过小麦()土培试验得出,PE和可降解微塑料对小麦()叶片中叶绿素含量无显著影响;Colzi等[20]的研究表明,PP对西葫芦叶片中光合色素的含量无影响。这些与本文结果一致。Meng等[16]发现较低浓度(0.5%,)的PE能抑制菜豆(L.)叶片光合色素的合成,但较高浓度(1.0% ~ 2.5%,)的PE对光合色素的含量无影响,他们将PE对光合色素的影响归结为常见的生物变异。
2.4 微塑料对樱桃萝卜生物量的影响
土培条件下微塑料对萝卜鲜重的影响如图6所示。在含有PE-M微塑料的土壤中,随着其含量的增加,萝卜根茎(地下部分)鲜重逐渐增加,而叶片(地上部分)鲜重总体上呈现微弱降低的趋势,但均不具有统计学意义(> 0.05)。此外,粒径较大的PE-L对萝卜的生物量也无显著(> 0.05)影响。相对而言,粒径较小的PE-S对樱桃萝卜生物量,尤其是根茎的生长具有一定程度的抑制作用。与大粒径的微塑料相比,小粒径的微塑料更易迁移至萝卜根系周围而被吸附在根表面,进而可能阻碍根系对水分和营养物质的吸收[15],也可能对根系造成机械损伤[22],最终影响萝卜根茎生长。总体而言,在本研究设定的试验条件下,PE微塑料不会影响樱桃萝卜的产量,这与Wang等[33]报道的结果一致,他们发现10%()的PE对玉米(L.var.Wannuoyihao)植株生物量无显著影响。相反,当土壤中含有1.01%()的PP-S微塑料时,萝卜的叶鲜重、根茎鲜重和总鲜重较对照组均显著(< 0.05)减少,表明相同尺寸和浓度的PP对萝卜产量的抑制作用强于PE。有关不同类型微塑料对植物生物量影响不同的结果已有报道。例如,Colzi等[20]通过土培试验得出,PP显著降低了西葫芦植株鲜重,而PE对西葫芦(L.)幼苗的生物量无影响。此外,Meng等[16]也指出PE对菜豆(L.)的生物量无影响。这可能是因为PE能改善土壤微环境[35],甚至提高土壤肥力[36]。另外,不同类型微塑料对土壤结构具有不同影响[25, 35]。因此,PP抑制萝卜生长的原因可能是PP微塑料对土壤理化性质(如土壤孔隙、饱和持水量、透气性)产生显著影响,导致土壤肥力下降,进而间接影响萝卜生长。
3 结论
无论在水环境还是土壤环境中,PE和PP微塑料对樱桃萝卜种子的发芽率无显著(> 0.05)影响。
种子萌发试验表明,PE和PP对樱桃萝卜幼苗芽长的影响较弱,但两种微塑料能附着在樱桃萝卜根系表面,并在较高浓度(>1 g·L-1)时显著(< 0.05)抑制幼苗根伸长,且微塑料粒径越小、浓度越高,对根长的抑制作用越强。
土培条件下,PP和PE对樱桃萝卜叶片光合色素含量无显著影响(> 0.05)。
PE暴露下,樱桃萝卜生物量较对照组无显著(> 0.05)变化,但PP显著(< 0.05)降低了萝卜叶鲜重和根茎鲜重,表明PP对樱桃萝卜生长的抑制作用强于PE。
本研究通过种子萌发和土培试验初步探究了PE和PP两种微塑料对樱桃萝卜生长的影响,研究结果对于评估土壤微塑料污染风险具有重要意义。在后续的研究中,应重点分析微塑料暴露下蔬菜生理生化指标、土壤性质、土壤微生物活性等参数的变化,以此探究微塑料对蔬菜生长的影响途径。
[1] 骆永明, 周倩, 章海波, 等. 重视土壤中微塑料污染研究防范生态与食物链风险[J]. 中国科学院院刊, 2018, 33(10): 1021-1030.
[2] BARNES D K A, GALGANI F, THOMPSON R C, et al. Accumulation and fragmentation of plastic debris in global environments[J]. Philos Trans R Soc Lond B Biol Sci, 2009, 364(1526): 1985-1998.
[3] CÓZAR A, ECHEVARRÍA F, GONZÁLEZ-GORDILLO J I, et al. Plastic debris in the open ocean[J]. Proc Natl Acad Sci USA, 2014, 111(28): 10239-10244.
[4] LI J, SONG Y, CAI Y B. Focus topics on microplastics in soil: analytical methods, occurrence, transport, and ecological risks[J]. Environ Pollut, 2020, 257: 113570.
[5] NIZZETTO L, LANGAAS S, FUTTER M. Pollution: Do microplastics spill on to farm soils?[J] Nature, 2016, 537(7621): 488.
[6] TEUTEN E L, SAQUING J M, KNAPPE D R U, et al. Transport and release of chemicals from plastics to the environment and to wildlife[J]. Philos Trans R Soc Lond B Biol Sci, 2009, 364(1526): 2027-2045.
[7] BHATTACHARYA P, LIN S J, TURNER J P, et al. Physical adsorption of charged plastic nanoparticles affects algal photosynthesis[J]. J Phys Chem C, 2010, 114(39): 16556-16561.
[8] KOELMANS A A, BESSELING E, FOEKEMA E M. Leaching of plastic additives to marine organisms[J]. Environ Pollut, 2014, 187: 49-54.
[9] SETÄLÄ O, FLEMING-LEHTINEN V, LEHTINIEMI M. Ingestion and transfer of microplastics in the planktonic food web[J]. Environ Pollut, 2014, 185: 77-83.
[10] YU L, ZHANG J D, LIU Y, et al. Distribution characteristics of microplastics in agricultural soils from the largest vegetable production base in China[J]. Sci Total Environ, 2021, 756: 143860.
[11] ZHANG G S, LIU Y F. The distribution of microplastics in soil aggregate fractions in southwestern China[J]. Sci Total Environ, 2018, 642: 12-20.
[12] CHEN Y L, LENG Y F, LIU X N, et al. Microplastic pollution in vegetable farmlands of suburb Wuhan, central China[J]. Environ Pollut, 2020, 257: 113449.
[13] 廖苑辰, 娜孜依古丽·加合甫别克, 李梅, 等. 微塑料对小麦生长及生理生化特性的影响[J]. 环境科学, 2019, 40(10): 4661-4667.
[14] DONG Y M, GAO M L, SONG Z G, et al. Microplastic particles increase arsenic toxicity to rice seedlings[J]. Environ Pollut, 2020, 259: 113892.
[15] URBINA M A, CORREA F, ABURTO F, et al. Adsorption of polyethylene microbeads and physiological effects on hydroponic maize[J]. Sci Total Environ, 2020, 741: 140216.
[16] MENG F R, YANG X M, RIKSEN M, et al. Response of common bean (L.) growth to soil contaminated with microplastics[J]. Sci Total Environ, 2021, 755: 142516.
[17] 李贞霞, 李庆飞, 李瑞静, 等. 黄瓜幼苗对微塑料和镉污染的生理响应[J]. 农业环境科学学报, 2020, 39(5): 973-981.
[18] 叶子琪, 蒋小峰, 汤其阳, 等. 聚乙烯微塑料对蚕豆幼苗的毒性效应[J]. 南京大学学报(自然科学), 2021, 57(3): 385-392.
[19] LI Z X, LI Q F, LI R J, et al. Physiological responses of lettuce (L.) to microplastic pollution[J]. Environ Sci Pollut Res Int, 2020, 27(24): 30306-30314
[20] COLZI I, RENNA L, BIANCHI E, et al. Impact of microplastics on growth, photosynthesis and essential elements in Cucurbita pepo L[J]. J Hazard Mater, 2022, 423(Pt B): 127238.
[21] LI Z X, LI R J, LI Q F, et al. Physiological response of cucumber (L.) leaves to polystyrene nanoplastics pollution[J]. Chemosphere, 2020, 255: 127041.
[22] KALČÍKOVÁ G, GOTVAJN A Ž, KLADNIK A, et al. Impact of polyethylene microbeads on the floating freshwater plant duckweed[J]. Environ Pollut, 2017, 230: 1108-1115.
[23] LOZANO Y M, RILLIG M C. Effects of microplastic fibers and drought on plant communities[J]. Environ Sci Technol, 2020, 54(10): 6166-6173.
[24] PIGNATTELLI S, BROCCOLI A, RENZI M. Physiological responses of garden cress () to different types of microplastics[J]. Sci Total Environ, 2020, 727: 138609.
[25] DE SOUZA MACHADO A A, LAU C W, KLOAS W, et al. Microplastics can change soil properties and affect plant performance[J]. Environ Sci Technol, 2019, 53(10): 6044-6052
[26] 连加攀, 沈玫玫, 刘维涛. 微塑料对小麦种子发芽及幼苗生长的影响[J]. 农业环境科学学报, 2019, 38(4): 737-745.
[27] 张蜀秋. 植物生理学实验技术教程[M]. 北京: 科学出版社, 2011.
[28] 张彦, 窦明, 邹磊, 等. 不同微塑料赋存环境对小麦萌发与幼苗生长影响研究[J]. 中国环境科学, 2021, 41(8): 3867-3877.
[29] 张秀玲, 鄢紫薇, 王峰, 等. 微塑料添加对橘园土壤有机碳矿化的影响[J]. 环境科学, 2021, 42(9): 4558-4565.
[30] JIANG X F, CHEN H, LIAO Y C, et al. Ecotoxicity and genotoxicity of polystyrene microplastics on higher plant Vicia faba[J]. Environ Pollut, 2019, 250: 831-838.
[31] MATEOS-CÁRDENAS A, SCOTT D T, SEITMAGAN- BETOVA G, et al. Polyethylene microplastics adhere to(L.), yet have no effects on plant growth or feeding by(Lillj.) [J]. Sci Total Environ, 2019, 689: 413-421.
[32] QI Y L, YANG X M, PELAEZ A M, et al. Macro- and micro- plastics in soil-plant system: effects of plastic mulch film residues on wheat () growth[J]. Sci Total Environ, 2018, 645: 1048-1056.
[33] WANG F Y, ZHANG X Q, ZHANG S Q, et al. Interactions of microplastics and cadmium on plant growth and arbuscular mycorrhizal fungal communities in an agricultural soil[J]. Chemosphere, 2020, 254: 126791.
[34] 陶宗娅, 曹小卫, 罗学刚, 等. 几种土壤酶活性对低分子量聚乙烯的响应[J]. 土壤通报, 2012, 43(5): 1104-1110.
[35] 张祯明, 罗学刚, 樊有国, 等. 聚乙烯颗粒粉末对土壤化学性质的累积效应[J]. 环境科学与技术, 2015, 38(11): 115-119.
[36] QI Y L, BERIOT N, GORT G, et al. Impact of plastic mulch film debris on soil physicochemical and hydrological properties[J]. Environ Pollut, 2020, 266(Pt 3): 115097.
Effects of the growth of cherry radish affected by different microplastics
CUI Min, GAO Ran, YU Songguo, CHEN Xuehai, YU Yufei, LI Jia
(College of Environmental Science and Engineering, Yangzhou University, Yangzhou 225127)
To explore the effects of microplastics (MPs) on the growth of vegetables, taken two commonly detected MPs (i.e. polyethylene (PE) and polypropylene (PP)) in soils of cherry radish (L. var.) as the target contaminants, selected cherry radish as the tested materials, the effects of the tested MPs on the growth of radish were preliminary studied based on the seed germination test and the soil culture experiment. The results showed that PE and PP had no effect on the germination rate of radish seeds. The addition of MPs to the water had no significant effect on the bud length of seedlings, except for the treatment with 5 g·L-1of PP; the two tested MPs attached to the radish roots, and significantly (< 0.05) inhibited the growth of the root, moreover, this inhibitory effect enhanced with increasing MPs concentrations and decreasing MPs particle sizes. PE and PP had no significant impact on the photosynthetic pigment content in the cherry radish, furthermore, PE induced negligible impacts, while PP significantly (< 0.05) decreased the radish biomass, which indicated that the effects of MPs on the radish growth were related to MPs types. A plausible explanation is that PE and PP have various effects on soil structure and/or fertility, thereby resulting in different performances of radish biomass after exposure to PE and PP.
microplastics; cherry radish; root length; photosynthetic pigment; fresh weight
S631.1; X173
A
1672-352X (2022)06-0899-07
10.13610/j.cnki.1672-352x.20230106.012
2023-01-06 19:00:53
[URL] https://kns.cnki.net/kcms/detail//34.1162.S.20230106.1208.015.html
2022-01-07
国家自然科学基金(42007108)资助。
崔 敏, 博士,讲师。E-mail:007282@yzu.edu.cn
李 嘉,博士,讲师。E-mail:lijia3611@yzu.edu.cn

