巢湖河口区和敞水区浮游植物功能群分布及其影响因子
崔文建,郭匿春,李 静
巢湖河口区和敞水区浮游植物功能群分布及其影响因子
崔文建1,郭匿春1*,李 静2
(1. 安徽农业大学资源与环境学院,合肥 230036;2. 安徽省农业科学院水产研究所,水产增养殖安徽省重点实验室,合肥 230001)
为研究富营养化湖泊-巢湖浮游植物群落结构和功能及其生态学意义,在巢湖的主要河口区以及敞水区共设置了20个采样点,于2020年8月至2021年4月开展了4个季度的调查并对巢湖河口区和敞水区浮游植物功能群分布及其影响因子进行了分析。研究期间巢湖河口区共鉴定出浮游植物8门42属90种,敞水区共鉴定出浮游植物8门42属80种,河口区的平均丰度、平均生物量、平均Margalef丰富度指数和平均Shannon-Wiener多样性指数均比敞水区高,其中丰度差异显著(<0.05),生物量差异不显著,Margalef丰富度指数和Shannon-Wiener多样性指数差异极显著(<0.01)。按照FG功能群划分方法,巢湖河口区浮游植物的功能群组成与敞水区相似,根据优势度计算,河口区有M、Lo、H2、MP、X3共5个优势功能群,敞水区有M、H2、X3共3个优势功能群。通过巢湖河口区和敞水区浮游植物优势功能群与环境因子的RDA分析以及Pearson相关性分析发现,河口区和敞水区浮游植物优势功能群受到不同环境因子的影响:河口区影响浮游植物优势功能群的主要环境因子有水温(WT)、水深(WD)、pH、溶解氧(DO)、电导率(Cond)、总磷(TP)和高锰酸盐指数(CODMn);敞水区影响浮游植物优势功能群的主要环境因子有WT、WD、pH、DO、Cond、总氮(TN)和硝态氮(NO3--N)。通过对比发现WT、WD、pH、DO和Cond是共同影响河口区和敞水区浮游植物优势功能群的环境因子,且巢湖河口区浮游植物优势功能群受磷营养盐影响较大,敞水区受氮营养盐影响较大。上述结果表明巢湖河口区和敞水区浮游植物功能群受到的环境影响存在差异性,今后的巢湖富营养化治理工作必须要因地制宜,根据河口区和敞水区自身情况分别制定合理有效的控制对策,河口区可优先采取控磷措施,敞水区可优先采取控氮措施。
巢湖;河口区;敞水区;浮游植物功能群;环境因子; RDA分析;Pearson相关性分析
在湖泊这一生态系统中,浮游植物是极其重要的组成部分,因此关于湖泊浮游植物的生态学研究日益受到重视[1]。浮游植物常常用作水生态环境的指示生物[2],在国内外已经被广泛应用于生物监测、评价水质状况以及指示水体营养水平等领域[3]。传统的系统分类法和分子鉴定法都是根据物种同源性特点来反映不同生物间的进化关系[4],并不能很好地反映出浮游植物在整个水生态系统中的生态特征和生境类型以及水环境变化前后的群落结构[5]。因此有学者提出将形态、生理和生态系统相似的浮游植物归为一组并称之为一个功能群来代替用优势种分析和评价环境变化与浮游植物的响应。FG功能群划分法是最早由Reynolds提出的功能群系统,该方法将浮游植物数据和水体环境数据紧密地联系在一起,是所有划分方法当中考虑最多最全的,已经被广泛应用于生态学研究当中[6]。2009年Padisák等人将该划分法进一步完善,最终划分出满足大部分淡水水体的39个浮游植物功能群[7]。完善后的划分法可以很好地反映水生态系统特征、生境类型以及水环境的变化。
近年来随着人类生产生活范围的日益扩大,大量富含氮、磷的生活废水和工农业污水通过入湖河流排入到湖泊,引起水体富营养化,致使浮游植物在水体中大量繁殖,从而引起水华灾害频繁发生。河流是陆地生态系统和湖泊生态系统之间进行物质交换的重要通道,而湖泊的出入湖河口区又是兼有河流和湖泊特征的特殊区域。湖泊河口区是陆地生态系统与湖泊生态系统的重要生态过渡带,具有保持生物多样性、稳定相邻生态系统、拦截面源污染、提高湖滨景观生态等功能[8]。湖泊敞水区是湖泊水面的宽阔区域,水体相对稳定,透明度较高,营养物质循环受生物群落自身的影响较强[9]。关于湖泊河口区和敞水区的生态特征比较已有报道,如谢永宏等研究了澧水河口区与目平湖心区的基本生态特征,发现河口区和湖心区的水体理化特征、土壤理化特征和生物学特征存在相互作用和相互影响[10]。在此基础之上,陈心胜等根据河口区与湖心区的连通性,将河口区分为开放河口区和封闭河口区两类,以六门闸至小西湖样带为例,研究了洞庭湖封闭河口区与湖心区水体、土壤和植物等基本生态特征,发现湖心区的水流速度、透明度、有机质和氮含量均比河口区高,与河口区相比更加适宜于植物的生长繁殖,但是河口区具有相对较高的营养水平和电导率[11]。此外还有学者研究了太湖河口区和敞水区的高锰酸盐指数、营养盐含量以及有色可溶性有机物(CDOM),均发现存在显著的空间差异,河口区明显大于敞水区[12-13]。国内关于湖泊河口区和敞水区生物群落结构研究越来越多,多项研究发现鄱阳湖的浮游动物,太湖的轮虫、附着细菌与浮游细菌、纤毛虫等生物多样性,河口区显著大于敞水区,这表明湖泊不同区域的生物群落结构具有重要的生态学研究价值[14-17]。浮游植物作为湖泊生态系统中重要的组成部分,开展湖泊河口区和敞水区的浮游植物群落结构研究也是非常有意义的。
富营养化湖泊-巢湖流域水系主要支流发源于大别山区,自西向东注入并流经巢湖,由裕溪河进入长江,以巢湖为中心,四周河流呈放射状注入。巢湖入湖河流约33条,其中主要入湖河流有8条,包括十五里河、派河、南淝河、杭埠河、白石天河、兆河、柘皋河和双桥河[18],有资料表明通过入湖河流进入巢湖的总氮、总磷分别占总氮、总磷总输入量的76.9%和68.5%[19]。巢湖是中国五大淡水湖泊之一,是长江中下游重要的湿地和生态屏障,巢湖水质治理和生态系统维护对保护长江和中国淡水资源具有重要意义。为了维护巢湖水生态系统,刘贞秋等于1984年对巢湖水生态系统重要的组成部分-浮游植物进行了初步研究,发现西湖区浮游植物丰度大于东湖区,东西湖区均为河口区>湖心区>沿岸[20]。此后虽然有众多学者对巢湖的浮游植物群落结构开展过研究,但是关于巢湖河口区和敞水区这两种不同生境中浮游植物的群落组成和水平分布差异的深入研究尚鲜见报道[21-23]。本研究在此基础之上利用功能群概念对巢湖主要入湖河口区和敞水区的浮游植物进行监测分析和功能群划分,明确巢湖河口区和敞水区浮游植物功能群组成和水平分布,探讨浮游植物优势功能群与环境因子的关系,以期为巢湖及相关湖泊的水环境保护和生态系统修复提供科学的参考依据。
1 材料与方法
1.1 采样点设置
2020年8月(夏季)、2020年11月(秋季)、2021年1月(冬季)和2021年4月(春季)利用快艇在巢湖进行全湖区采样,共20个采样点全部按照《全国湖泊富营养化调查规范(第二版)》进行设置[24],具体如图1所示。其中于巢湖主要入湖河口区设置了8个采样点E1-E8,敞水区设置了12个采样点P1-P12。河口区采样点E1至E8顺序依次对应:十五里河、派河、南淝河、杭埠河、白石天河、兆河、柘皋河、双桥河。采样点P1-P4为西半湖敞水区,P5-P8为中部敞水区,P9-P12为东半湖敞水区。

图1 巢湖采样点分布图
Figure 1 Distribution of sampling sites in Chaohu Lake
1.2 浮游植物样品采集及鉴定
浮游植物定性样品用孔径约0.064 mm的25号浮游生物网在水面下约0.5 m处以适当的速度作“∞”字形来回拖动1~3 min,获得的浓缩样放入50 mL的白色小方瓶中,并添加2 mL的甲醛溶液保存。定量样品采用5 L有机玻璃采水器根据水层深度分表层(水下0.5 m)和底层(距底0.5 m)采集混合水样后用1 L样品瓶装满,并立即加入15 mL鲁哥试剂固定,带回实验室后静置48 h后虹吸浓缩至50 mL,充分摇匀后,迅速吸取0.1 mL样品到浮游生物计数框内,盖上盖玻片,在显微镜下进行鉴定并计数。种类鉴定参照《中国淡水藻类—系统,分类及生态》[25]以及《淡水微型生物图谱》[26],浮游植物生物量的计算参照章宗涉研究方法[27],功能群划分参照Padisák等人完善的FG功能群划分法[7]。
1.3 水体理化指标测定
水温(WT)、pH、溶解氧(DO)、电导率(Cond)等指标现场用多功能便携式水质分析仪YSI 6600现场测定。水体透明度(SD)主要采用Secchi盘现场测定,水深(WD)采用水深仪现场测定。水化指标检测主要参照国家环境保护总局的《水和废水监测分析方法》[28],总氮(TN)浓度采用碱性过硫酸钾消解法测定,总磷(TP)浓度采用过硫酸钾消解法测定,氨氮(NH4+-N)浓度采用纳氏试剂分光光度法测定,硝态氮(NO3--N)和亚硝态氮(NO2--N)浓度均采用分光光度法测定,高锰酸盐指数(CODMn)采用高锰酸钾消解滴定法测定。
1.4 数据处理与统计分析
将浮游植物优势功能群代替整体进行研究分析可以较好地反映水体环境的变化[29],因此根据浮游植物功能群的出现频率及相对丰度来分别计算河口区和敞水区的浮游植物功能群优势度(Y),当Y≥0.02时定义为优势功能群[30]。为了避免单一生物指数对结果造成偏差,同时运用Margalef丰富度指数和Shannon-Wiener多样性指数进行浮游植物群落多样性分析[31]。
式中,n为物种的个体数,f为物种出现的频率,为所有物种的总个体数,为总物种数;0<<3表示-中污-重污型,3<<4表示-中污型,4<<5表示寡污型,>5表示清洁;0<<1表示多污型,1<<2表示a-中污型,2<<3表示b-中污型,>3表示寡污型。
运用Microsoft Excel 2010、SPSS 25.0、Origin 2018进行数据统计分析。运用CANOCO 4.5软件分别分析巢湖河口区和敞水区浮游植物优势功能群与环境因子之间的关系,环境参数除pH外经最大标准化lg(X+1)预处理后作为环境数据源,浮游植物丰度数据作为生物数据源,构成种类与环境因子矩阵,对浮游植物群落分布进行DCA(去趋势对应分析),得出物种的单峰响应值SD(梯度),发现单峰响应值SD<3,再对数据进行999次蒙特卡洛置换检验,判定显著影响浮游植物优势功能群特征的环境因子后,主要采用RDA(冗余分析)和Pearson相关性分析对巢湖河口区和敞水区浮游植物优势功能群与环境因子之间的关系进行研究。
2 结果与分析
2.1 巢湖水环境因子变化情况
采样期间,WT变化范围为7.3~30.9 ℃,SD变化范围为15.0~60.0 cm,WD变化范围为1.1~6.0 m,DO变化范围为1.49 ~12.70 mg·L-1,Cond变化范围为144.40~438.40 s·m-1,pH变化范围为7.14~9.45,为弱碱性水体。巢湖水体TN平均含量为1.47 mg·L-1,不同季节以及不同采样点TN含量相差较大,如2021年 4月(春季)的P1采样点TN含量仅为0.12 mg·L-1,而2021年4月(春季)位于派河河口的E2采样点TN含量高达5.48 mg·L-1;巢湖水体TP平均含量为0.13 mg·L-1,TP的时空变化范围也较大,如2021年1月(冬季)位于十五里河、派河、南淝河的E1、E2、E3采样点TP含量均为最低值0.02 mg·L-1,2020年11月(秋季)位于双桥河的E8采样点TP含量为最高值0.45 mg·L-1。NH4+-N、NO3--N、NO2--N、CODMn也具有类似的时空差异。从平均值大小来看,这6项营养盐指标均呈现出河口区大于敞水区的现象。运用SPSS 25.0软件进行单因素方差(one-way ANOVA)分析,发现TN、NO3--N存在极显著的空间差异(<0.01),NO2--N存在显著的空间差异(<0.05),而TP、NH4+-N和CODMn空间差异不显著。

表1 巢湖河口区和敞水区环境特征(表中数值为平均值±标准差)

图2 巢湖河口区浮游植物种类组成及所占百分比
Figure 2 Species composition and percentage of phytoplankton in the estuary area
2.2 浮游植物群落组成和空间分布特征
在巢湖河口区8个采样点中共鉴定出浮游植物8门42属90种(图2),其中绿藻门种类最多,共发现13属31种,占总种类数的34.44%;其次是蓝藻门14属27种,占总种类数的30.00%:裸藻门3属14种,占总种类数的15.56%:硅藻门8属11种,占总种类数的12.22%;隐藻门1属3种,金藻门1属2种,黄藻门1属1种,甲藻门1属1种,分别占总种类数的3.33%、2.22%、1.11%和1.11%;在巢湖敞水区12个采样点中共鉴定出浮游植物8门42属80种(图3),其中绿藻门种类最多,共发现14属29种,占总种类数的36.25%;其次是蓝藻门13属23种,占总种类数的28.75%:裸藻门3属12种,占总种类数的15.00%:硅藻门7属9种,占总种类数的11.25%;隐藻门1属3种,金藻门2属2种,黄藻门1属1种,甲藻门1属1种,分别占总种类数的3.75%、2.50%、1.25%和1.25%。巢湖河口区的浮游植物种类组成与敞水区相比较为丰富,但是空间分布差异不显著。

图3 巢湖敞水区浮游植物种类组成及所占百分比
Figure 3 Species composition and percentage of phytoplankton in the Pelagic area
巢湖河口区和敞水区浮游植物平均丰度为1.224´107cells·L-1和1.019´107cells·L-1,平均生物量分别为3.55 mg·L-1和3.46 mg·L-1。河口区Margalef丰富度指数范围为2.08~6.20,平均为3.87,Shannon-Wiener多样性指数范围为1.40~3.42,平均为2.54;敞水区Margalef丰富度指数范围为1.18~5.69,平均为3.04,Shannon-Wiener多样性指数范围为0.32~3.68,平均为2.19(表2)。河口区的平均丰度、平均生物量、平均Margalef丰富度指数和平均Shannon-Wiener多样性指数均比敞水区高,其中丰度差异显著(<0.05),生物量差异不显著, Margalef丰富度指数和Shannon-Wiener多样性指数差异极显著(<0.01)。按照Margalef丰富度指数和Shannon-Wiener多样性指数的水质划分标准,发现两种指数的划分结果一致,巢湖河口区和敞水区的水质类型均为b-中污
2.3 浮游植物功能群组成及优势功能群划分
整体上巢湖浮游植物可划分为25个功能群,分别为C、D、E、F、G、H1、H2、J、Lo、LM、M、MP、N、P、S1、S2、SN、T、TC、W1、W2、Wo、X1、X2、Y。各浮游植物功能群的代表性种(属)及生境特征见表3。X3、MP、J、W1、H2、Y、Lo、C、M、W2、X1共计11个功能群出现频率均在50%以上,出现频率较高,为巢湖常见的功能群;T、 D、F、P、Wo共计5个功能群出现频率在30%~50%之间,出现频率相对较低; E、S1、H1、TC、SN、N、LM、S2、G共计9个功能群出现频率低于30%(图4)。巢湖河口区和敞水区浮游植物功能群组成相似,河口区可划分为24个功能群,敞水区可划分为25个功能群,相比之下G功能群代表种(属)仅在敞水区中被发现,从G功能群生境特征进行分析,由于河口区水体不属于静止水体可能导致G功能群不适宜在河口区生长繁殖。巢湖河口区和敞水区浮游植物功能群优势度见图5,按照优势功能群划分标准(Y≥0.02),河口区有5个优势功能群,分别为M、Lo、H2、MP、X3,敞水区有3个优势功能群,分别为M、H2、X3。

表2 巢湖河口区和敞水区浮游植物丰度、生物量和生物多样性(表中数值为平均值及其范围)
2.4 河口区和敞水区浮游植物优势功能群与环境因子的关系分析
分别对巢湖河口区和敞水区的浮游植物群落分布进行DCA分析,得出物种的单峰响应值SD(梯度)分别为1.797、2.347,均小于3,因此选择线性模型RDA对优势功能类群与环境变量进行排序分析。采用999次蒙特卡洛置换检验对浮游植物优势功能群丰度数据和12个环境因子进行显著性检验。通过筛选,河口区有7个环境因子具有显著解释性,分别为WT、WD、pH、DO、Cond、TP和CODMn;敞水区也有7个环境因子具有显著解释性,分别为WT、WD、pH、DO、Cond、TN和NO3--N。蒙特卡洛置换检验结果表明WT、WD、pH、DO和Cond是共同影响河口区和敞水区浮游植物优势功能群的环境因子(图6)。
河口区浮游植物优势功能群和环境因子的RDA分析结果表明,第一、二轴的特征值分别为0.758、0.022,共解释了78.0%的物种信息与99.7%的物种-环境信息(表4)。敞水区浮游植物优势功能群和环境因子的RDA分析结果表明,第一、二轴的特征值分别为0.585、0.003,共解释了58.8%的物种信息与100.0%的物种-环境信息(表4)。这表明河口区和敞水区浮游植物优势功能群与环境因子之间存在明显的相关性。同时选取浮游植物优势功能群丰度数据与水环境因子进行Pearson相关性分析。综合这两种分析结果发现:河口区中的M功能群与WT(=0.744,<0.01)、CODMn(=0.463,<0.01)呈极显著正相关,与WD(=0.269,<0.05)呈显著正相关,与Cond(=-0.516,<0.01)呈极显著负相关,与DO(=-0.400,<0.05)呈显著负相关;Lo功能群与WT(=0.639,<0.01)呈极显著正相关,与CODMn(=0.386,<0.05)呈显著正相关,与Cond(=-0.471,<0.01)呈极显著负相关,与DO(=-0.382,<0.05)呈显著负相关;H2功能群与WT(=0.493,<0.01)呈极显著正相关,与pH(=0.373,<0.05)、TP(=0.418,<0.05)呈显著正相关;MP功能群与pH(=0.387,<0.05)、TP(=0.373,<0.05)呈显著正相关;X3功能群与WT(=-0.379,<0.05)、TP(=-0.417,<0.05)呈显著负相关(表5)。敞水区中 M功能群与WT(=0.710,<0.01)、WD(=0.392,<0.01)、pH(=0.601,<0.01)呈极显著正相关,与Cond(=-0.519,<0.01)、NO3--N(=-0.544,<0.01)呈极显著负相关,与DO(=-0.323,<0.05)、TN(=-0.048,<0.05)呈显著负相关;H2功能群与TN(=0.028,<0.05)呈显著正相关;X3功能群与pH(=0.299,<0.05)呈显著正相关(表6)。

表3 巢湖浮游植物功能群组成
注: “ü”表示存在,“û”表示不存在。

图4 浮游植物功能群频率分布
Figure 4 Frequency distribution of phytoplankton functional groups
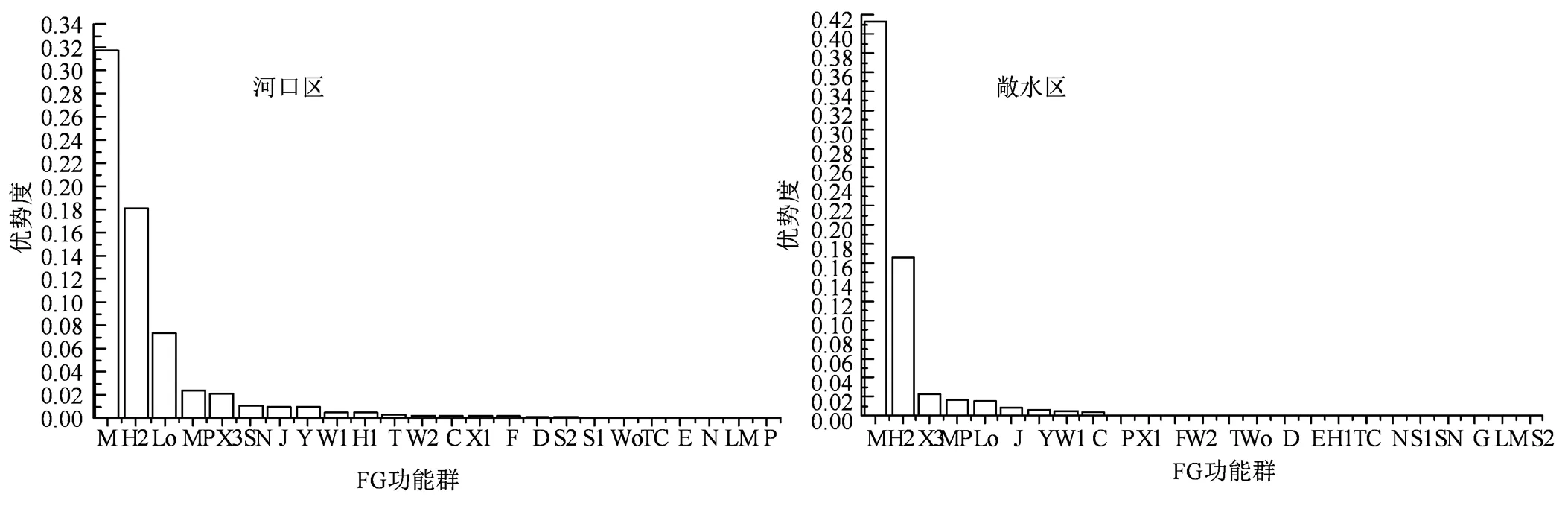
图5 巢湖河口区和敞水区浮游植物功能群优势度
Figure 5 Dominance of phytoplankton functional groups in the estuary and pelagic area of Chaohu Lake

图6 河口区和敞水区浮游植物优势功能群与主要环境因子的RDA分析
Figure 6 RDA analysis of phytoplankton dominant functional groups and main environmental factors in the estuary and pelagic area

表4 浮游植物优势功能群与环境因子RDA分析

表5 河口区浮游植物优势功能群丰度与水环境因子的Pearson相关性分析
注:*表示在0.05水平上显著相关(双侧);**表示在0.01水平上显著相关(双侧)。下同。

表6 敞水区浮游植物优势功能群丰度与水环境因子的Pearson相关性分析
3 讨论
3.1 巢湖河口区和敞水区的环境特征以及浮游植物结构特征比较
本研究显示,巢湖河口区和敞水区的WT、SD、WD、DO、Cond和pH均在正常范围内波动。巢湖河口区的TN、TP、NH4+-N、NO3--N、NO2--N和CODMn这6项指标均比敞水区高,这表明河口区水体受到的污染程度要高于敞水区水体。河口区共鉴定出90种浮游植物,敞水区共鉴定出80种浮游植物,河口区和敞水区中绿藻门和蓝藻门都是主要的类群,蓝藻门中的微囊藻属和鱼腥藻属对其丰度值贡献量较大,使得蓝藻门的丰度要远远高于其他七大藻门。本调查发现巢湖河口区和敞水区浮游植物的功能群组成相似,河口区有5个优势功能群,分别为M、Lo、H2、MP、X3,敞水区有3个优势功能群,分别为M、H2、X3。以微囊藻属为主的M功能群和以鱼腥藻属为主的H2功能群在巢湖河口区和敞水区均为优势功能群,并且M功能群和H2功能群的优势度远远高于其他优势功能群。将本调查结果与前期的巢湖浮游植物群落调查结果对比分析发现,尽管对于具体物种的调查结果存在一些差异,但是总体上巢湖湖体以微囊藻属和鱼腥藻属为主要水华物种的格局尚未改变。
水体理化指标包括TN、TP、NH4+-N、NO3--N、NO2--N和CODMn均呈现出河口区大于敞水区,分析其原因可能是一些入湖河流作为重要的水运通道,来往船只的频繁扰动,使得底泥沉积物中的营养盐加速向河口区的水体中释放,以及入湖河流两岸分布的工厂和现代农业的迅速发展使得大量的化肥、农药、城市污水、工业废水排入到河流中,继而在河口区聚集。我国一直以水质参数来代表水环境质量,但水质参数仅能代表水生态系统的化学特征,并不能代表其生物特征及栖息地质量[32]。本调查发现巢湖河口区和敞水区浮游植物的功能群组成相似,但是具体的优势种及其优势度存在差别,这进一步证明了巢湖河口区和敞水区的水环境状况存在异质性,并且该现象与李静等人关于夏季蓝藻水华期间太湖河口区和敞水区的纤毛虫群落调查结果具有一致性[17]。
通过浮游植物丰度、生物量、Margalef 丰富度指数和Shannon-Wiener多样性指数的计算,发现河口区的平均丰度、平均生物量、平均Margalef丰富度指数和平均Shannon-Wiener多样性指数均比敞水区高,其中丰度差异显著(<0.05),生物量差异不显著,Margalef丰富度指数和平均Shannon-Wiener多样性指数差异极显著(<0.01),该结果体现了巢湖河口区作为生态过渡带所存在的边缘效应,并且在性质上表现为正效应[8]。按照Margalef丰富度指数和Shannon-Wiener多样性指数的水质划分标准,发现两种指数的划分结果一致,巢湖河口区和敞水区的水质类型均为b-中污,表明当前巢湖的水质状况虽然与过去几年相比有所改善但仍然不容乐观。基于以上分析结果,发现巢湖河口区和敞水区环境特征以及浮游植物结构特征存在差异性,这使得研究巢湖河口区和敞水区浮游植物功能群分布具有很高的研究价值和现实意义。
3.2 巢湖河口区和敞水区浮游植物优势功能群与水环境因子的关系
水温、光照、营养盐状况、水文动态等都能对浮游植物功能群组成产生影响,是决定浮游植物出现或消失的重要因素[33]。本研究中浮游植物优势功能群与环境因子的RDA分析以及Pearson相关性分析发现,河口区和敞水区浮游植物优势功能群受到不同环境因子的影响。河口区影响浮游植物优势功能群的主要环境因子有WT、WD、pH、DO、Cond、TP和CODMn,敞水区影响浮游植物优势功能群的主要环境因子有WT、WD、pH、DO、Cond、TN和NO3--N。通过对比发现,WT、WD、pH、DO和Cond是共同影响河口区和敞水区浮游植物优势功能群的环境因子。近年来随着巢湖周边经济和工农业生产的快速发展,大量的氮、磷营养盐输入使巢湖水体面临富营养化问题,因此氮、磷营养盐是影响巢湖浮游植物功能群的重要环境因子[34]。RDA分析以及Pearson相关性分析均得出,巢湖河口区的浮游植物优势功能群受TP影响较大,巢湖敞水区的浮游植物优势功能群受TN和NO3--N影响较大。巢湖河口区TP平均值为0.15 mg·L-1, 冬季的十五里河、派河、南淝河河口区的TP浓度达到最低值,为0.02 mg·L-1,秋季双桥河河口区的TP浓度达到最高值,为0.45 mg·L-1。巢湖流域本身就是富磷地区,巢湖周边存在有大量的磷矿,磷通过雨水冲刷进入巢湖,给浮游植物提供了良好的生长条件[35]。磷是湖泊富营养化的主要限制性因子,且有研究表明,TP的浓度在0.02 mg·L-1时就足以引起湖泊富营养化的发生[36],冬季十五里河、派河、南淝河河口区的TP浓度为0.02 mg·L-1,正好达到引起湖泊富营养化的条件。巢湖河口区水体中有如此高的TP浓度,对巢湖是一个巨大的生态威胁。巢湖敞水区TN平均值为1.45 mg·L-1,春季P1位点的TN浓度达到最低值,为0.12 mg·L-1,秋季P5位点的TN浓度达到最高值,为3.64 mg·L-1。巢湖敞水区NO3--N平均值为0.96 mg·L-1,夏季P1位点的NO3--N浓度达到最低值,为0.14 mg·L-1,冬季的P12位点的NO3--N达到最高值,为2.29 mg·L-1。氮是生物生长所必须的元素,水体中的一些藻类主要是蓝藻门类具有固氮能力,能够把大气中的氮转化为被水生植物吸收和利用的硝酸盐类,因而使得藻类能够获得充足的氮营养元素。无机氮形式的氮素是浮游植物优先吸收利用氮的主要形式,路娜等人对巢湖的研究发现NO3--N是影响浮游植物分布的重要因素[21]。工业废水、生活污水中含有大量的氮营养物质,还有农业生产过程中大量使用化肥、农药,它们中的很大一部分会通过地表径流最终排入到水体中。巢湖敞水区浮游植物优势功能群受氮营养盐影响较大,表明巢湖流域氮循环的固氮过程被不断强化而造成水体氮负荷的增加是巢湖水体富营养化形成的一个重要原因[37]。
采样期间WT变化范围为7.3~30.9℃,河口区的M、Lo、H2功能群和敞水区的M功能群与WT均呈极显著正相关,河口区的X3功能群与WT呈显著负相关;采样期间WD变化范围为1.1~6.0 m,河口区的M功能群与WD呈显著正相关,敞水区的M功能群与WD呈极显著正相关;采样期间pH变化范围为7.14~9.45,河口区的H2、MP功能群和敞水区的X3功能群与pH均呈显著正相关,敞水区的M功能群与pH呈极显著正相关。采样期间DO变化范围为1.49 ~12.70 mg·L-1,河口区的M、Lo 功能群和敞水区的M功能群与DO均呈显著负相关;采样期间Cond变化范围为144.40 ~438.40 s·m-1,河口区的M、Lo功能群和敞水区的M功能群与Cond均呈极显著负相关。WT是影响浮游植物功能群季节演替的主要因子,浮游植物进行光合作用和营养物质运输转换的酶系统活性直接与温度相关,本研究采取的是季度采样,水温不可避免地成为关键性因子[38]。水深可以通过影响光照强度和水体热力学状态,进而影响到浮游植物的群落组成[39]。水环境pH对浮游植物的生长影响也很大,不同种类的浮游植物其最适pH范围也不一样,因此可以通过调节水体pH来控制浮游植物[40]。浮游植物的光合作用会消耗大量的二氧化碳,使得水体中的DO含量增加,因此浮游植物的生长会显著影响DO含量,巢湖水体中DO含量的测定可以较好地反映水体中浮游植物的生长状况和巢湖的污染程度[41-42]。Cond与浮游植物的生长和繁殖密切相关,Cond的测定可以间接推测浮游植物的丰度和水质状况[43]。综上所述,除营养盐外,WT、WD、pH、DO和Cond对巢湖浮游植物功能群的组成也有重要影响。此外CODMn只对巢湖河口区的浮游植物优势功能群产生了影响,CODMn是指采用一定的强氧化剂处理水样时所消耗的氧化剂量,它能够直接反映出水体受到还原性物质污染的程度,这进一步表明巢湖河口区受到的污染程度要高于敞水区。在许多关于浮游植物功能群和环境因子关系的研究中,CODMn都是重要的影响因子[44-45]。
3.3 巢湖富营养化控制对策
氮磷营养盐的高含量是巢湖发生富营养化的主要原因,因此巢湖富营养治理工作的根本出发点就是控制氮磷营养盐的含量。河口区的浮游植物优势功能群主要受 TP的影响,敞水区的浮游植物优势功能群主要受 TN 和 NO3--N 的影响,河口区浮游植物优势功能群受磷营养盐影响较大,敞水区受氮营养盐影响较大。通常观点认为海洋中浮游植物的生长受氮限制,湖泊中受磷限制,河口可能是氮和磷交替控制[46],本研究之所以会出现不同的结论,分析其原因可能是前期的研究在进行分析时只考虑到了浮游植物的个别优势种,而不包括鉴定出来的所有浮游植物种类。对于湖泊富营养化治理是控磷还是控氮,学术界一直存在争议,一种观点认为磷是浮游植物生长的主要限制因子,只需控磷,另一种观点认为氮也是浮游植物主要的生长限制因子,必须控氮[47],还有学者认为富营养化治理应放宽控氮、集中控磷[48]。本研究发现巢湖河口区和敞水区浮游植物功能群分布以及受环境因子影响存在差异性,因此今后的巢湖富营养治理工作可以因地制宜,根据河口区和敞水区自身情况分别制定合理有效的控制对策。
国外学者归纳出一个关于水体富营养化和氮磷控制的普适性规律,即在数月至数年的尺度上,只有控磷才能长期有效地治理水体富营养化及蓝藻水华,该规律适用于水交换率较低的湖泊、水库和池塘,也适用于河口水体[49]。因此在巢湖河口区优先采取控磷措施可以较好地控制浮游植物和治理水体富营养化。针对河口区大量的化肥、农药、城市污水和工业废水排放,可以在河口区条件适宜地段,根据现有的地形特征,选择合适的水生植物进行湿地建设,并通过人工参与构建的方式,合理布局、配水,提高其磷营养盐的削减能力。同时必须对现有的污水处理设施进行升级以达到国家或地方规定的关于污水中磷营养盐排放标准的最低要求,从而实现巢湖河口区藻类水华控制和水体富营养化治理。巢湖敞水区面临的主要问题是自1962年巢湖裕溪闸建成后,虽然发挥了巨大的防洪调控功能,但也使得巢湖与长江每年水体交换量大量减少,水体自净能力急剧下降,一方面造成氮营养盐不能有效输出,另一方面又造成浮游植物大量繁殖。但是随着引江济巢工程的实施,巢湖水交换得到加快,提高了水体自净能力,在一定程度上增加了环境容纳量。巢湖敞水区可以优先采取控氮措施,通过生物操纵的方法,即利用水生生物对氮营养盐进行吸收利用和代谢,从而达到减轻污染负荷和调节生态平衡的目的[50]。此外在经济条件许可时,可以在巢湖的敞水区采用底泥疏浚工程的方法进行治理。底泥疏浚是一种快速去除沉积物中氮营养盐的物理方法,从已经实施的富营养化湖泊底泥疏浚工程的效果来看,在短期内疏挖对于湖水水质改善作用较为明显[51]。综上所述,本研究认为针对巢湖的富营养化治理,河口区可以优先采取控磷措施,敞水区可以优先采取控氮措施。
[1] 田永强. 淡水浮游植物功能类群划分方法及其生态学应用研究进展[J]. 亚热带植物科学, 2015, 44(4): 349-354.
[2] JAKHAR P. Role of phytoplankton and zooplankton as health indicators of aquatic ecosystem: a review [J]. International Journal of Innovative Research &Studies, 2013, 2(12):489-500.
[3] UGBEYIDE J A, UGWUMBA O A. Water Quality and Phytoplankton as Indicators of Pollution in Ibuya River[J]. British Journal of Environmental Sciences, 2021, 9(1): 26-39.
[4] SALMASO N, NASELLI-FLORES L, PADISÁK J. Functional classifications and their application in phytoplankton ecology[J]. Freshw Biol, 2015, 60(4): 603-619.
[5] 安瑞志, 潘成梅, 塔巴拉珍, 等. 西藏巴松错浮游植物功能群垂直分布特征及其与环境因子的关系[J]. 湖泊科学, 2021, 33(1): 86-101.
[6] REYNOLDS C S, HUSZAR V, KRUK C, et al. Towards a functional classification of the freshwater phytoplankton[J]. J Plankton Res, 2002, 24(5): 417-428.
[7] PADISÁK J, REYNOLDS C S. Selection of phytoplankton associations in Lake Balaton, Hungary, in response to eutrophication and restoration measures, with special reference to the cyanoprokaryotes[J]. Hydrobiologia, 1998, 384(1/2/3): 41-53.
[8] 郭沛涌, 沈焕庭. 河口浮游植物生态学研究进展[J]. 应用生态学报, 2003, 14(1): 139-142.
[9] 温展明, 徐健荣, 林秋奇, 等. 流溪河水库敞水区轮虫多样性与群落的动态特征[J]. 生态学报, 2017, 37(4): 1328-1338.
[10] 谢永宏, 李锋, 侯志勇, 等. 澧水河口区与目平湖心区的基本生态特征[J]. 生态科学, 2008, 27(6): 439-445.
[11] 陈心胜, 谢永宏, 李峰, 等. 洞庭湖封闭河口区与湖心区的基本生态特征: 以六门闸至小西湖样带为例[J]. 生态与农村环境学报, 2010, 26(5): 502-507.
[12] 朱广伟. 太湖水质的时空分异特征及其与水华的关系[J]. 长江流域资源与环境, 2009, 18(5): 439-445.
[13] 刘明亮, 张运林, 秦伯强. 太湖入湖河口和开敞区CDOM吸收和三维荧光特征[J]. 湖泊科学, 2009, 21(2): 234-241.
[14] 陈佳琪, 赵坤, 曹玥, 等. 鄱阳湖浮游动物群落结构及其与环境因子的关系[J]. 生态学报, 2020, 40(18): 6644-6658.
[15] 杨桂军, 秦伯强, 高光, 等. 太湖不同湖区轮虫群落结构季节变化的比较研究[J]. 环境科学, 2008, 29(10): 2963-2969.
[16] 宋玉芝, 赵淑颖, 黄瑾, 等. 太湖水体附着细菌和浮游细菌的丰度与分布特征[J]. 环境工程学报, 2013, 7(8): 2825-2831.
[17] 李静, 卢文轩, 张雷燕, 等. 夏季蓝藻水华期间太湖河口区和敞水区纤毛虫群落组成及水平分布[J]. 水生生物学报, 2014, 38(5): 860-867.
[18] 张民, 孔繁翔. 巢湖富营养化的历程、空间分布与治理策略(1984—2013年)[J]. 湖泊科学, 2015, 27(5): 791-798.
[19] 安徽省规划编制领导小组. 巢湖流域综合防治规划(2001—2015)[R],2001.
[20] 刘贞秋, 蒙仁宪. 巢湖浮游藻类的初步研究[J]. 安徽大学学报(自然科学版), 1988, 12(4): 62-70.
[21] 路娜, 尹洪斌, 邓建才, 等. 巢湖流域春季浮游植物群落结构特征及其与环境因子的关系[J]. 湖泊科学, 2010, 22(6): 950-956.
[22] 孟小丽, 邓道贵, 张赛, 等. 巢湖春夏季节浮游植物的动态变化[J]. 生态科学, 2011, 30(2): 189-194.
[23] JIANG Y J, HE W, LIU W X, et al. The seasonal and spatial variations of phytoplankton community and their correlation with environmental factors in a large eutrophic Chinese Lake (Lake Chaohu)[J]. Ecol Indic, 2014, 40: 58-67.
[24] 金相灿,屠清瑛. 湖泊富营养化调查规范[M]. 2版. 北京:中国环境科学出版社,1990.
[25] 胡鸿钧, 魏印心. 中国淡水藻类: 系统、分类及生态[M]. 北京: 科学出版社, 2006.
[26] 周凤霞, 陈剑虹. 淡水微型生物图谱[M]. 北京: 化学工业出版社, 2005.
[27] 章宗涉,黄祥飞. 淡水浮游生物研究方法[M].北京:科学出版社,1991.
[28] 国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法 [M].4版. 北京: 中国环境出版社, 2002.
[29] LAMPITT R S, WISHNER K F, TURLEY C M, et al. Marine snow studies in the Northeast Atlantic Ocean: distribution, composition and role as a food source for migrating plankton[J]. Mar Biol, 1993, 116(4): 689-702.
[30] 尹子龙. 达里湖自然保护区浮游植物功能群特征研究[D]. 哈尔滨: 东北林业大学, 2017.
[31] 董立新, 周绪申. 浮游植物多样性指数在内陆水体污染类型评价中的应用简述[J]. 海河水利, 2017(5): 57-60.
[32] 高俊峰, 蔡永久, 夏霆. 巢湖流域水生态健康研究[M]. 北京: 科学出版社, 2016.
[33] 黄国佳, 李秋华, 陈椽, 等. 贵州高原三板溪水库浮游植物功能群时空分布特征[J]. 环境科学学报, 2015, 35(2): 418-428.
[34] 李怀国, 杨长明, 王育来. 巢湖水质现状及浮游生物群落结构特征[J]. 安徽农业科学, 2017, 45(22): 13-16.
[35] 谢平. 翻阅巢湖的历史: 蓝藻、富营养化及地质演化[M]. 北京: 科学出版社, 2009.
[36] 舒金华, 黄文钰, 吴延根. 中国湖泊营养类型的分类研究[J]. 湖泊科学, 1996, 8(3): 193-200.
[37] 叶琳琳, 吴晓东, 刘波, 等. 太湖西北湖区浮游植物和无机、有机氮的时空分布特征[J]. 湖泊科学, 2017, 29(4): 859-869.
[38] 方丽娟, 刘德富, 杨正健, 等. 水温对浮游植物群落结构的影响实验研究[J]. 环境科学与技术, 2014, 37(S2): 45-50.
[39] DE SOUSA D N R, MOZETO A A, CARNEIRO R L, et al. Electrical conductivity and emerging contaminant as markers of surface freshwater contamination by wastewater[J]. Sci Total Environ, 2014, 484: 19-26.
[40] 谭亚, 吴晓东, 杨梓文, 等. 大冶市城市湖泊夏季浮游植物群落结构及其影响因子[J]. 水利水电技术(中英文), 2021, 52(6): 130-142.
[41] 刘川, 闫金霞, 刘家乐, 等. 青龙湖浮游植物群落与环境因子相关性分析[J]. 人民黄河, 2021, 43(7): 104-109.
[42] 赵秀侠, 方婷, 杨坤, 等. 安徽沱湖夏季浮游植物群落结构特征与环境因子关系[J]. 植物科学学报, 2018, 36(5): 687-695.
[43] 许海, 刘兆普, 袁兰, 等. pH对几种淡水藻类生长的影响[J]. 环境科学与技术, 2009, 32(1): 27-30.
[44] NEAL C, HOUSE W, JARVIE H P, et al. The water quality of the River Dun and the Kennet and Avon Canal[J]. J Hydrol, 2006, 330(1/2): 155-170.
[45] 张莹莹, 张经, 吴莹, 等. 长江口溶解氧的分布特征及影响因素研究[J]. 环境科学, 2007, 28(8): 1649-1654.
[46] 张平, 沈志良. 营养盐限制的水域性特征[J]. 海洋科学, 2001, 25(6): 16-19.
[47] 刘伟, 晏娟. 富营养化湖泊治理研究综述[J]. 安徽农学通报, 2014, 20(8): 121-122, 150.
[48] 王海军, 王洪铸. 富营养化治理应放宽控氮、集中控磷[J]. 自然科学进展, 2009, 19(6): 599-604.
[49] SCHINDLER D W, HECKY R E, FINDLAY D L, et al. Eutrophication of lakes cannot be controlled by reducing nitrogen input: results of a 37-year whole-ecosystem experiment[J]. Proc Natl Acad Sci USA, 2008, 105(32): 11254-11258.
[50] 刘恩生. 生物操纵与非经典生物操纵的应用分析及对策探讨[J]. 湖泊科学, 2010, 22(3): 307-314.
[51] 濮培民, 王国祥, 胡春华, 等. 底泥疏浚能控制湖泊富营养化吗? [J]. 湖泊科学, 2000, 12(3): 269-279.
Distribution and influencing factors of phytoplankton functional groups in the estuary and pelagic area of Chaohu Lake
CUI Wenjian1, GUO Nichun1, LI Jing2
(1. School of Resources and Environment,Anhui Agricultural University, Hefei 230036; 2. Anhui Province Key Laboratory of Aquaculture & Stock Enhancement, Fisheries Research Institute, Anhui Academy of Agricultural Sciences, Hefei 230001)
In order to study the structure and function of phytoplankton community and its ecological significance in eutrophic lake- Chaohu Lake,20 sampling sites were set up in the main estuary and pelagic area of Chaohu Lake. The survey was conducted for four quarters between August 2020 and April 2021. The distribution and influencing factors of phytoplankton functional groups in the estuary and pelagic area of Chaohu Lake were also analyzed. A total of 90 species of phytoplankton belonging to 42 genera and 8 phyla were identified in the estuary area and 80 species belonging to 42 genera and 8 phyla were identified in the pelagic area. The average abundance, biomass, Margalef richness index and Shannon-Wiener diversity index in the estuary area were higher than those in the pelagic area. There were significant differences in abundance (<0.05), but no significant differences in biomass, Margalef richness index and Shannon-Wiener diversity index were significantly different (<0.01). According to FG functional group classification method, the composition of phytoplankton functional groups in the estuary area was similar to that in the pelagic area. According to the calculation of dominance degree, there were 5 dominant functional groups M, Lo, H2, MP and X3 in the estuary area, and 3 dominant functional groups M, H2 and X3 in the pelagic area. RDA analysis and Pearson correlation analysis of phytoplankton dominant functional groups and environmental factors in the estuary area and pelagic area showed that the dominant functional groups of phytoplankton were affected by different environmental factors. The main environmental factors affecting the phytoplankton dominant functional groups in the estuary area were water temperature(WT), water depth(WD), pH, dissolved oxygen(DO),electrical conductivity(Cond), total phosphorus(TP) and permanganate index(CODMn). The main environmental factors affecting the phytoplankton dominant functional groups in the pelagic area were WT, WD, pH, DO, Cond, total nitrogen(TN), and nitrate nitrogen (NO3--N). By comparison, the result showed that WT、WD、pH、DO and Cond were the environmental factors both affecting phytoplankton dominant functional groups in the estuary area and pelagic area. In addition, the dominant functional groups of phytoplankton in the estuary area were greatly affected by phosphorus and the pelagic area was greatly affected by nitrogen. These results indicate that there were differences in environmental effects on the phytoplankton functional groups between the estuary area and pelagic area of Chaohu Lake. Therefore, the future eutrophication management of Chaohu Lake must be tailored to local conditions. Reasonable and effective control measures were formulated according to the situation of the estuary area and pelagic area respectively, phosphorus control measures should be taken first in the estuary area and nitrogen control measures should be taken first in the pelagic area.
Chaohu Lake ; estuary area; pelagic area; phytoplankton function groups; environmental factors; redundancy analysis(RDA); Pearson correlation analysis
Q948.8
A
1672-352X (2022)06-0979-11
10.13610/j.cnki.1672-352x.20230106.013
2023-01-06 20:22:19
[URL] https://kns.cnki.net/kcms/detail//34.1162.S.20230106.1208.017.html
2022-03-10
安徽省重点研究与开发计划生态环境专项(202004i07020007)资助。
崔文建,硕士研究生。E-mail:18306890187@163.com
郭匿春,博士,副教授。E-mail: guonichun@ahau.edu.cn
——记山东省东营市河口区河安小学校长刘波

