TIVS在四肢血管损伤治疗中应用的进展
卢思宇 徐永清
周围血管损伤的发生率因各种原因日益增加,无论是对于临床骨科医师还是一线抢险救灾的军警医务工作者来说,积极地挽回伤者的生命、保住伤者的肢体及功能都是最为迫切、最为紧要的任务。四肢血管损伤的发生率约占人体血管损伤发生率的44.4%[1]。其中战创伤导致的四肢血管损伤发生率约为13%[2]。而在周围血管损伤的救治中,肢体缺血时间的长短是决定肢体成活及其他器官衰竭甚至死亡的重要因素。通常血管重建的时间不得超过6~8 h,大于12 h属于超时限缺血时间,缺血6 h后肌肉将发生变性、功能障碍。缺血12 h后肢体将发生不可逆的损害甚至并发急性肾衰竭等[3-5]。因此,在四肢血管损伤争分夺秒的救治中,临时血管转流(temporary intravascular shunt,TIVS)扮演着至关重要的角色。本文通过TIVS在四肢血管损伤治疗中应用的进展文献综述,旨在探讨其应用历史、临床效果、技术发展以及材料展望。
1 四肢主要血管损伤的简述
1.1 外周血管损伤的机制及特点
通常血管损伤的机制有锐性损伤、钝性损伤和医源性损伤三大机制[6-7]。其特点及临床表现又因损伤机制、损伤时体位、损伤部位和类型不同可出现不同的临床表现,主要临床表现包括出血、休克、血肿、组织缺血、局部震颤和杂音以及合并神经组织损伤的症状等[8]。主要特点包括:其他并发症掩盖了血管损伤,最后出现漏诊的可能;早期的血管损伤有可能第一时间没有症状;不能只关注原发部位,可能出现多部位血管损伤可能。
1.2 血管损伤的分型及诊治
血管损伤可以根据其损伤机制简单分三大类[9-11],但因为繁琐的损伤程度及名称描述,导致不同的医务工作者对同一血管损伤认识可能存在差异,给伤情的描述以及诊治增添困难。为此2008年张英泽等[12]提出了血管损伤分型(coding and injury classification for arteries,CICA)系统,对血管损伤的诊断、治疗、效果评价有很大的帮助,并取得的广泛的认可。血管损伤因临床表现、损伤部位及严重程度各有不同,所以在临床救治工作中需做全面检查、早期诊断、及时治疗。血管损伤在诊断时应注意:不要把所有焦点集中在骨折或脱位上,因为不仅仅是开放性损伤才伴有血管损伤;检查动脉时应与健侧对比,有搏动不代表主干动脉没有损伤;肢体感觉异常或障碍不能只考虑神经损伤,需排除血管损伤缺血后的感觉异常;针刺肢体末梢出血不能完全证明肢体血运良好,应根据实际出血速度、颜色、血液中是否伴有其他液体综合判断。诊断过程中除了结合病史及相关查体,还可以通过血管超声、数字减影血管造影、CTA及MRA等辅助检查进一步明确诊断,目前最可靠、直接有效的方法还是CTA和MRA[13],可根据具体医疗条件及伤情选择适合的辅助检查。
1.3 四肢血管损伤的救治
治疗四肢血管损伤的关键是止血,同时应尽可能地减少肢体缺血时间。开放手术的方式包括结扎、单纯修补、端端吻合、移植修复和旁路手术[8]。但上述开放治疗中,除血管结扎外,其余治疗方式均对医务人员的显微吻合技术及医疗条件有较高的要求,在一线战场及基层医疗机构难以开展,伤员需要长途转运,长途转运带来的必然是肢体缺血时间增加。国内学者杨福周等[14]2017年在临床中利用TIVS维持血管通畅,成功减少肢体缺血时间。同法在损伤血管修复困难、需要转运时,TIVS可以临时有效地保持远端肢体血液灌注。在四肢血管损伤的治疗中,随着血管内技术的不断发展,血管内膜损伤导致的血栓形成、创伤性动脉瘤、动静脉瘘等情况,传统开放性手术正逐渐被血管腔内技术所取代,但血管腔内技术在血管损伤严重甚至完全断裂的情况中仍有一定的局限性[15]。
2 TIVS的作用原理及在血管损伤救治中的效果分析
2.1 TIVS的作用原理
临时血管转流技术是指参与血管损伤救治的医务人员通过1根与损伤血管管径相近的人工通道,暂时性地接通受损血管远近端,维持远端肢体血运。避免或降低因伤员转运及其他并发疾病救治过程中远端肌肉、神经的损伤,有效减少伤员因肢体缺血导致的截肢及死亡风险。该技术主要可用于以下几种情况:严重多发伤并血管损伤一期需行损伤控制性手术的伤员;严重开放性骨折,骨折固定时间较长、需优先处理骨折的伤员;需断肢再植的伤员;因基层卫生院和战争前线资源缺乏,需向上级医院或后方转运的血管损伤患者;大型自然灾害或暴恐活动致血管损伤患者人数多,医疗资源不足时。
2.2 TIVS在血管损伤救治中的效果分析
Wlodarczyk等[16]对2004年至2015年在6个一级创伤中心的病例进行回顾分析,比较在初次手术中接受TIVS的患者和未接受TIVS的患者,结果发现291例患者中72例使用TIVS的患者室间室综合征发生率显著降低(15%vs.34%,=0.002)。Hinck等[17]研究分析后指出,TIVS可以作为血管损伤控制手术的辅助手段来维持损伤肢体灌注,并能有效降低因结扎或耗时血管重建所带来的高死亡率和继发性截肢率。在杨福周等[14]、Ayala-Hillman等[18]对使用TIVS治疗血管损伤的回顾性分析中,指出临时血管转流术可以有效地让患肢获得血液灌注,在争取到宝贵的转运及救治时间的同时也能很好地降低截肢率及死亡率。朱庆棠等[19]在2009—2011年期间应用TIVS对6例8条大血管损伤需行血管移植的患者进行术中转流,转流时间后1~3.5 h,术后5例保肢成功,1例因术前转运时间较长、肢体坏死感染截肢。周敦等[20]在2005—2011年期间在9例股骨骨折合并股动脉损伤患者的救治中使用TIVS技术急诊桥接血管,术后8例保肢成功,1例因缺血时间较长肾脏功能衰竭选择截肢。2016年,Inaba等[21]对多年来TIVS使用的分析,发现临时血管转流技术保肢成功率高达96.3%,生存率约为79.6%(死亡病例均由其他器官衰竭导致)。但同时出现各种并发症的情况大概如下:转流装置脱落率1.4%;出现筋膜室综合征和血栓的几率分别为4.2%、5.6%。i li等[22]在对TIVS治疗的90例血管损伤患者进行分析后,发现同样的结果。Osterberg等[23]及Hanley等[24]在动脉瘤血管切除的手术中应用临时血管转流技术,成功地将肢体缺血时间降低至14 min,避免了远端缺血及血栓的形成。Sonesson等[25]及Xiong等[26]在试验中使用TIVS维持脑部的血液灌注,成功减少了整体手术的时间。通过上文阐述可以得出,TIVS技术在血管损伤的救治中起着至关重要的作用,该技术能有效地建立血管损伤后远端肢体的血液灌注,可以延长伤员的转运及术前准备时间,有效地降低了血管损伤带来的截肢率及致死率。
3 TIVS装置的历史沿革
在TIVS发展过程中,临时血管转流技术一直都是以建立损伤血管远近端通畅、有效的人工通道,并保持远端肢体血液灌注为核心原理,多年来几乎没有任何改变。但为了降低TIVS的并发症发生率及延长转流时间,TIVS的装置及材料一直在变化。
3.1 早期的TIVS装置
首只血管转流装置诞生于1915年,Tuffier提出血管损伤早期及时建立远端肢体血液灌注尤为重要,同时设计出了全球首只用石蜡涂层的银制转流装置,并命名为Tuffier管[27]。该装置在Bowlby救治周围大血管损伤的患者时首次应用于临床。Tuffier管虽然材料造价较高、可塑性较差,但当时仍得到了小范围内的认可及使用。在第二次世界大战期间,美军战场医务人员曾尝试使用输液管自制转流装置维持肢体血供,有效地减少了伤员后送治疗后血管损伤带来的截肢率。由于转流装置内的血栓形成,1940年Murray提出并制作了玻璃转流装置[28],配合局部加入肝素抗凝后可将转流时间延长至1 440 min,但在部分西方国家尝试使用后并未取得较好的效果。随后由Blakemore等发明并设计的Vitallium管于1945年诞生,该转流装置主要由钴、铬、钼等金属组成,美军在朝鲜战场上曾使用Vitallium管做血管临时转流术,并取得了良好的效果,明显降低了伤后截肢的概率[29]。尽管该装置存在血栓形成、血管二次损伤、感染等情况,但在战场上也起到了不小的积极作用。
3.2 TIVS装置目前的发展
目前,TIVS转流装置主要有两大类。一类是国内广泛使用的自制转流装置,由临床大夫根据血管损伤的情况、部位及医疗条件选择输液管、导尿管、输血管、胃管等自行裁剪制作。自制引流管的优势是取材方便、造价便宜、可塑性强,但转流管是否通畅不易检测、管内抗凝药物注射困难、转流管两端固定部位管壁有塌陷的可能,以及转流通畅时间无法统一估算等不足。另一类转流装置主要以商品转流管为主,包括:带活动金属固定夹的硅胶管、Javid管[30];不锈钢螺纹加固内壁的硅胶管,Sundt管;法国军队配备的中段带三通的硅胶管、Argyle管[31];两端球囊固定,中段开口监测血流及压力的Pruitt-Inahara管[32]。该类转流装置的优势是操作简单、管壁解释不塌陷、转流期间可监测血流等。但硅胶材质容易被细菌黏附、生物兼容性不如已经用于确定性血管重建的ePTFE[33]管效果好。国内也有学者发明设计了固定效果优于丝线捆绑的拉索式血管转流装管[34]。李宏辉等[35]为了增加转流后肢体血液的灌注,在对兔子的实验中首次尝试了运用动力辅助血管转流装置进行临时血管转流,取得了积极良好的结果。因此无论是在转流装置的材料、固定、自身抗凝及肢体血液灌注上,TIVS转流装置在未来都还有很大的提升空间及前景。
3.3 自制TIVS操作流程
TIVS技术的操作流程因转流装置的不同,安装操作流程也略有不同,国内传统TIVS术中通常使用的是自制转流装置。根据操作者习惯及救治场所条件,常见的转流装置有输液管、导尿管、输血管、胃管等,根据血管损伤的部位及范围剪裁制作。通过学习杨福周等[14]、朱庆棠等[19]、周敦等[20]、肖占祥等[36]学者们关于TIVS临床应用的相关文献,将TIVS自制转流管操作流程简单总结如下:明确诊断,确定损伤血管部位,止血夹临时夹闭损伤血管远近端;评估测量损伤血管管腔大小、损伤范围长短,剪裁粗细长短合适的转流装置;肝素生理盐水冲洗灌注转流装置管腔;切除血管损伤部分,转流装置一端置入近端断端(动脉)或远端断端(静脉)丝线捆绑固定,松开连接侧血管夹见转流装置另一端口血液流出后再次夹闭血管夹,同法置入转流装置另一端;松开两端血管夹,观察转流装置通畅情况及是否脱落,输液管自制转流装置及材料可见图1,转流操作过程图及转流成功后转流管工作状态可见图2。综上所述,笔者发现自制的TIVS术在血管损伤的临床救治中一定时间内维持远端血供有效。但也发现一些可能存在的不足如下:丝线捆绑可能对血管造成医源性损伤,吻合时需切除捆绑部位血管;传统自制转流装置材料偏软时,捆绑后转流管塌陷可能,最终造成转流管血管连接处漏血,甚至转流装置脱落;自制转流装置材料不透明时,可能无法或难以观察转流是否通畅;自制转流装置植入步骤相对繁琐,植入时间因熟练程度不同而长短不一。
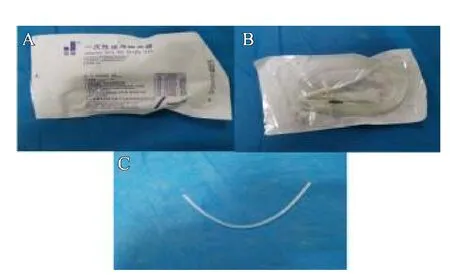
图1 A、B.自制转流装置材料;C.自制转流装置
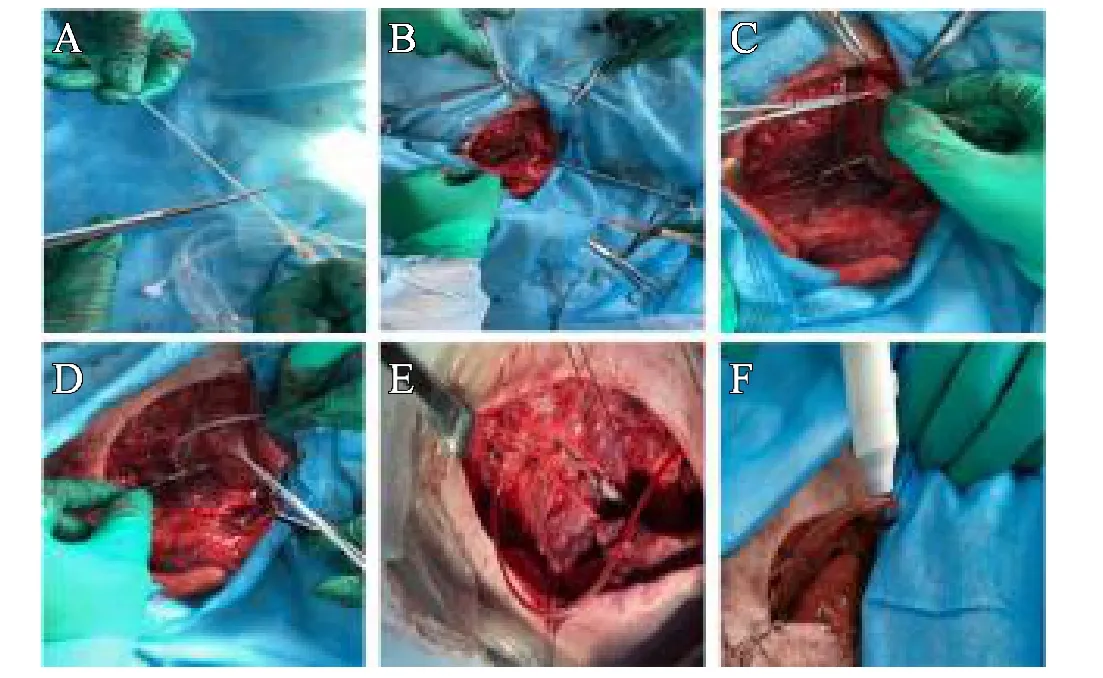
图2 输液管自制转流装置的简易操作流程:A.血管夹止血、测量输液管、剪裁制作合适的转流装置;B.肝素生理盐水冲洗转流装置;C.安装近端转流管,丝线捆绑,松近端止血夹见转流装置远端口血液流出,夹闭近端止血夹;D.同法安装远端转流装置,丝线捆绑;E.转流装置安装成功,松开两端止血夹时状态;F.观察转流装置是否通畅或脱落
3.4 自制TIVS装置规范使用的临床意义
目前临床使用的自制TIVS装置因受伤血管的大小和范围各式各样,操作的方法也略有不同。规范的操作方法在临床中可以有效地缩短TIVS装置安装的时间、提高TIVS装置的转流效果、降低转流管塌陷甚至脱落的几率,也可以最大限度地减少TIVS装置植入时对血管的损伤。
4 展望
TIVS不仅在血管损伤治疗中发挥重要作用,在控制性手术(damage control surgery,DCS)[37]中也有很大的实用价值和空间。同时TIVS也有很多不足之处,如血栓、转流动力不足、转流管固定不牢靠或不易固定、易脱落、细菌黏附感染等、转流装置对血管二次损伤。但随着各种新型材料及3D打印技术的发展,近年来有国内学者根据已有转流装置的优点,创新发明了一款新型转流装置[38],并用比格犬验证了该装置在动物体内使用的可行性,该装置主要成分为成硅橡胶材料,分别由两端自动撑开器(环状球囊、球囊通道、球囊通道口)、中部的血管桥接转流系统(端头、血液通道、补液口)组成,但目前并没有关于该装置更深入的研究报道能证明:该装置两端的球囊固定对血管的损伤比传统丝线捆绑对血管的损伤小;该装置转流效果优于传统转流装置;该装置对人体没有生理病理方面的影响;该装置球囊固定不会导致管腔塌陷甚至脱落。但是笔者认为鉴于TIVS技术在快速重建血管通路、维持肢体血液灌注中扮演的关键角色及已经取得的显著效果。关于新型转流装置的研究会越来越多,各种新型的转流装置也会随之出现在我们的视野中。
在过去100多年的时间里,无论是战伤转运还是临床血管损伤的治疗中,TIVS不仅为伤员转运提供了保障,挽救了无数的生命,也在各种血管损伤的救治中发挥了不可替代的作用。随着各种新型转流装置的不断出现,以及TIVS在临床治疗中成功的案例越来越多。相信临时血管转流术将会成为外科各种手术中减少组织缺血时间、降低创伤、降低致残率、提高救治成功率的重要方法。

