基于琼脂糖-中性红法的简易空斑试验应用研究*
金 鑫,余福勋,杨 丽,余本莉,崔玉霞,叶芝旭,△
(1.贵州省人民医院眼科,贵州 贵阳 550002;2.贵州省人民医院中心实验室/国家卫生健康委员会肺脏免疫疾病重点实验室,贵州 贵阳550002;3.贵州省人民医院儿科,贵州 贵阳 550002)
呼吸道合胞病毒(RSV)是全世界婴幼儿和老年人病毒性呼吸道感染的主要原因,其每年造成的死亡人数超过流感。几乎所有2岁以下儿童均感染过RSV。严重的RSV感染与儿童反复喘息及哮喘有关[1-2]。因此,RSV感染越来越受到重视,研究RSV致病机制、研发抗RSV药物及疫苗均需进行RSV滴度定量测定。空斑形成试验是测定病毒滴度的“金标准”,在国内外已得到广泛应用。与甲基纤维素相比,琼脂糖更容易覆盖细胞单层[3-4],但方法不当时,不易形成空斑。本研究应用琼脂糖覆盖细胞单层、中性甲醛固定及中性红染色的试验流程检测病毒滴度,能形成合适的空斑,方法简单且重复性较好,为进一步进行RSV相关基础研究打下了基础。
1 材料与方法
1.1主要材料 人喉上皮癌细胞Hep-2及RSV A2标准株由重庆医科大学附属儿童医院呼吸病研究室惠赠。胎牛血清购自澳大利亚AusGeneX公司;DMEM液体培养基和干粉培养基分别购自美国Gibco公司和Hyclone公司;Triton X-100、BSA、中性红、胰酶和低熔点琼脂糖购自北京Solarbio公司;鼠抗RSV N抗体购自英国ABCam公司;异硫氰酸荧光素(FITC)标记的小鼠抗荧光二抗购自北京Bioss公司;4′,6-二脒基-2-苯基吲哚(DAPI)购自上海碧云天公司。
1.2方法
1.2.1RSV感染细胞模型的建立 未感染RSV的Hep-2细胞作为空白对照组,感染RSV的Hep-2细胞作为试验组,每组4个孔。Hep-2细胞按6×105/孔铺板于12孔板中,待细胞单层生长至80%时,将感染复数为0.01的病毒液[用含2%胎牛血清(FBS)的DMEM稀释病毒液]按每孔400 μL加入细胞中,于37 ℃、5% CO2条件下吸附2 h,每15~30分钟摇动1次,以保证病毒分布均匀。吸附2 h后弃上清液,磷酸盐缓冲液(PBS)洗2次,以去除未被吸附的病毒。再次加入新的含2%FBS的DMEM每孔1 mL,于37 ℃、5% CO2条件下培养48 h,显微镜下可观察到明显的细胞病变。收集标本,其中上清液用于测定病毒滴度,采用免疫荧光检测方法检测RSV N蛋白。
1.2.2细胞免疫荧光检测 RSV感染Hep-2细胞后48 h,去除培养上清液,感染细胞用PBS洗涤3次,4%甲醛固定20 min,PBS洗涤3次,再用含1%牛血清清蛋白(BSA)和0.3%Triton X-100的PBS封闭,同时打孔30 min。然后加入小鼠抗RSV N抗体(1∶200,1%BSA作稀释液),37 ℃孵育2 h,PBS洗涤细胞3次,再加入FITC标记的抗小鼠二抗(1∶300,1%BSA作稀释液),37 ℃避光孵育1 h。PBS洗涤3次,加入DAPI染液常温避光染色30 min,PBS洗涤3次,采用奥林巴斯倒置荧光显微镜进行观察和拍摄。
1.2.3简易空斑试验方法 Hep-2细胞以每孔3×105接种至24孔细胞培养板中,达到100%融合时,弃去培养液,PBS冲洗2次。在冰盘上将病毒悬液以含2%FBS的DMEM作10倍系列稀释,共8个稀释度(10-8~10-1)。每一稀释浓度设2个复孔,每孔分别接种200 μL病毒液,于37 ℃、5%CO2条件下吸附2 h,每15~30分钟摇动1次,以保证病毒分布均匀,对照组仅加入含2%FBS的DMEM。吸附2 h后弃上清液,PBS洗涤2次,以去除未被吸附的病毒。加入琼脂糖覆盖层,琼脂糖覆盖层由1%低熔点琼脂糖(琼脂糖以灭菌注射用水配制,高压灭菌处理,临用前微波炉加热融化,于42 ℃水浴保温备用)及含5%FBS的2×DMEM(42 ℃保温备用)按1∶1配制而成,使琼脂糖浓度为0.5%,FBS浓度为2.5%,DMEM为1×DMEM。每孔加入上述琼脂糖混合液1 mL,覆盖细胞,室温下静置20 min后置于37 ℃、5% CO2条件下培养。观察并记录Hep-2细胞形成典型融合病变,即空斑的时间、形态及数量。培养5~6 d后,每孔加入1 mL10%甲醛固定细胞,1 h后小心去除琼脂糖覆盖层并用双蒸水轻轻冲洗,每孔加入0.05%中性红染液1 mL,常温染色过夜,次日去除中性红染液,自然晾干后肉眼计数空斑个数。将每孔记数为10~100的空斑数带入计算公式,并按如下公式计算病毒滴度。病毒滴度=(每孔平均空斑个数×病毒稀释度倒数)/每孔病毒接种量。
2 结 果
2.12组典型细胞病变情况 试验组形成典型合胞病变,即感染细胞发生融合后形成多核巨细胞,直径为1.5~2.5 mm,合胞形态不规则,细胞界限不清;空白对照组未见典型细胞病变。见图1。
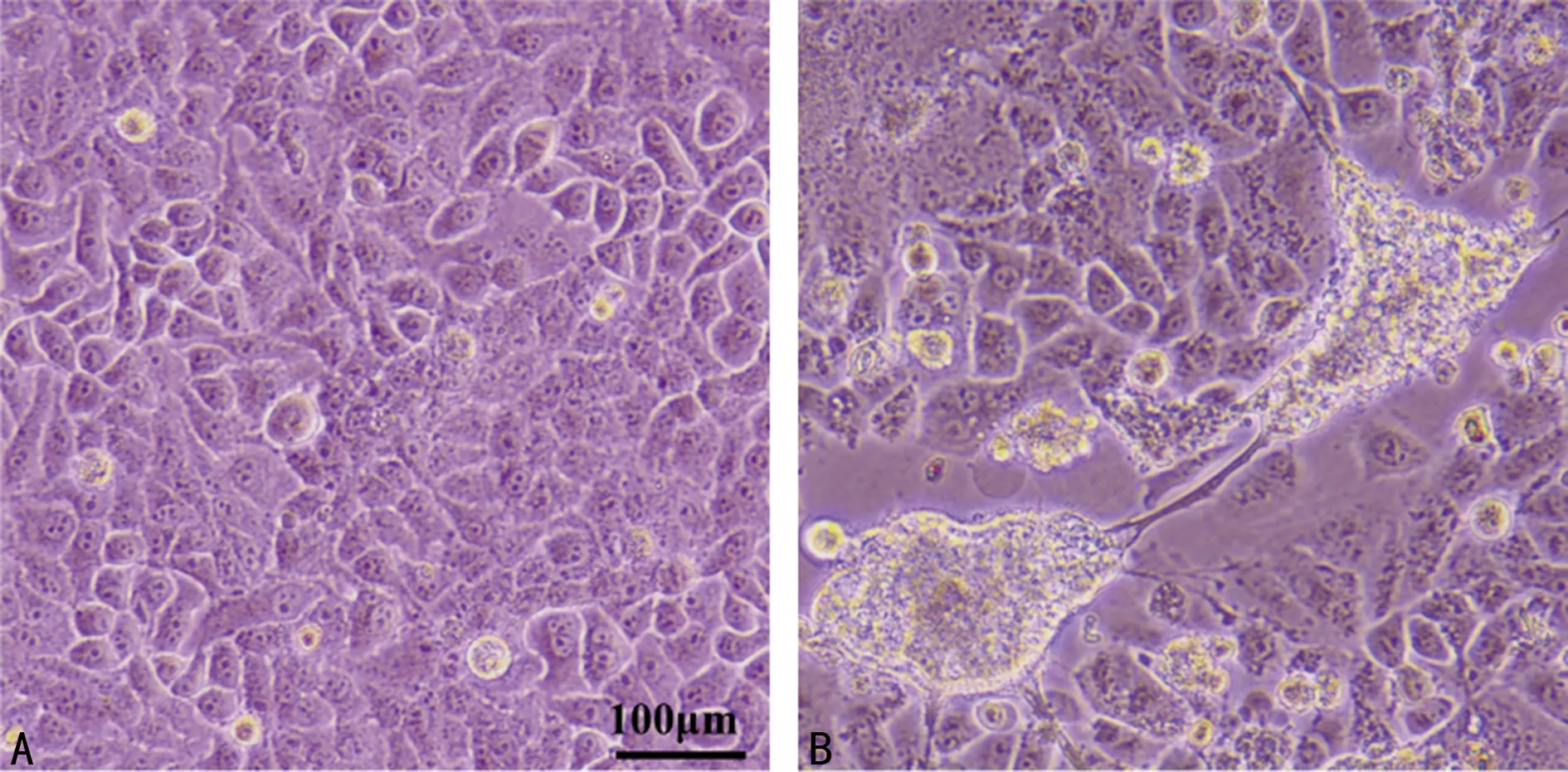
A为空白对照组,B为试验组。
2.22组RSV N蛋白表达检测结果比较 试验组有绿色荧光表达,且可见细胞核聚集现象;空白对照组未检测到非特异性的荧光标记。见图2。
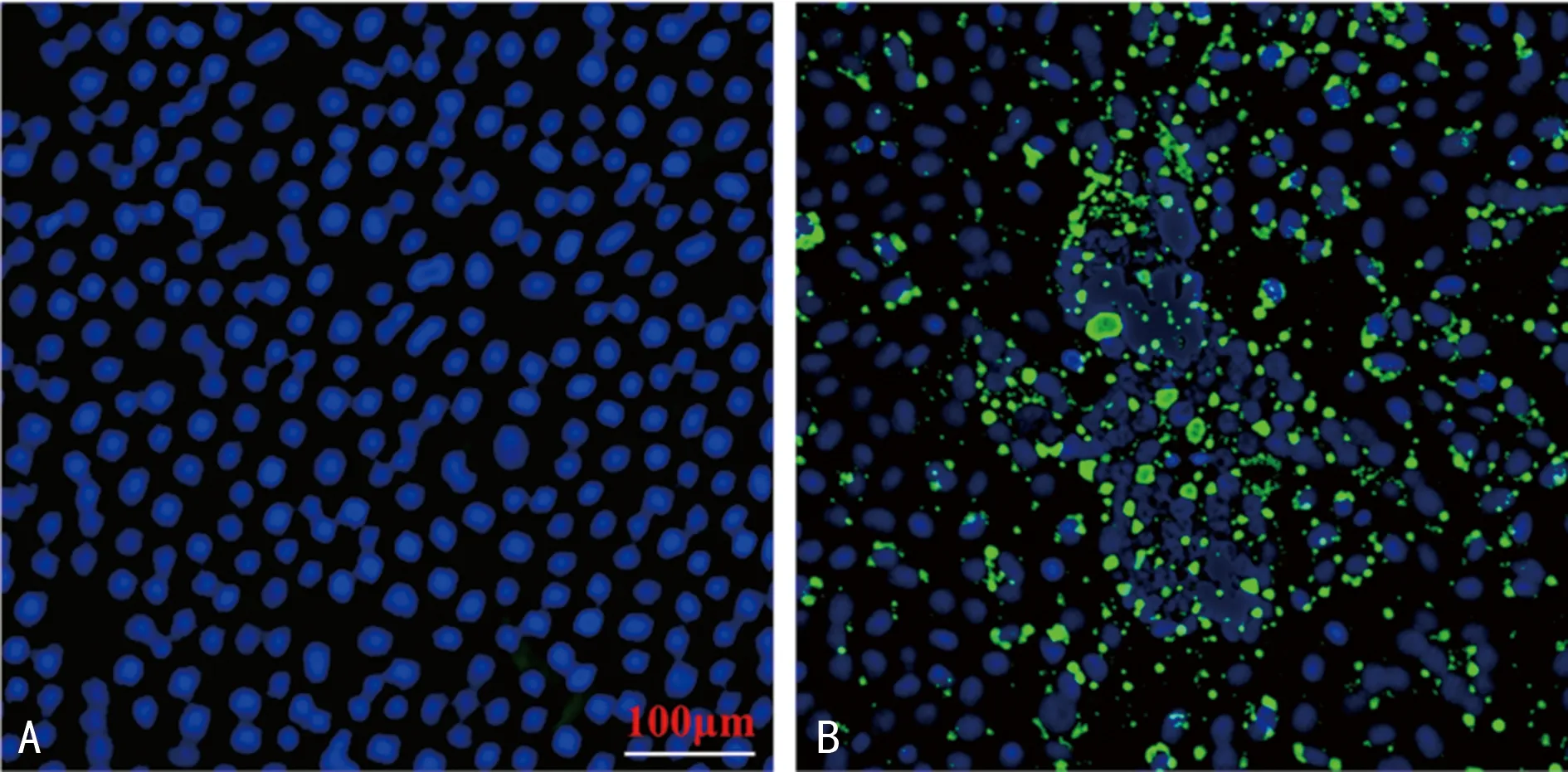
A为空白对照组,B为试验组。
2.3RSV感染Hep-2细胞后形成的空斑 中性红染色后,正常Hep-2细胞呈红色,而RSV感染的Hep-2细胞不能染色,形成空斑。镜下空斑形态与RSV形成的合胞病变一致(图3A)。空斑肉眼清晰可见,为类圆形或圆形,大小1.5~2.5 mm,边缘不规则。随着病毒稀释度的增高,空斑数目逐渐较少(图3B)。偶有部分细胞因去除琼脂糖覆盖层时不慎刮伤细胞,导致中性红染色时亦不着色,但刮伤的细胞处肉眼可辨别出来,多成条索状。计算2个复孔并取平均值,最后计算出病毒滴度为7.5×108PFU/mL。

A.镜下空斑形态(400×);B.肉眼空斑,其中1~3未感染RSV,4~8病毒稀释度为10-8~10-4。
3 讨 论
RSV是导致全世界婴幼儿病毒性肺炎最常见的病毒病原,可分为A、B两种抗原亚型,其中RSV A2株是最常用于试验研究的标准株[5]。研究RSV的致病机制、抗病毒药物的筛选及新药开发等均需要对病毒滴度进行测定。既往采用TCID50测定病毒滴度,但操作繁琐、耗时且结果判断有很大的主观性[6]。病毒空斑试验于1952年由Dulbecco首次描述用于检测动物病毒,并在1954年用于检测脊髓灰质炎病毒[7-8]。经过接近70年的不断改进及优化,病毒空斑试验已是目前公认的测定病毒滴度的“金标准”[9-11]。在临床前和临床研究中,病毒空斑试验是开发和评价新的抗病毒药物或疫苗的重要工具。凡是感染后能使宿主细胞产生细胞病变效应的病毒都可以用空斑试验检测病毒滴度。采用空斑法可对呼肠孤病毒[11]、轮状病毒[12-13]、新型冠状病毒[14]、副流感病毒、RSV[3]等进行病毒滴度检测。免疫法采用抗体标记RSV抗原蛋白,而后借助荧光显微镜计数空斑数,可将检测时间缩短至3 d。但该方法需要使用较昂贵的抗RSV抗体及二抗,且需使用荧光显微镜,导致成本较高、操作繁琐、重复性欠佳[9]。
本研究采用的简易空斑试验原理:RSV感染致密成片的Hep-2细胞后,然后覆盖一层琼脂糖半固体培养基,病毒感染细胞并在细胞中增殖,使细胞发生病变死亡。由于半固体介质的限制,释放的病毒只能由最初感染的细胞向周围扩散,数天后可出现典型的细胞融合病变。去除琼脂糖覆盖层,细胞经甲醛固定后用中性红染色,未被感染的细胞被染成红色,而死细胞不能染色,因此出现肉眼可见的病毒空斑。理论上,当病毒液充分稀释后,每一个空斑由1个感染性病毒颗粒繁殖并破坏细胞后形成,因此通过空斑数可精确测定病毒滴度[9]。RSV简易空斑试验通常在6~24孔板中进行,常用对RSV最易感的Hep-2细胞,易于形成典型的空斑。用来做培养基覆盖的物质包括琼脂糖、明胶、甲基纤维素等。常规RSV空斑试验采用低熔点的琼脂糖作为覆盖层。既往采用3%固体琼脂糖覆盖后形成的空斑偏小,且需培养9~13 d后在显微镜下人工计数空斑[9],固体琼脂糖融化后易于凝固,操作时温度难以把握,常因温度过高导致细胞死亡,或温度过低导致凝固,且非常耗时。近年来,采用0.6%或1%琼脂糖[3,15],即半固体琼脂糖制作覆盖层。琼脂糖在较低温度下不易凝固,形成空斑的时间可缩短至5~7 d,空斑更大,可肉眼观察,操作简单,可重复性强[3]。常用于空斑试验的染料包括中性红、结晶紫等。有研究比较了琼脂糖-中性红法及甲基纤维素-结晶紫法对严重急性呼吸综合征病毒空斑检测的影响,发现两种方法测定到的病毒滴度无明显差异[16]。琼脂糖-中性红法是最为常用的检测各种病毒滴度的方法。细胞经甲醛固定后再用中性红染色,只有活的细胞才能摄取中性红,使细胞被染色,而死亡的细胞则不能染色形成空斑,且染色结果可长期保存[9]。
本研究中,RSV A2株感染Hep-2细胞后,显微镜下可形成典型的合胞病变,通过免疫荧光染色RSV N蛋白,可检测到RSV N蛋白表达,提示RSV成功感染Hep-2细胞。空斑试验中,半固体琼脂糖覆盖细胞,经甲醛固定后并用中性红染色,可见到形成合胞病变处的细胞不被染色形成空斑,而未感染的细胞被染成红色,因而可直观通过空斑个数计算病毒滴度。本试验需要注意以下几点:(1)空斑试验所用的Hep-2细胞应处于最佳状态,铺板均匀,几乎100%长满培养板时,试验结果最佳,应防止细胞生长过密或接种时细胞生长过久;(2)2×DMEM培养基配制后如放置时间过久,需注意pH值的变化,不适宜的pH值会导致细胞死亡;(3)琼脂糖为低熔点琼脂糖,且覆盖时温度适宜,覆盖时动作要缓慢,防止气泡产生,同时动作要快,防止混合物凝固及细胞因长时间脱离培养基或液体而死亡;(4)第1次做空斑试验时,每隔12 h观察1次细胞病变,了解细胞病变所需时间,避免观察时间太晚导致细胞大量死亡。
综上所述,基于琼脂糖-中性红法的简易空斑试验可直接观察空斑计算病毒滴度,不需要进行免疫荧光染色和显微镜检查,且检测结果可无限期保存,具有试验方法简单、经济等优点。该方法可成功测定RSV病毒滴度,并可为后续RSV相关研究奠定基础。

