Notch信号通路调控癌症的研究进展
付治美 宋武琦 徐梦蔚 张凤民
Notch基因得名于该基因的功能缺失突变导致黑腹果蝇翅缘缺刻的遗传学研究。早在20世纪90年代,Notch突变与癌症的密切关系就得到了证实[1]。
Notch信号是造血、免疫细胞分化的关键调节因子之一,与多种自身免疫性疾病、肿瘤的发生和肿瘤诱导的免疫抑制有关。Notch信号通路本身简单,但它所调控的细胞进程却相当复杂,通过基因组测序发现在多种肿瘤中都存在突变的Notch基因,事实上,异常活化的Notch信号涉及癌症几乎所有基本特征,如肿瘤血管生成、癌细胞的干性和上皮间充质转化等[2]。本文综述了Notch信号通路调控癌症的相关机制,将为肿瘤的防治开辟新的思路。
一、经典Notch信号通路及其调控
经典Notch信号通路以细胞间接触的方式传递信号,又称为复合信号结合蛋白J(recombination signal binding protein J,RBP-J)依赖通路,需要Notch受体、配体、RBP-J和靶基因的参与[3]。哺乳动物中,Notch受体(Notch1、Notch2、Notch3和Notch4)和配体(Jagged1、Jagged2、DLL1、DLL3、DLL4)的结合启动了Notch信号的传递。
Notch受体是由单一前体编码的单程Ⅰ型跨膜蛋白,为多肽段构成的异二聚体,Furin样蛋白酶在异二聚化结构域的非结构区的S1位点将其切割为N端胞外配体结合区(notch extracellular subunit,NEC)和C端跨膜亚单位(notch transmembrane subunit,NTM);而Notch受体与配体结合后,去整合素金属蛋白酶(a disintegrin and metalloprotease,ADAM)在NTM外部的S2位点进行切割,切割产生的Notch片段,被早老素依赖的γ-分泌酶在其跨膜区内S3位点再次切割,释放Notch胞内域(notch intracellular domain,NICD);NICD从膜上释放并转移到细胞核,形成一个由NICD、RBP-J和智者基因样(mastermind-like,MAML)核转录激活蛋白家族组成的复合物,该复合物与Notch的一些调节元件结合之后,转录Notch下游基因[4]。
经典Notch信号激活上调的靶基因,已知有发状分裂增强子1(hairy and enhancer of split 1,HES1)、与YRPW基序相关的发状分裂增强子1(hairy and enhancer of split-related with YRPW motif 1,HEY1)、B细胞特异性MLV整合位点-1(B cell-specific MLV integration site-1,BMI1)、G1/S-特异性周期蛋白-D1(cyclin D1,CCND1)、细胞周期蛋白依赖性激酶抑制剂1A(cyclin dependent kinase inhibitor 1A,CDKN1A)等[5~8]。Notch本身作为转录共激活因子,转录反应非常复杂,可以和其他信号通路发生复杂的交叉作用,Notch通路可以调控以下这些癌症相关通路继而在不同癌症中发挥不同功能(图1)。
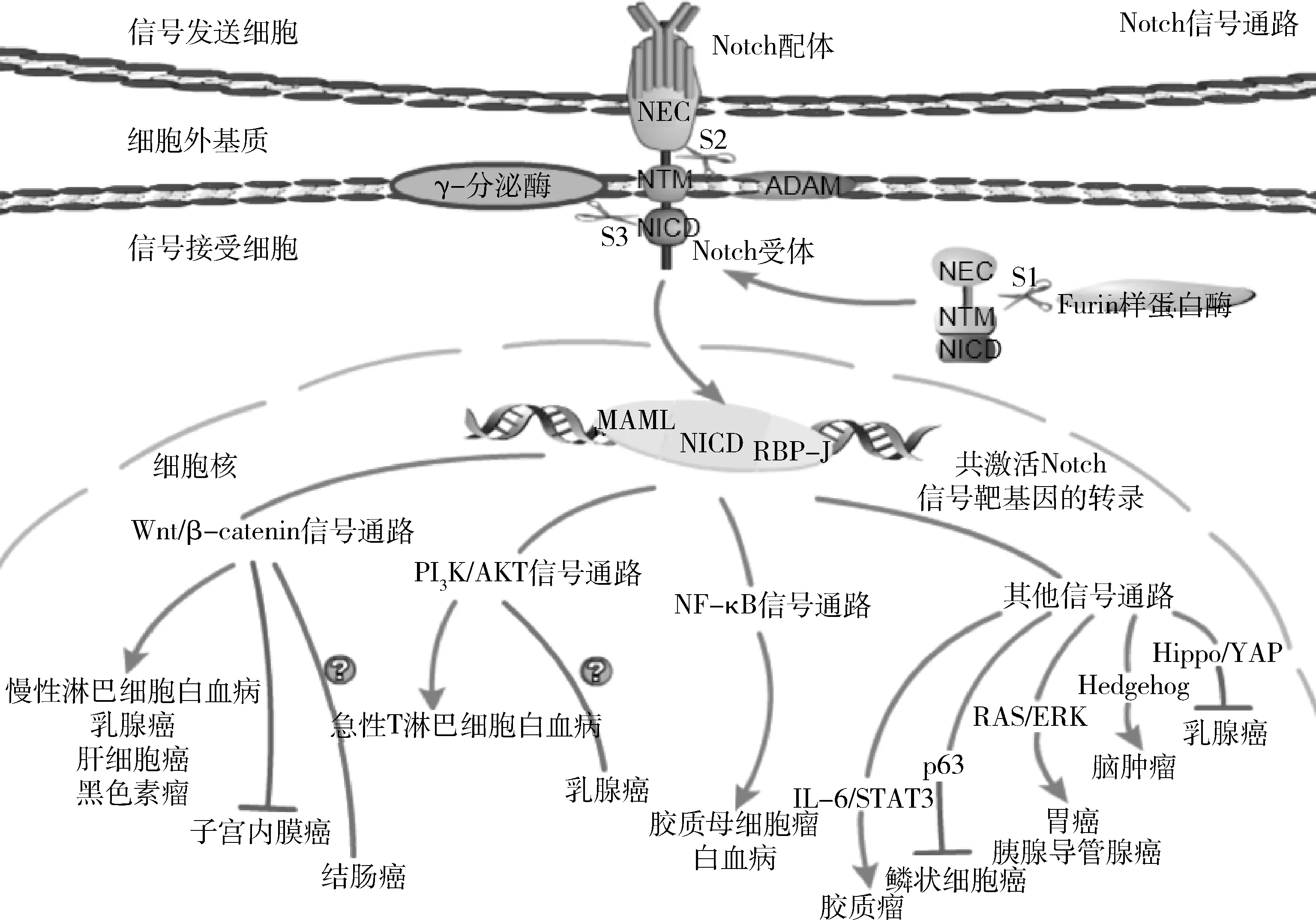
图1 Notch信号通路与癌症相关通路的关系
1.Notch与Wnt/β-catenin信号通路:Wnt /β-连环蛋白(Wnt/β-catenin)信号通路在多种肿瘤中被异常激活,主要是由转录因子β-catenin的错义突变引起。Notch与Wnt信号通路的相互作用发生在许多水平上,Notch能抑制糖原合成酶激酶3β(glycogen synthase kinase3β,GSK-3β)激活β-catenin,最近的研究集中在Notch和Wnt信号在细胞和基质成分之间正常的交互作用上[9]。研究表明,Wnt信号通路在慢性淋巴细胞白血病中是核心调节通路之一,而失调的Notch2是肿瘤细胞中经典的Wnt信号激活的先决条件,抑制Notch信号会降低基质保护的CLL细胞在体内外的存活率[10]。在乳腺癌细胞中,Notch信号可以与Wnt及其他信号通路发生交叉作用被激活,目前已有文献报道靶向Notch和Wnt通路来治疗乳腺癌的联合用药方法[11]。肝细胞癌组织中也常发现Notch基因突变,已知Notch1调控Wnt通路上调乙肝病毒X蛋白的表达从而诱导肝癌发生[12]。Notch1在黑色素瘤中也能调控Wnt、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、蛋白激酶B(protein kinase B,PKB,又称AKT)等信号通路,Notch1激活后,β-catenin上调,MAPK和AKT被激活,而抑制Wnt/β-catenin、MAPK和AKT通路能逆转Notch1诱导的肿瘤生长和转移[13]。结直肠癌(colorectal cancer,CRC)中,Notch与活化的β-catenin的结合干扰了CRC细胞中β-catenin的溶酶体的转运和降解,从而干扰Wnt信号传递,结肠癌中Notch1表达的升高促进癌症的进展,而Notch2升高却可能起到抑制结肠癌生长的作用,因此,Notch通路在结肠癌中发挥作用尚不明确[14]。在子宫内膜癌(endometrial cancer,EC)中关于Wnt信号的报道较少,出人意料的是,通过对47例EC样本的分析显示,与相邻的非肿瘤组织比较,EC组织中Notch 和Wnt信号分子的转录水平降低,NICD与Wnt通路重要效应分子体轴抑制因子(axis inhibitor,Axin)结合可减少β-catenin的累积,发挥肿瘤抑制功能[15]。
由此可见,Notch通过激活GSK-3β继而激活Wnt通路。Notch结合Axin等使Wnt降解受阻,这样的双重作用使Notch与Wnt信号之间维持着一种动态平衡,一旦平衡被打破,组织和微环境中的信号转导紊乱,就会导致肿瘤的发生、发展[4]。
2.Notch与PI3K/AKT信号通路:磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/AKT信号通路的失调被认为是肿瘤发生的标志,在脑肿瘤、消化系统肿瘤、女性生殖系统肿瘤、血液免疫系统肿瘤、乳腺癌和皮肤癌中均存在。编码受体的Notch基因可能通过典型的受体-配体相互作用激活AKT,还可通过与一些表面受体表达的增强子结合来激活PI3K/AKT信号,如白细胞介素7受体(interleukin 7 receptor,IL-7R)[16]。血液系统恶性肿瘤常表现出Notch信号的异常,最常见的是急性T淋巴细胞白血病(T-cell acute lymphoblastic leukemia,T-ALL)。2021年Padi等[17]证实了T-ALL早期对Notch抑制剂的耐药就是PI3K激活的结果。在乳腺癌中Notch与PI3K/AKT的互相作用较为复杂。在低分化型乳腺癌中,Notch与PI3K/AKT通路共同活化可使乳腺癌恶性程度升高[18]。另一方面,Notch3可通过反式激活磷脂酶和张力蛋白同源物(phosphatase and tensin homolog,PTEN)的表达来抑制乳腺癌的增殖[19]。因此,关于Notch在乳腺癌中发挥作用的明确机制仍需进一步的研究。
3.Notch与NF-κB信号通路:核因子-κB(nuclear factor kappa B, NF-κB)通路能够促进肿瘤的发生、发展,广泛存在于乳腺癌、淋巴癌等肿瘤中,几乎与所有癌症的特征相关。胶质母细胞瘤(glioblastoma multiforme,GBM)中,Notch1可以直接激活NF-κB通路,还可通过诱导HES1的表达间接激活NF-κB通路[20]。Notch与NF-κB在白血病中的联系更是紧密,如Notch3的异常激活可导致不同的NF-κB亚单位二聚化,调节参与白血病细胞分化或增殖的不同基因簇,在一定程度上还能增强NF-κB靶基因的表达介导白血病细胞抗凋亡作用[9]。
4.Notch与其他信号通路
(1)IL-6/STAT3信号通路:活化的转录激活因子3(signal transducer and activator of transcription 3,STAT3)扰乱了细胞的正常生存周期,在头颈癌、多发性骨髓瘤等多种恶性肿瘤中发挥强烈的致癌作用。Notch通路的关键调节因子RBP-J通过增强白细胞介素6(interleukin 6,IL-6)表达激活STAT3通路,并介导胶质瘤的肿瘤进展及放化疗耐药[21]。
(2)p63信号通路:转录因子p63在鳞状上皮组织中赋予基底细胞自我更新的活性,在鳞状细胞癌(squamous-cell carcinoma,SCC)中过表达。Notch在SCC中与p63互相作用,鳞状上皮细胞中p63的下调和Notch的激活启动了细胞周期阻滞和终止鳞状分化的程序,发挥肿瘤抑制功能,如近期就有研究提示Notch1的表达与口腔鳞癌的进展和预后有关,但Notch是如何发挥这些肿瘤抑制功能的,还有待于深入研究[22]。
(3)RAS/ERK信号通路:肿瘤中常出现大鼠肉瘤病毒(rat sarcoma virus,RAS)家族蛋白成员KRAS、NRAS、HRAS的突变。2019年,Huang等[23]研究发现Notch信号和RAS/细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号可能通过交互作用共同参与了胃癌(gastric cancer,GC)细胞增殖的调控,Notch1在胃癌组织中高表达,与胃癌淋巴结转移有关,抑制Notch1可以有效地抑制胃癌细胞的增殖。胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)是一种生存率极低的胰腺癌类型,小鼠遗传学研究表明,Notch信号的激活与致癌的KRAS协同作用,使腺泡细胞的发育出现异常,也有研究发现Notch2基因的失活会抑制KRAS引起的PDAC的发展[24]。
(4)Hedgehog信号通路:激活Hedgehog信号通路会导致细胞过度增殖,与多种癌症有关,包括髓母细胞瘤、胶质瘤、肺癌等。在胶质瘤和髓母细胞瘤中,Notch信号控制Hedgehog通路的关键因子G蛋白偶联受体Smoothened蛋白的传递和胶质瘤相关癌基因同源物(glioma-associated oncogene homolog,GLI)基因的转录,Notch信号的激活导致Smoothened蛋白累积,继而增高Hedgehog反应水平[25]。
(5)Hippo/YAP信号通路:Hippo/Yes相关蛋白(Yes-associated protein,YAP)信号通路可抑制细胞和组织生长,Notch3通过上调乳腺癌细胞肾脏脑蛋白(recombinant kidney and brain protein,KIBRA)激活Hippo/YAP通路来抑制乳腺上皮细胞间充质转化,干扰肿瘤的侵袭和转移[26]。
二、非经典Notch信号通路及其调控
除依赖于RBP-J的Notch通路以外,非经典的Notch信号通路在机体发育和成熟过程中同样发挥着重要作用。在乳腺癌中,非经典Notch通路激活PI3K通路促进癌细胞的迁移,其中没有明显的RBP-J参与[27]。在部分肺癌、胶质瘤、卵巢浆液性癌等肿瘤中,表皮生长因子家族delta样同源蛋白(delta-like 1 homolog,DLK1)缺乏Notch配体结构域,通过非经典通路拮抗Notch1信号转导[28]。然而,非经典Notch信号通路主要以果蝇为模型进行研究,在人体生理学中的相关研究较少。
三、展 望
Notch信号失调是肿瘤发生、发展的重要因素,它和其他信号机制之间并不是彼此孤立的,而是形成复杂的相互作用网络。现有研究已经证明,Notch信号通路不仅在肿瘤的发生、发展中至关重要,在预后中同样不可或缺,作为肿瘤的治疗靶点具有很大的前景(图2)。因此,以Notch为靶点或许可以为癌症预防和治疗药物开发提供新的策略。

图2 筛选Notch1~4基因在不同肿瘤及正常组织中表达的差异及预后分析GEPIA联合TCGA和GTEx数据库;A、D、G、J.筛选并分析Notch1~4表达差异有意义的肿瘤,红色代表肿瘤组织,蓝色代表正常组织;B、E、H、K.相比于正常组织Notch1-4高表达肿瘤的生存曲线;C、F、I、L.相比于正常组织Notch1~4低表达的生存曲线,红色代表Notch1~4高表达的肿瘤,蓝色代表Notch1~4低表达的肿瘤。*P<0.01
目前阻断Notch信号通路的药物和生物制剂已作为抗癌药物正在进行研发,如单克隆抗体Demcizumab(OMP-21M18)、γ-分泌酶抑制剂Nirogacestat(PF-03084014)、抗体药物偶联物rovalpituzumab tesirine、双特异性抗体Navicixizumab(OMP-305B83)等已进入临床试验阶段[29]。这些药物的抗肿瘤作用已经在一些难治性癌症如弥漫型胃癌、胰腺癌中进行了测试,然而,Notch靶向疗法尚未被批准用于癌症患者的治疗。首先,由于Notch通路与其他通路的互相作用的复杂性,简单地靶向Notch受体的抗体可能不足以抑制肿瘤的生长或转移;其次这些药物的不良效应和毒性同样是治疗过程中不可忽视的阻碍。因此,Notch靶向疗法的安全性和有效性仍需要进一步的研究。
Notch疗法与其他疗法的联合应用会是一条癌症防治的新思路。联合疗法的优点在于每种药物的应用剂量都较低,毒性减少,产生耐药性的风险也较小。关于联合疗法的开发和试验虽有理论数据的支持,实际技术尚未成熟。2021年3月,Denny等[30]指出生物医学方法、计算算法和高分辨率数据的可用性将在未来十年内急剧增加。这是一条新的思路,通过人工智能和基于自然语言处理和文本挖掘的认知计算构建Notch相关知识的数据库,将优化在精准医学时代的Notch靶向治疗方法,为癌症的预防和治疗提供了新的策略。

