RNA干扰沉默CLIC4基因对胃癌细胞增殖和侵袭的影响
彭如洁 曾庆新 邱锋 彭孝纬
(1福建医科大学福建省老年医院教学医院消化内科,福建 福州 350003;2福建省立医院消化病研究所)
胃癌是世界上癌症相关死亡的第二大常见原因〔1,2〕。离子转运蛋白在癌细胞中的作用是研究的热点,并且已经在消化系统肿瘤中发现了各种类型的离子转运蛋白〔3,4〕。氯离子胞内通道(CLIC)蛋白是哺乳动物细胞内新型阴离子通道的组成成分或调控因子。迄今为止,已经确定了7个不同的CLIC成员:CLIC1、CLIC2、CLIC3、CLIC4、CLIC5、p64和parchorin〔5〕。这些基因在其羧基末端具有高度同源性。就其体外分子功能而言,显然所有CLIC蛋白和无脊椎动物CLIC样蛋白均以可溶性球状蛋白和具有离子通道活性的整合膜蛋白存在。在大多数情况下,这两种形式之间的转变受pH和氧化还原条件的影响〔6〕。CLIC4也称为p64H1、RS43或mtCLIC,是CLIC家族的七个成员之一。CLIC4由253个氨基酸构成,蛋白分子量为29 kD,主要定位在线粒体上,此外在细胞核、高尔基体、内质网、微丝、细胞膜等部位亦有表达。CLIC4在脑、肝和皮肤等组织中表现出特别高的表达水平〔7〕。CLIC4具有抑制鳞癌的作用,并且CLIC4的减少程度与鳞状肿瘤从良性进展到恶性直接相关〔8〕。沉默CLIC4基因可促进U251细胞的自噬,并启动含半胱氨酸的天冬氨酸蛋白水解酶(caspase)相关线粒体途径的凋亡〔9〕。本研究旨在探讨RNA干扰沉默CLIC4基因对胃癌细胞增殖和侵袭的影响。
1 材料与方法
1.1细胞培养 人胃癌细胞系SGC-7901(腺癌)和MGC-803(腺癌)购自中国科学院(中国上海)的上海细胞库(http://www.cellbank.org.cn)。使用Dulbecco改良的Eagle培养基(DMEM,Gibco,美国)加入10%的胎牛血清(FBS,HyClone,美国)培养细胞,使用青霉素G(100 U/ml,Sigma,美国)和链霉素(100 μg/ml,Sigma,美国)双抗处理。细胞在37℃、5%CO2的培养箱中单层培养。
1.2实时荧光聚合酶链反应(PCR)检测 Trizol法提取总mRNA,取2 μg mRNA反转录合成cDNA,建立PCR体系,检测mRNA表达水平。CLIC4上游引物序列:5′-GACAAAGAGCCCCTCATCGA-3′,下游引物5′-GTTTCCAATGCTTTCACC-ATC-3′。甘油醛-3-磷酸脱氢酶(GAPDH)上游引物:5′-CAACGACCCCTTCATTGACC-3′,下游引物:5′-CGCCAGTAGACTCCACGACAT-3′。
1.3siRNA合成和细胞转染测定 针对CLIC4的四种人siRNA(GenePharma,中国上海)。一种与人、小鼠或大鼠基因序列无显著序列相似性的阴性随机siRNA(GenePharma,中国上海)用作阴性对照。CLIC4 siRNA和对照siRNA的序列为:siRNA1:CLIC4-Homo-131(正义链:5′-GAGCUUGUGUUGUG-CUGAATT-3′,反义链:5′-UUCAGCACAACAC-AAGCUCTT-3′);siRNA2:CLIC4-Homo-630(正义链:5′-CAGCACUCAAUGACAAUCUTT-3′,反义链:5′-AGAUUGUCAUUGAGUGCUGTT-3′);siRNA3:CLI-C4-Homo-805(正义链:5′-GCCAAAGUUACACAU-AGUATT-3′,反义链:5′-UACUAUGUGUAACUUUGGCTT-3′);siRNA4:CLIC4-Homo-1195(正义链:5′-GGACAACAUAUUUCAGUAATT-3′,反义链:5′-UUA-CUGAAAUAUGUUGUC-CTT-3′);和阴性随机siRNA 5(正义链:5′-UUCUCCGAACGUGUCACGUTT-3′,反义链:5′-ACGUGACACGUUCGGAGAATT-3′)。
分别将SGC-7901和MGC-803细胞系分为7组,分别为siRNA1组、siRNA2组、siRNA3组、siRNA4组、siRNA5组、模拟组(Mock组)和阴性对照组(CTRL组)。其中Mock组仅添加转染试剂,CTRL组添加非靶向对照siRNA和转染试剂,其余5组分别添加5种不同的CLIC4 siRNA和转染试剂。对于细胞转染,将细胞接种在96孔板(5×103细胞用于SGC-7901和3×103细胞用于MGC-803)和6孔板(5×105细胞用于SGC-7901和3×105细胞用于MGC-803)在含有10%FBS的DMEM中,附着24 h,然后每孔分别用5 pmol和100 pmol siRNA处理。将等摩尔量的siRNA与来自Invitrogen(Madison,WI,美国)的Lipofectamine2000转染试剂一起孵育,将转染的细胞在37℃下完全培养基上孵育6 h。细胞在试验前分别培养24 h、48 h和72 h。
1.4Western印迹 每孔蛋白上样量50 μg,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。电泳2 h后,转至聚偏氟乙烯(PVDF)膜上,用5%牛血清白蛋白封闭后,然后将膜与CLIC4特异性抗体(ABCAM;1∶1 000)和β-actin(ABCAM;1∶1 000)在4℃下孵育过夜。二抗(KPL;1∶5 000)室温孵育1 h。使用Odyssey(美国)的双色红外激光成像分析仪系统通过光密度分析来量化条带的密度。
1.5细胞生长和活力测定 通过四甲基偶氮噻蓝(MTT)比色法测定CLIC4特异性siRNA对细胞活力的影响。将细胞接种在96孔板中,分为3组,分别为siRNA3组、Mock组和CTRL组。转染siRNA 24 h、48 h和72 h后测定细胞活力。然后向每个孔中加入20 μl MTT(PBS原液中10 mg/ml,用培养基稀释至1 mg/ml的工作浓度)并孵育4 h。除去培养基后,向每个孔中加入200 μl二甲基亚砜并轻摇10 min。在酶标仪上以570 nm波长记录吸光度。CLIC4 siRNA对细胞生长抑制的影响评估为细胞存活率百分比。
1.6细胞周期分析和膜联蛋白V染色试验 对于流式细胞术细胞周期分析,收集用siRNA处理的细胞,用PBS洗涤,在冷的70%乙醇中固定,并在4℃下储存直至染色。固定后,用PBS洗涤细胞,并与100 μl RNaseA在37℃温育30 min,然后用400 μl碘化丙啶染色。使用来自BioVision的膜联蛋白V-FITC凋亡检测试剂盒检测早期和晚期的凋亡细胞。洗涤后,将细胞重悬于500 μl膜联蛋白V结合缓冲液中,然后加入5 μl膜联蛋白V-FITC和5 μl碘化丙啶。将样品在室温下在黑暗中温育5 min并使用流式细胞术分析。
1.7细胞迁移试验 使用聚碳酸酯膜细胞培养插入皿测量细胞通过过滤器迁移能力。转染后24 h,用胰蛋白酶消化细胞。使用具有8 μm孔径的聚碳酸酯膜的细胞培养插入皿。孔底含有5%FBS的培养基(0.5 ml),而将模拟、阴性对照或CLIC4 siRNA转染的细胞(1.0×106/ml悬浮于0.1 ml含0.5%FBS的培养基中)接种到上孔中并孵育24 h在37℃、5%CO2的培养箱中。刮去表面上的剩余细胞。然后洗涤膜,固定并用甲基紫染色。显微镜计数已迁移到过滤器下侧的细胞来确定细胞的迁移能力。
1.8基质胶侵袭试验 使用涂有基质胶的聚碳酸酯膜孔板进行基质胶侵袭试验。SGC-7901细胞密度为3.0×105/ml,MGC-803为1.5×105/ml。其他处理方法与细胞迁移试验相同。
1.9统计学分析 采用SPSS23.0软件进行单因素方差分析、Student-Newman-Keuls检验。
2 结 果
2.1CLIC4在胃癌细胞中的表达 人胃癌细胞系SGC-7901和MGC-803中均存在CLIC4 mRNA。见图1。
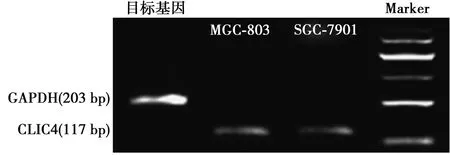
图1 CLIC4在胃癌细胞株SGC-7901和MGC-803中的表达
2.2CLIC4表达下调抑制胃癌细胞中CLIC4蛋白和mRNA的表达 在不同时间点,SGC-7901和MGC-803细胞系的siRNA5组、Mock组和CTRL组的CLIC4蛋白表达无显著差异(P>0.05),但此3组的CLIC4蛋白表达显著高于siRNA1组、siRNA2组、siRNA3组和siRNA4组(P<0.05),其中siRNA3组的蛋白表达水平最低(P<0.05)。见图2,图3,表1。
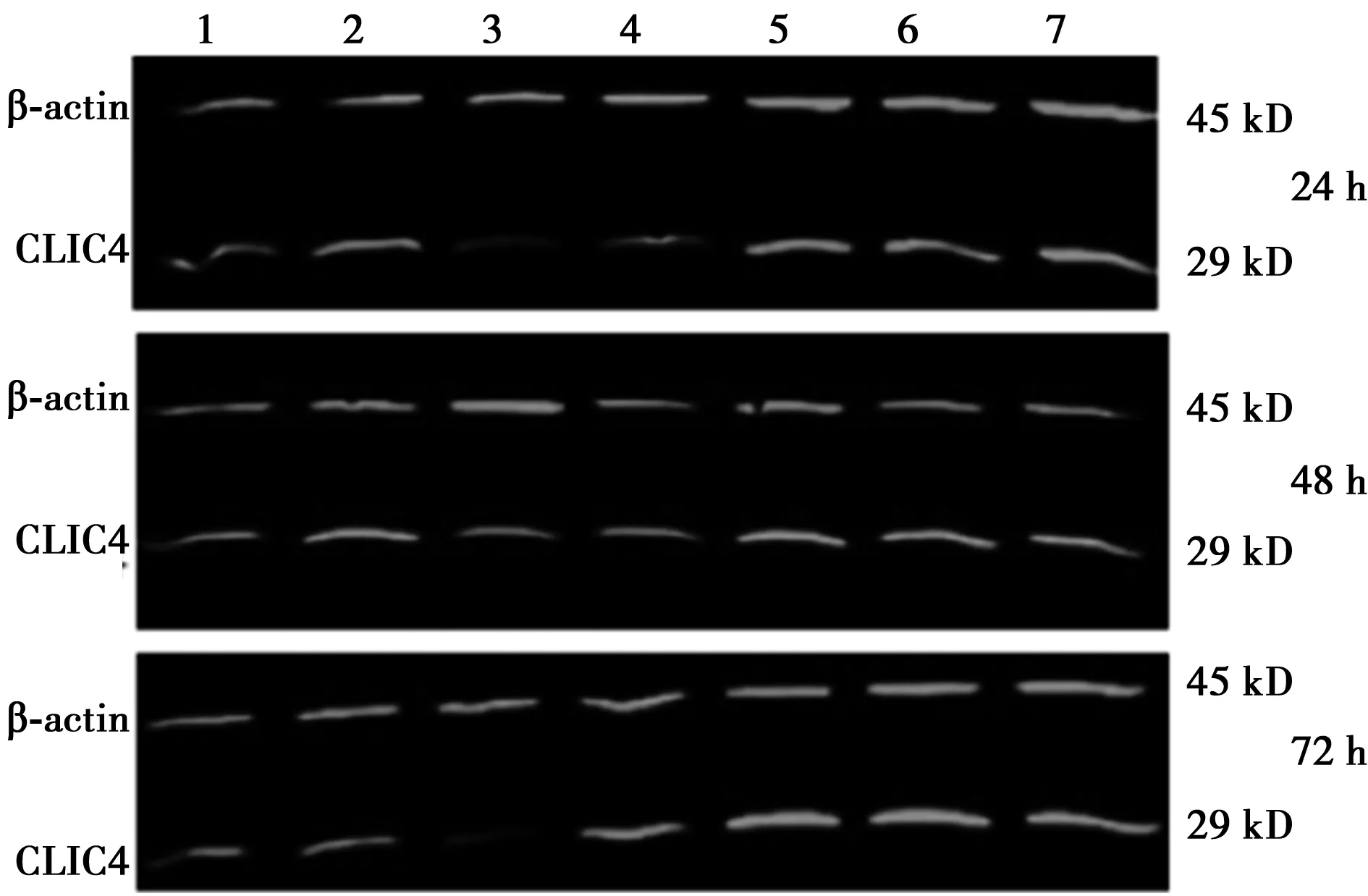
1~7:siRNA1组、siRNA2组、siRNA3组、siRNA4组、siRNA5组、Mock组、CTRL组;图3同

图3 MGC-803细胞系转染相关siRNA 24 h、48 h、72 h后CLIC4蛋白表达
表1 SGC-7901、MGC-803、中的CLIC4蛋白相对表达水平
在不同时间点,SGC-7901和MGC-803细胞系的siRNA5组、Mock组和CTRL组的CLIC4 mRNA表达无显著差异(P> 0.05),但此3组的CLIC4 mRNA表达显著高于siRNA1组、siRNA2组、siRNA3组和siRNA4组(P<0.05),其中siRNA3组的mRNA表达水平最低(P<0.05)。见表2。因此,选择CLIC4 siRNA3用于后续的体外试验。
表2 SGC-7901、MGC-803中的CLIC4 mRNA相对表达水平
2.3CLIC4敲低促进体外胃癌细胞的生长 siRNA3组的SGC-7901细胞系在24、78及72 h的吸光度显著高于Mock组和CTRL组(P<0.05),而Mock组和CTRL组的吸光度无显著差异(P>0.05)。siRNA3组的MGC-803细胞系在24、48及72 h的吸光度显著高于Mock组和CTRL组(P<0.05),而Mock组和CTRL组的吸光度无显著差异(P>0.05),见表3。表明siRNA3敲低CLIC4可促进体外胃癌细胞的生长。
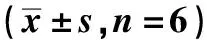
表3 SGC-7901和MGC-803细胞系的平均吸光度
2.4CLIC4表达下调诱导胃癌细胞中的细胞周期停滞 两种细胞系的siRNA3组的G2/M期比例显著高于Mock组和CTRL组,而G0/G1期和S期比例显著低于Mock组和CTRL组(P<0.05)。见表4。
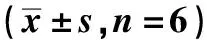
表4 SGC-7901和MGC-803细胞系的细胞周期分布
2.5CLIC4表达下调在体外抑制胃癌细胞凋亡 SGC-7901和MGC-803细胞系siRNA3组的凋亡率〔(8.9±1.1)%,(9.0±1.5)%〕均显著低于Mock组〔(25.5±3.5)%,(20.4±2.6)%〕和CTRL组〔(23.8±3.2)%,(19.5±3.8)%,均P<0.05〕。
2.6CLIC4表达下调抑制胃癌细胞的体外迁移和侵袭 siRNA3组在两种胃癌细胞系中的侵袭、迁移细胞数显著低于Mock组和CTRL组(P<0.05),见图4、表5。表明抑制CLIC4敲低显著抑制SGC-7901和MGC-803细胞的侵袭和迁移能力。
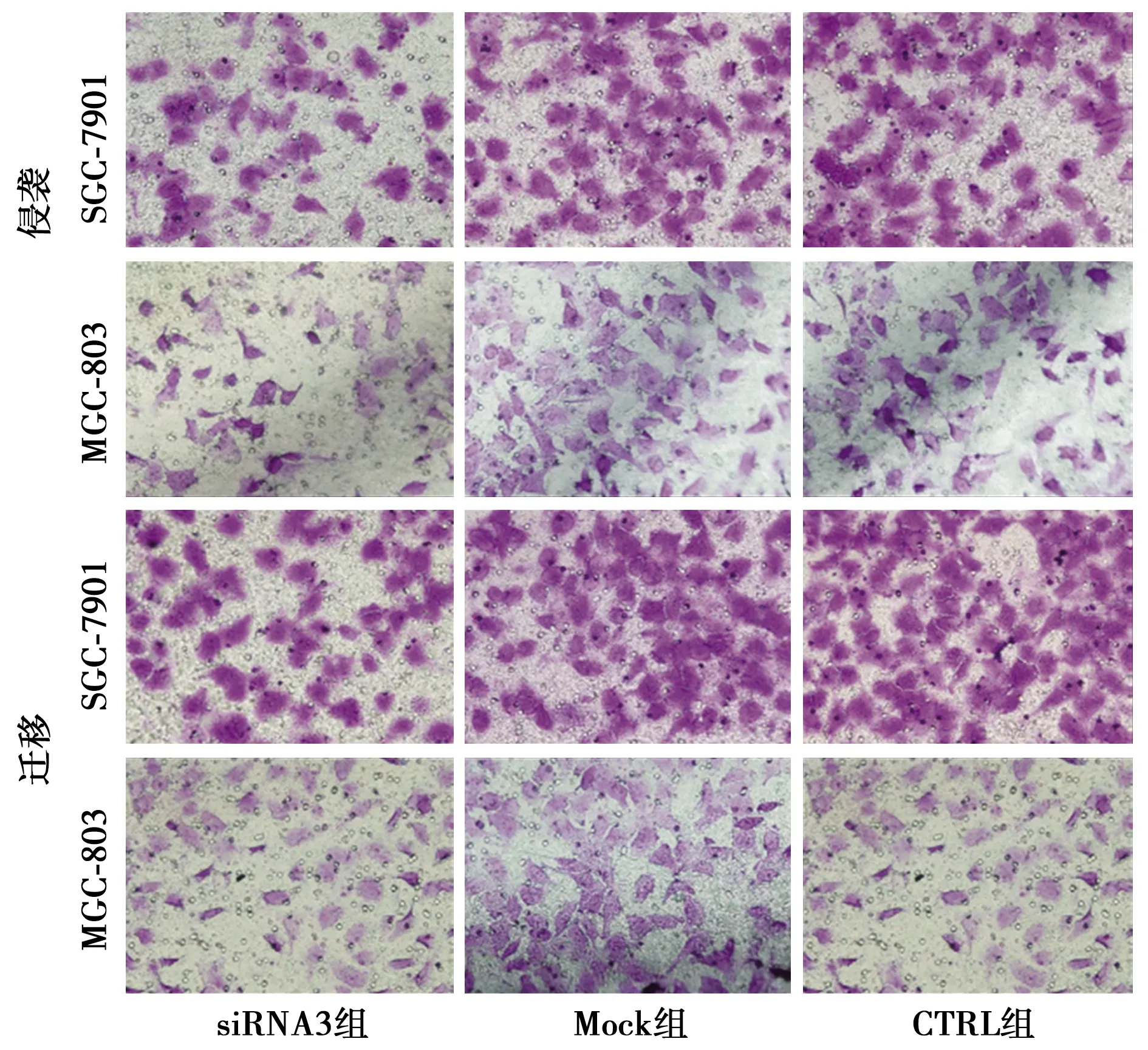
图4 CLIC4敲低对SGC-7901和MGC-803细胞48 h细胞迁移和侵袭的影响(结晶紫,染色×200)

表5 胃癌细胞系的受侵袭细胞数和平均迁移细胞数个)
3 讨 论
胃癌是一种高度侵袭性和致命的恶性肿瘤,占全球所有新发癌症病例的8.6%,是癌症相关死亡的第二大原因〔10〕。手术是局部胃癌的标准治疗方法,但远处转移或复发的晚期患者仍无法治愈〔11,12〕。与邻近的正常组织相比,肿瘤组织中的CLIC4表达增加1.95倍〔13,14〕。CLIC4表达增加与淋巴结转移、淋巴和神经周围侵袭、病理分期和不良生存率密切相关。
本研究发现两种细胞系中的抑制率不同,可能原因是两种细胞系之间不同的细胞生长特征和组织来源。
本研究结果表明siRNA3对CLIC4的下调促进了胃癌细胞的增殖;CLIC4参与了G2/M期细胞周期的调控,并在细胞分裂过程中发挥了重要作用。
有学者发现CLIC4的过表达显著增加细胞活力,CLIC4的敲低显著抑制细胞迁移和侵袭〔15〕。本研究结果表明siRNA3下调CLIC4表达明显抑制了体外培养的SGC-7901和MGC-803细胞的侵袭和迁移能力。研究解释了CLIC4如何促进癌细胞的运动,发现CLIC4与改变细胞黏附有关〔16〕。整合素对癌细胞的侵袭和转移至关重要,是细胞黏附分子的主要家族,介导细胞-细胞黏附或细胞-细胞外基质黏附,影响信号转导、细胞增殖、分化、存活和凋亡〔17〕。通过增加β1、α3和αvβ3的表面表达,CLIC4表达的下调可以增加内皮细胞与细胞外基质的黏附,并通过阻止细胞与细胞外基质的接触来抑制运动。整合素表达的这些变化也为细胞生长和活力缺陷提供了可能的解释〔18〕。此外,研究证实胃癌的侵袭和迁移与整合素密切相关〔19〕。

