miR-26a通过促进KLF9的转录表达抑制胶质瘤侵袭能力
王必佳,李浩诣,周振华,陈康宁,桂 莉,肖 力,李学刚(陆军军医大学第一附属医院神经内科,重庆 400038;陆军军医大学第一附属医院神经外科;共同第一作者;通讯作者,E-mail:lxg003@63.com)
在中枢神经系统肿瘤中,胶质瘤有着极强的侵袭能力,其生物学特性使治疗很难奏效[1]。目前为止,用于胶质瘤患者标准的治疗是外科切除、放疗和传统的化疗。同样,一些新兴治疗手段如肿瘤治疗电场(tumor treating field,TTF),在胶质瘤治疗中也取得了可喜的成果,在最新的国内外诊疗规范中指出肿瘤治疗电场被推荐应用于新诊断和复发的胶质母细胞瘤(glioblastoma multiform,GBM)患者治疗中[1]。随着个体化治疗和精准医疗的兴起,分子分型在指导临床治疗胶质瘤中具有重要地位。
目前发现一些蛋白质基因能够有效地抑制肿瘤的生长,有望突破治疗这一瓶颈。寻找能够上调或者下调肿瘤相关活性基因,并将其运用到治疗胶质瘤的临床治疗之中变得尤为重要。
KLF9是KLF(Krueppel-like factor)家族中的一员,在肿瘤侵袭性发生发展中扮演着重要的角色,如在食道鳞状细胞癌中,KLF9通过负调控TCF/β-catenin信号传导来抑制肿瘤的生长和转移[2]。KLF9还能通过抑制MMP9转录来抑制乳腺癌的侵袭[3]。此外,KLF9可正向调节肝癌细胞中的p53表达,进一步诱导细胞凋亡[4],但是KLF9在人胶质瘤细胞侵袭性中的作用尚待研究。
miRNA是高度保守的非编码RNA。miRNA的功能具有两面性,当miRNA在细胞浆时,它通过传统的机制结合靶基因的3′UTR抑制基因的表达(即负向调控),而少数miRNA则通过细胞核介导激活增强子发挥系统性的基因激活作用[5](即正向调控)。miRNA-26a或许就是少数正向调控miRNA中的一员,有报道发现,在肝细胞癌(HCC)小鼠模型中miR-26a表达减少抑制PTEN表达导致癌细胞侵袭增加[6]。到目前为止,miR-26a对胶质瘤细胞侵袭性中的作用还尚待研究,与此同时,miR-26a能否调控KLF9来调节胶质瘤细胞的侵袭性仍然尚不明确。本研究通过收集136例不同级别的胶质瘤组织,了解miR-26a、KLF9与胶质瘤侵袭能力之间的关系,为神经胶质瘤患者的预后以及治疗提供辅助参考,进一步提高患者的生存与生活质量,丰富临床诊疗方案。
1 材料和方法
1.1 一般资料
经西南医院医学伦理研究委员会审查并批准,患者知情同意。选取2012年10月至2018年3月西南医院神经外科脑外科收治的神经胶质瘤患者136例,其中男80例,女56例;年龄50~61岁。所有患者均有明确的病理诊断,且术前未接受治疗。术中取得成对的神经胶质瘤组织样本和癌周组织样本,置于液氮中保存待用。所有胶质瘤样本根据2016版《WHO中枢神经系统肿瘤分类》分成Ⅱ级胶质瘤55例(星形细胞瘤10例、少突细胞胶质瘤12例、少突-星形细胞胶质瘤10例、室管膜瘤13例、黏液型毛细胞星形细胞瘤10例)、Ⅲ级胶质瘤51例(间变型星形细胞瘤15例、间变型少突细胞胶质瘤15例、间变型少突-星形细胞胶质瘤11例、间变型室管膜瘤10例)、Ⅳ级胶质瘤30例(胶质母细胞瘤30例),癌周组织65例(Ⅱ级胶质瘤周组织20例,Ⅲ级胶质瘤周组织30例,Ⅳ级胶质瘤周组织15例)。
1.2 材料与试剂
人源胶质瘤细胞株SNB19细胞系获于西南医院神经外科。胎牛血清、RPMI1640培养基、慢病毒(LV-hsa-miR-26a-mimics)购自上海TaKaRa公司;KLF9单克隆抗体购自美国Thermo Scientific公司(ab179880);si-KLF9购自Genechem(中国上海);Lipofectamine 3000购自中国ThermoFish公司;用于实时荧光定量PCR(quantitative)购自中国OriGene公司;Real-time PCR(qRT-PCR)检测的TRIzol试剂盒购自中国GeneCopoeia公司;KLF9启动子与对应突变克隆的相关引物由上海TaKaRa公司合成;反转录试剂盒(FSQ-101)购自美国Abcam公司;PCR试剂盒购自美国BD公司。
1.3 细胞培养、慢病毒感染和分组
将SNB19细胞分为3组:对照组(未转染的SNB19细胞)、miR-26a mimics组(转染miR-26a mimics的细胞)和miR-26a-si-KLF9组(转染miR-26a mimics和KLF9特异性siRNA的细胞)。于37 ℃、5%CO2的条件下用含有10%胎牛血清的RPMI-1640培养基培养。收集处于对数生长期的胶质瘤SNB19细胞,按照Lipofectamine 3000转染试剂说明书步骤转染miR-26a mimics和si-KLF9(序列片段UGGCGGGAAGUGUGAAGCG)。用嘌呤霉素筛选转染2周的细胞以获得稳定的转染细胞。
1.4 生物信息学预测miR-26a的靶基因
通过公共生物信息学软件TargetScan(https://targetscan.org/vert-72/)、ENCORI(https://star-base.sysu.edu.cn/agoClipRNA.php?source=mRNA)预测miR-26a可能的靶基因及其作用位点,并结合文献分析。
1.5 荧光素酶活性测定
扩增野生型KLF9 3′-UTR(5′-ugauUUAAUUGGAGAUCAGUAUUa-3′)和突变型KLF9 3′-UTR(5′-ugauUUAAUUGGAGAUCUCGUGGa-3′),并将其克隆到pGL3报告质粒(Promega)中荧光素酶基因的下游。所构建的载体分别命名为wt-KLF9-PGL3和mut-KLF9-PGL3。对于荧光素酶报告基因测定,将SNB19细胞培养在24孔板中,wt-PTEN-PGL3和mut-PTEN-PGL3分别与miR-26a mimics共转染,并培养48 h。分别以wt-PTEN-PGL3和mut-PTEN-PGL3载体与miR-26a mimics共转染SNB19细胞为野生型试验组和突变型试验组,分别以wt-PTEN-PGL3和mut-PTEN-PGL3载体转染SNB19细胞为野生型对照组和突变型对照组。根据制造商的方案,使用双重荧光素酶报告基因测定系统测量荧光素酶活性。
1.6 qRT-PCR检测miR-26a在胶质瘤组织及细胞中的表达
将收集的各级胶质瘤组织和SNB19胶质瘤细胞按照RNAiso Plus试剂盒说明书提取组织和细胞的总RNA,用NanoDrop分光光度计测定总RNA在280 nm处的光密度值并定量。使用All-in-One miRNA qRT-PCR试剂盒检测miRNA的表达,PCR扩增条件为95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火20 s和72 ℃延伸10 s,共40个循环。使用带有gDNA Eraser的PrimeScript RT反转录试剂盒合成cDNA,并使用SYBR Premix Ex Taq进行定量PCR,PCR扩增条件为95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s和72 ℃延伸10 s,共40个循环。miR-26a正向引物序列为5′-GAAGATCTGAGG-CCCATCTGAGGTCT-3′,反向引物序列为5′-CCCAGACTTAAA-GGCTTCCACCACGAAT-3′。所有反应均在实时定量PCR系统(Bio-Rad,美国)上一式三份进行。根据2-ΔΔCt计算目的基因的相对表达量。
1.7 Western blot检测胶质瘤组织及细胞中KLF9的表达水平
收集对照组、miR-26a mimics组细胞和各级胶质瘤组织,应用T-PER组织蛋白质提取试剂中蛋白酶抑制剂苯甲基磺酰氟提取总蛋白质,配制SDS变性质量分数为10%的SDS-十二烷基硫酸钠(SDS-PAGE)凝胶,混合蛋白样品和上样缓冲液,电泳。总蛋白被转移到聚偏二氟乙烯(PVDF)膜上,5%脱脂奶粉封闭膜2 h后,将膜置于MYCBP一抗(1 ∶1 000)中,4 ℃摇动孵育,然后与辣根过氧化物酶一起孵育。抗人GAPDH小鼠单克隆IgG(1 ∶5 000)估算蛋白质负荷。ECL Detection Systems检测免疫活性蛋白质。
1.8 Transwell实验检测各组细胞侵袭能力
转染48 h后消化细胞,分别在对照组、miR-26a mimics组和miR-26a-si-KLF9组对应的Transwell小室上室中加入经无血清DMEM以1 ∶3比例稀释的基质胶15 μl,7.5 μl,7.5 μl,接种经无血清DMEM培养基重悬的SNB19细胞100 μl(含5×105个细胞),下室加入500 μl含10%FBS的DMEM培养基,孵箱培养24 h后弃去小室内培养液,棉棒擦拭去除上室底膜上的细胞,4%多聚甲醛固定,0.1%结晶紫染色40 min。穿透基质胶的细胞数量用于评估细胞的侵袭能力。每个实验进行3次。
1.9 统计学分析
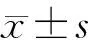
2 结果
2.1 miR-26a和KLF9在胶质瘤中的表达水平变化
qRT-PCR结果表明,与癌周组织(NC)相比,miR-26a mRNA的水平在Ⅱ、Ⅲ和Ⅳ级胶质瘤中明显降低(P<0.05,见图1);Western Blot结果表明,KLF9的表达在Ⅱ、Ⅲ和Ⅳ级胶质瘤中明显降低(P<0.05,见图1)。miR-26a和KLF9的表达水平均有随着肿瘤等级增高而降低的趋势。
2.2 转染miR-26a后KLF9转录活性验证
通过在线分析软件预测发现,miR-26a与KLF9的3′-非翻译区高度同源配对,提示KLF9可能是miR-26a的靶标基因(见图2A);双荧光素酶基因报告显示miR-26a的转染显著增强正常KLF9基因启动子活性,而不影响突变型启动子活性(见图2B)。
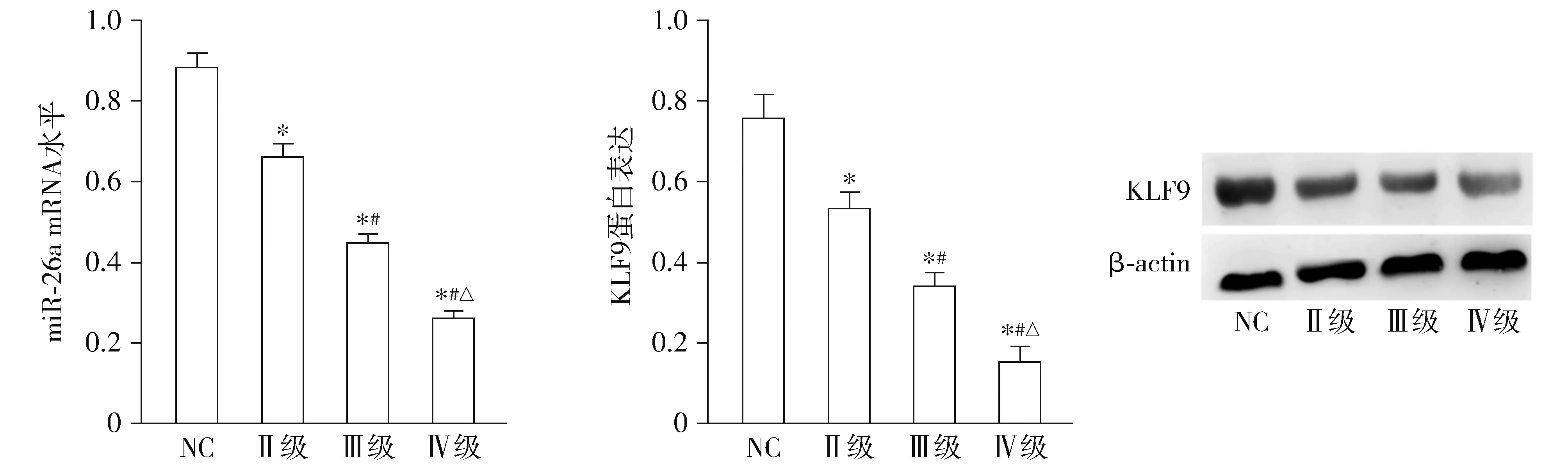
与NC组相比,*P<0.05;与Ⅱ级相比,#P<0.05;与Ⅲ级相比,△P<0.05图1 不同分级胶质瘤中miR-26a和KLF9的表达情况Figure 1 Expression of miR-26a mRNA and KLF9 protein in different grades of glioma
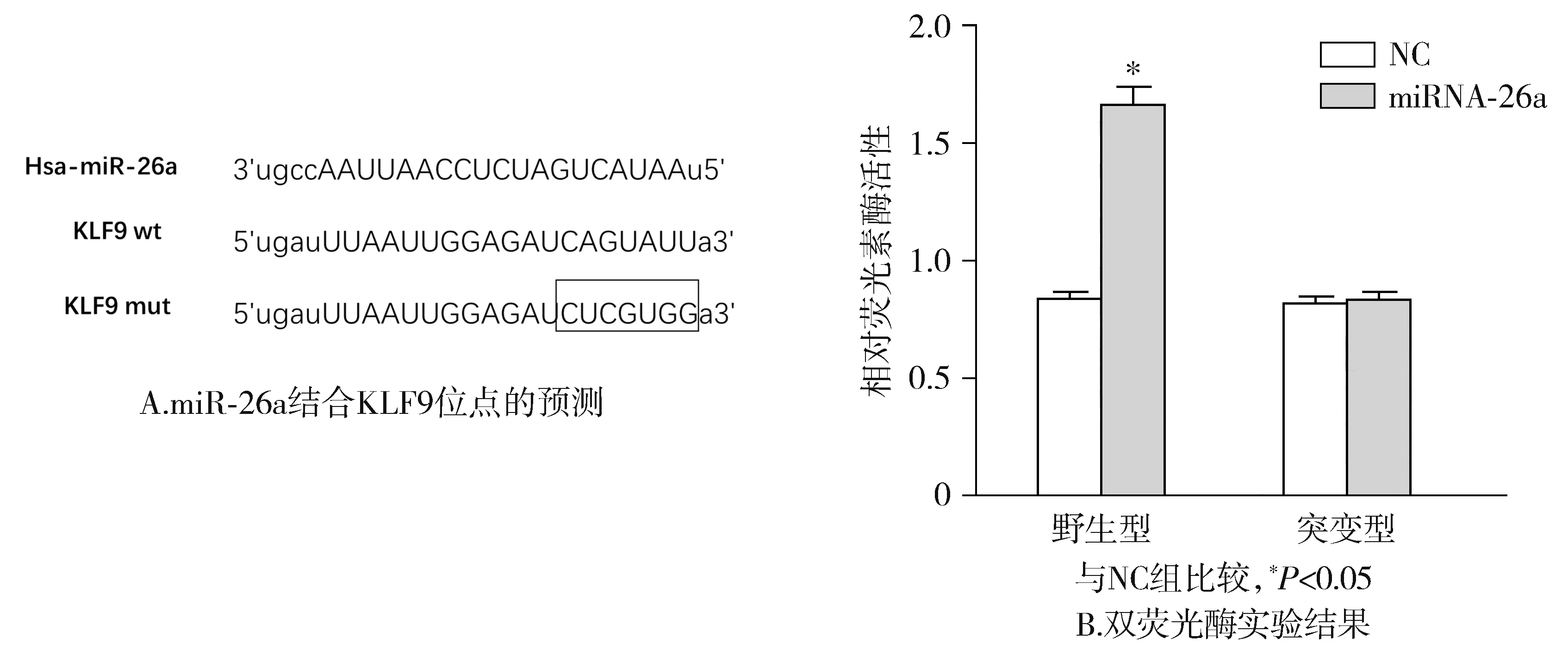
图2 双荧光酶验证KLF9是miR-26a下游的靶向基因Figure 2 KLF9 is the downstream target gene of miR-26a
qRT-PCR结果表明,转染miR-26a mimics可使神经胶质瘤细胞中miR-26a表达显著增加(P<0.05,见图3)。转染miR-26a mimics可增加SNB19细胞中KLF9蛋白质水平(P<0.05,见图4)。
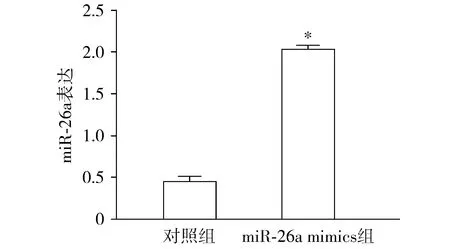
与对照组比较,*P<0.05图3 qRT-PCR检测胶质瘤细胞转染miR-26a mimics后miR-26a的表达情况Figure 3 The expression of miR-26a detected by qRT-PCR
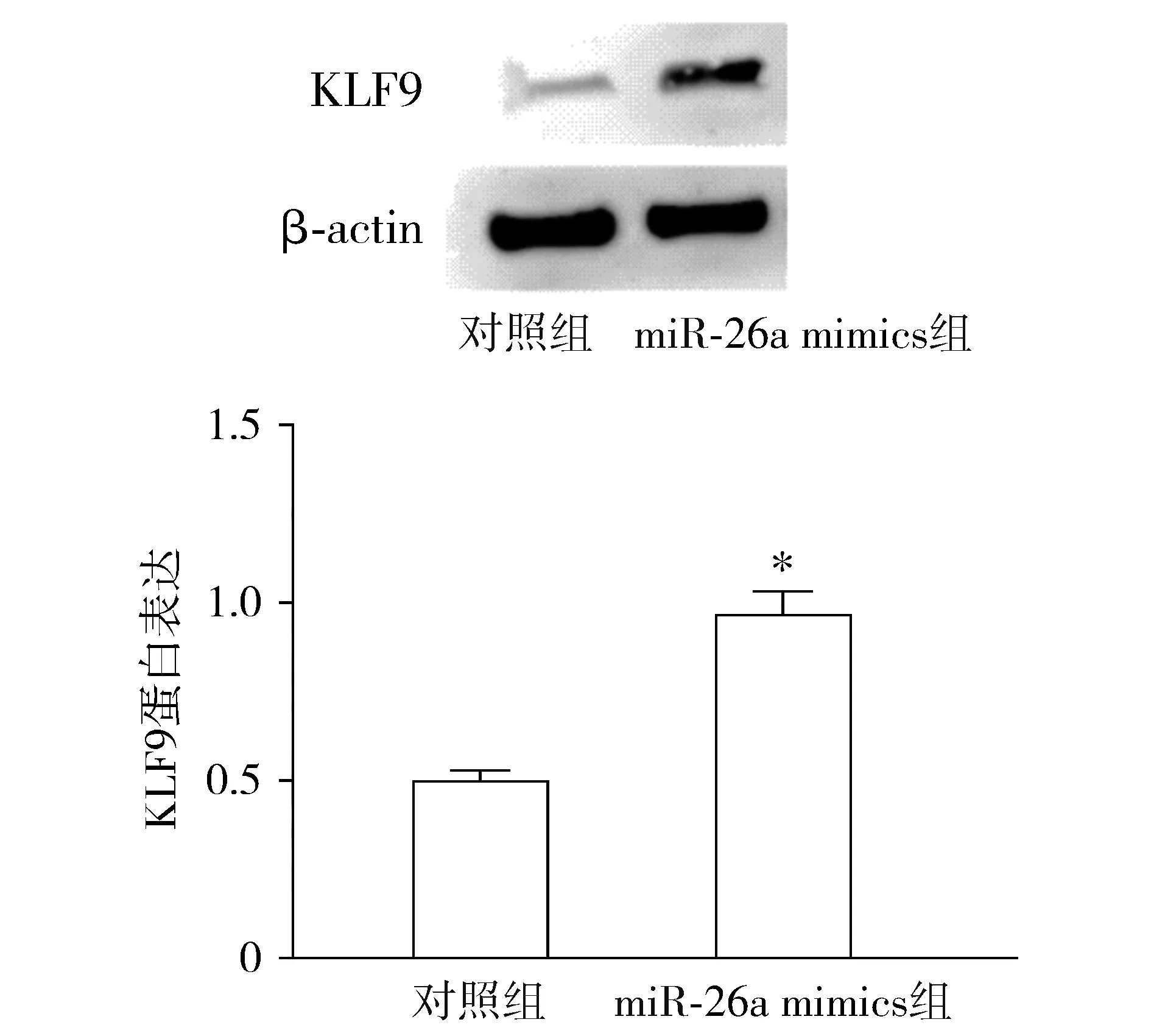
与对照组比较,*P<0.05图4 转染miR-26a mimics后KLF9表达增多Figure 4 The expression of KLF9 increases after miR-26a mimics transfection
2.3 转染miR-26a后KLF9靶基因表达情况
结果显示,细胞转染miR-26a mimics后神经胶质细胞瘤细胞中KLF9 mRNA的表达增加(P<0.05,见图5)。提示miR-26a可调节神经胶质细胞瘤细胞中KLF9的转录活性。
2.4 转染miR-26a后SNB19细胞侵袭能力的变化
分析三组的细胞侵袭数发现,与对照组相比,miR-26a mimics组与miR-26a-si-KLF9组细胞的侵袭能力显著降低(P<0.01)。与miR-26a mimics组相比,miR-26a-si-KLF9组的细胞侵袭能力更强(P<0.05,见图6)。
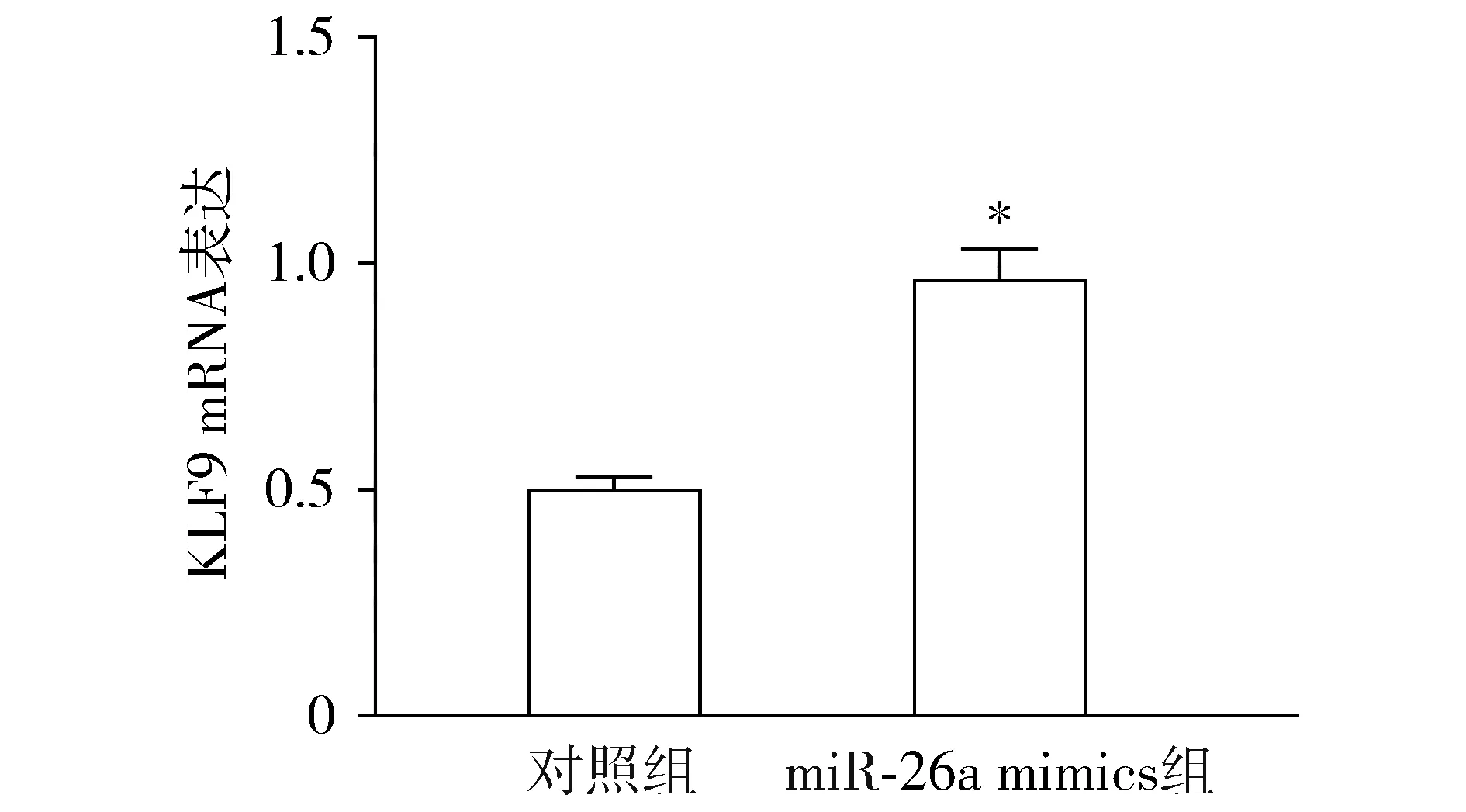
与对照组比较,*P<0.05图5 qRT-PCR检测转染miR-26a mimics后KLF9 mRNA的表达Figure 5 The expression of KLF9 mRNA after miR-26a mimics transfection detected by qRT-PCR
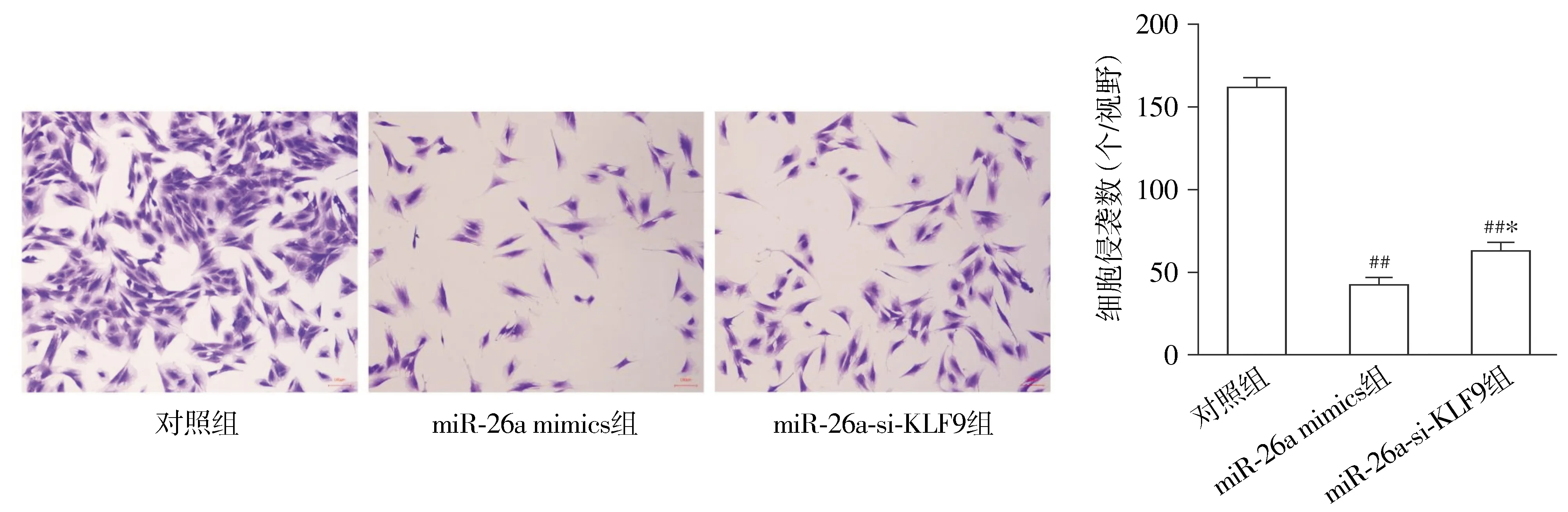
与对照组相比,##P<0.01;与miR-26a mimics组相比,*P<0.05图6 Transwell侵袭实验检测miR-26a对人胶质细胞瘤SNB19的影响 (×100)Figure 6 Effect of miR-26a on human glioma SNB19 detected by Transwell invasion assay (×100)
3 讨论
有研究显示,miRNA会影响许多细胞生物学行为,多数认为miRNA可能是胶质瘤细胞侵袭的基本调节剂[7]。在功能上,miR-26a能抑制神经胶质瘤细胞的侵袭,miR-26a低表达时,侵袭细胞的数量显著增加,而转染miR-26a mimics后,细胞侵袭数量则显著减少,表明miR-26a能抑制侵袭起抑癌基因的作用。
EMT是一个复杂的过程,使上皮细胞在转移过程中失去分化特征并获得间质表型,是HCC进展中肿瘤细胞浸润和转移相关的关键事件[8]。其诱导的级联反应与上皮标记物(例如E-钙黏蛋白,闭合蛋白,亲脂蛋白和细胞角蛋白)的表达降低以及间充质标记物(包括波形蛋白,N-钙黏着蛋白和纤连蛋白)的表达增加有关。此外,EMT可以由miRNA调控[9],miR-26a的下调可以显著增强波形蛋白的表达;降低E-钙黏蛋白的表达,在EMT过程中具有积极作用。
据报道,miR-26在癌症发生过程中起重要作用[10],其表达水平和病理功能是细胞背景依赖性的。有研究证实miR-26家族在各种类型癌症(包括食管癌,乳腺癌)中发挥肿瘤抑制作用[11,12]。miR-26a通过调节EZH2生物活性抑制人膀胱癌的细胞增殖并诱导其凋亡[13]。本研究发现miR-26a在胶质细胞瘤中发挥重要调控作用,在SNB19细胞中促进KLF9转录,降低细胞侵袭能力。我们研究结果显示,神经胶质细胞瘤组织中miR-26a的表达显著降低,恢复表达可抑制神经胶质细胞瘤细胞侵袭,miR-26a可能在神经胶质细胞瘤的发展中起到肿瘤抑制基因的作用。miR-26在不同肿瘤中的功能不同,可能是由于调节不同的靶标所致。通常,miRNA与目标mRNA的3′UTR结合,导致mRNA裂解或翻译抑制。此外,有研究证明,miRNA还可以通过与靶基因的启动子或3′UTR相互作用来增强基因表达。例如,miR-205通过靶向前列腺癌启动子中的特定位点来诱导白介素(IL)抑癌基因IL-24和IL-32的表达[14]。有实验发现miRNA-346以GRSF1依赖性方式结合人端粒酶催化蛋白亚单位(hTERT)的3′UTR[15]。本研究结果表明miR-26a在神经胶质瘤中表达常常是降低的,其低表达导致较差的预后结局,并且miR-26a和KLF9基因之间存在正向靶向调节,miR-26a能够增强KLF9基因的转录。同时KLF9基因沉默后,miR-26a丧失调控肿瘤侵袭效应。综上,miR-26a靶向KLF9并增强其基因表达,抑制神经胶质瘤细胞侵袭。但是,其基本机制仍不清楚,需要进一步阐明。
KLF9被认为是癌症中的肿瘤抑制因子,在许多类型的人类恶性肿瘤中KLF9的表达降低,如胰腺导管腺癌、食道鳞状细胞癌、肝细胞癌和前列腺癌。越来越多的证据表明,KLF9在致癌和癌症进展中具有重要作用,能够抑制肿瘤和调节多种细胞过程,包括细胞增殖、细胞凋亡、迁移和侵袭[16]。本实验结果表明,在胶质瘤组织和细胞系中KLF9表达降低,促进了体外细胞侵袭。这些结果提示,KLF9可能是胶质瘤患者目标期望靶。然而,KLF9在卵巢癌中的功能不同于其他癌症,在卵巢癌中KLF9表达水平明显增加,而抑制KLF9表达会导致卵巢癌细胞生长受到抑制[2]。这种结果表明KLF9在不同类型的肿瘤组织中起不同的作用。KLF9如何调节每种类型的癌症是一个复杂且依赖上下文的过程,需要进一步详细研究。在本研究中,当转染si-KLF9时,由miR-26a引起的表型改变被抵消,表明miR-26a通过增加KLF9表达来调节神经胶质瘤细胞侵袭。但是,KLF9的作用是通过何种途径尚待确定,这也将是我们下一步研究的重点。
目前多数针对恶性神经胶质瘤治疗的预后效果较差,亟需寻找新的治疗靶点,提出更有效和毒性较小的治疗策略。KLF9基因是肿瘤预后的评估指标,且有助于研究肿瘤的作用机制。因此,基因治疗对肿瘤的诊断具有重要意义。本研究显示,miR-26a可能起到调控抑癌基因的作用,可以通过促进KLF9的表达减少神经胶质瘤细胞侵袭,增加现有miRNA调控网络的复杂性,提出用于胶质瘤管理的潜在诊断和治疗策略。

