慢性肾功能不全对急性冠脉综合征病人1年内缺血和出血事件的影响
李元玲,韩坤元,林儒峥,林桂香
慢性肾功能不全(CRF)是急性冠脉综合征(ACS)病人常见的合并症,与临床预后密切相关[1]。评估肾功能的一个简单方法是使用估计的肾小球滤过率(eGFR)方程,如Cockcroft-Gault公式、肾脏疾病饮食改良-4(MDRD-4)公式和慢性肾脏病流行病学合作研究(CKD-EPI)公式[2]。《2012年改善全球肾脏病预后组织(KDIGO)贫血指南解读》[3]建议使用CKD-EPI公式,与其他方法相比,CKD-EPI更精确、偏差更小。对ACS病人的调查研究显示,在以CRF为基线的亚组中,住院和随访心血管事件的发生率更高[4],这可能由多种机制引起,包括高炎症状态和血栓形成前环境,使肾功能受损病人出现动脉粥样硬化及血栓形成事件[5]。研究表明,ACS病人早期出血事件的发生率也较高[6]。在目前的ACS治疗策略背景下,尚无以缺血性和出血性并发症的累积发生率作为研究终点来探讨肾功能与临床结果之间的相关性研究。本研究探讨CRF对ACS病人1年内复合终点的预测作用。
1 对象与方法
1.1 研究对象 选取2016年1月—2018年12月海南省人民医院收治的ST段抬高型心肌梗死(STEMI)或非ST段抬高型ACS(NSTE-ACS)病人。为了减少选择偏差,在开始抗血小板治疗中没有明确的排除标准;所有病人在住院期间均进行了临床评估以评估指标事件(基线评估),随后分别在6个月和1年时进行随访评估。本研究的目的是调查肾功能损害对ACS病人预后的影响,因此,排除了接受使用造影剂后出现的急性肾损伤的肾功能正常的病人。相反,无论造影剂暴露后是否发生急性肾损伤,均纳入基线CRF病人。最终纳入病人805例。
1.2 肾功能不全的评估 初步比较Cockcroft-Gault公式、MDRD公式和CKD-EPI公式预测1年后的不良事件。用具有最佳预测值方程探讨肾功能不全与临床结局的关系。根据体表面积调整eGFR,eGFR<60 mL/(min·1.73 m2)为肾功能不全。
1.3 临床结果及研究终点 主要终点是基线肾功能不全与复合终点发生率的关系,包括1年时的主要心血管不良和出血事件(MACBE),即缺血性心血管事件(心肌梗死、冠状动脉再血管化、脑卒中或心血管死亡)和主要出血事件。根据肾功能和并发贫血(血红蛋白女性<120 g/L,男性<130 g/L)或糖尿病,对主要心血管不良和出血事件的发生率进行二次分析。冠状动脉血运重建定义为经皮冠状动脉介入治疗(PCI)或冠状动脉旁路手术。脑卒中定义为突然发作的局灶性神经功能缺损,通常分布在单个脑动脉(包括视网膜动脉)的范围内,持续时间>24 h。根据心肌梗死溶栓标准,将大出血分为颅内出血或临床上明显出血,并伴有血红蛋白降低>50 g/L。
1.4 统计学处理 采用SPSS 22.0软件进行数据分析。连续变量符合正态分布的定量资料采用t检验(Kolmogorov-Smirnov检验评估),不符合正态分布的定量资料采用Mann-WhitneyU检验。当预期频率<5时,采用Fisher精确检验,否则采用χ2检验(Yates′校正)。不同方程式的eGFR值采用Pearson相关分析。通过受试者工作特征曲线(ROC)分析评估每个方程区分主要心血管不良和出血事件发生的能力。采用Logistic回归分析肾功能不全对主要心血管不良和出血事件发病率的影响:首先在单变量模型中评估表1所示的每个变量,然后将P<0.15的变量纳入到多因素Logistic回归分析模型中;回归模型的诊断检验显示Hosmer和Lemeshow检验的P值为0.90,C统计量的P值为0.72;计算优势比(OR)、95%置信区间(CI)和相应的P值。以P<0.05为差异有统计学意义。

表1 两组基线资料比较 单位:例(%)
2 结 果
2.1 肾功能不全的评估 基线时肾功能不全[eGFR<60 mL/(min·1.73 m2)]发生率,Cockcroft-Gault方程为20.2%,MDRD方程为14.6%,CKD-EPI方程为21.8%,无病人接受透析。eGFR比较,使用Cockcroft-Gault方程为89.2 [四分位间距为(64.7,124.1)]mL/(min·1.73 m2),使用MDRD方程为92.6(71.1,114.0)mL/(min·1.73 m2),使用CKD-EPI方程为81.5(64.0,94.4)mL/(min·1.73 m2)。Cockcroft-Gault方程得出的eGFR值与MDRD(r=0.871,P<0.001)和CKD-EPI(r=0.816,P<0.001)方程的eGFR值显著相关。在总体人群中,1年时主要心血管不良和出血事件的累积发病率分别为8.6/100例和69/805例。3个方程预测主要心血管不良和出血事件风险的能力是中等和相似的。Cockcroft-Gault方程曲线下面积(AUC)为0.548,95%CI(0.461,0.642);MDRD方程AUC为0.523,95%CI(0.435,0.627);CKD-EPI方程AUC为0.534,95%CI(0.442,0.648);总体P=0.741。详见图1。

图1 3个方程预测1年主要不良心血管和出血事件的ROC曲线
虽然Cockcroft-Gault方程的AUC不显著,但较大,使用该方程进一步评估CRF对1年临床结果的影响,结果显示,肾功能不全组(163例)和肾功能正常组(642例)病人的基线临床变量特点为:肾功能不全组年龄>75岁、女性、NSTE-ACS、原发性高血压、糖尿病、既往心肌梗死、合并心房颤动、左心室射血分数≤40%、体质指数≥30 kg/m2、贫血均高于肾功能正常组,差异均有统计学意义(P<0.05);STEMI、吸烟低于肾功能正常组,差异均有统计学意义(P<0.05)。治疗方面,肾功能不全组药物保守治疗、PCI,使用他汀类药物、阿司匹林、氯吡格雷较肾功能正常组高,差异均有统计学意义(P<0.05);使用ACEI/ARB类药物、替格瑞洛较肾功能正常组低,差异均有统计学意义(P<0.05)。

(续表)
2.2 临床结果及研究终点分析 CRF病人1年时主要心血管不良和出血事件的发生率为12.6%,而肾功能正常病人为7.4%(P=0.042);Logistic回归分析显示,CRF与复合终点的风险增加明显相关[OR=1.844,95%CI(1.038,3.275),P=0.041]。女性和糖尿病是主要心血管不良和出血事件的独立预测因子,而在随访期间使用ACEI/ARB类和他汀类药物对肾功能具有保护作用。详见表2、图2。

表2 主要心血管不良和出血事件的Logistic回归分析
CRF病人主要心血管不良和出血事件的增加率与指标事件的临床表现无关:STEMI病人425例,肾功能正常与肾功能不全比例为14.5%与7.7%[OR=2.053,95%CI(0.891,4.694),P=0.142];NSTE-ACS病人380例,肾功能正常与肾功能不全比例为11.2%与7.1%[OR=1.653,95%CI(0.742,3.663,P=0.262),交互P=0.703]。此外,替格瑞洛与氯吡格雷使用情况比较,肾功能、复合终点治疗没有明显的相互作用(P>0.05)。关于复合终点,肾功能不全病人比肾功能正常病人的缺血事件[9.3%与5.8%;OR=1.649,95%CI(0.786,3.197),P=0.14]和重大出血并发症[4.6%与2.0%;OR=2.876,95%CI(1.124,6.998),P=0.029]的发生率更高。详见图2。

图2 肾功能正常与肾功能不全病人心血管不良和出血事件比较
根据肾功能受损的严重程度,主要心血管不良和出血事件的增加呈梯度变化,127例eGFR 30~59 mL/(min·1.73 m2)病人调整OR=1.753[95%CI(0.815,2.984)],36例严重肾功能不全[eGFR<30 mL/(min·1.73 m2)]的病人调整OR=2.695[95%CI(1.019,7.168)](见图3)。根据基线时的并发贫血和肾病类型(与糖尿病有关或与糖尿病无关)评估了有肾功能不全和无肾功能不全病人复合终点的发生率。在CRF病人中,贫血导致主要心血管不良和出血事件风险增加43%(从10.4%增加到14.9%)。无论是否伴有肾功能不全,糖尿病都会增加主要心血管不良和出血事件的发生率(无CRF为12.7%,合并CRF为13%)。最后,无论是否合并糖尿病,CRF与主要心血管不良和出血事件发生率增加相关(无糖尿病病人为12.4%,糖尿病病人为13.0%)。
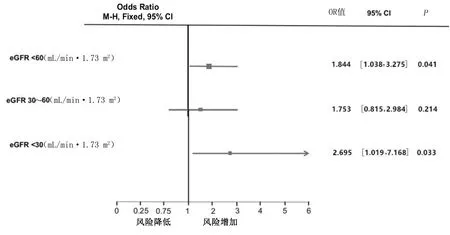
图3 不同eGFR水平病人主要心血管不良和出血事件的关系
3 讨 论
慢性肾功能不全与急性冠脉综合征后心血管事件的高风险独立相关,且其生存率较低[7]。各种因素可能解释了肾功能受损病人的不良预后:传统和非传统心血管危险因素的患病率更高;氧化应激、炎症状态升高和内皮功能障碍导致更复杂和广泛的冠状动脉疾病[8]。此外,CRF病人的促血栓状态已被证明与血小板功能障碍和促凝血活性有关,而且CRF已被证明是经皮冠状动脉介入治疗术后血小板高反应性的独立预测因子[9]。
CRF病人出血事件的风险增加,伴随着更高的死亡率风险[10]。CRF病人的这种出血倾向与内源性纤溶系统激活,血小板功能受损,半衰期延长以及随后具有肾脏清除功能的抗血栓药物积聚有关[11]。研究发现,CRF与ACS后早期出血事件的发生有独立的相关性,特别是在接受有创治疗的病人中[12],然而很少有证据表明CRF对长期出血事件的影响。本研究发现,CRF的患病率从14.6%到21.8%不等,这取决于使用的方程。然而,Cockcroft-Gault、MDRD和CKD-EPI方程组独立预测复合终点(包括心血管死亡、主要心血管缺血事件和大出血)的能力相似。本研究用主要心血管不良和出血事件发生的AUC最高的Cockcroft-Gault方程来探讨CRF对1年预后的影响。
本研究结果表明,基线CRF与1年时发生主要心血管不良和出血事件的风险增加80%相关;这与终点事件类型(STEMI与NSTE-ACS)和治疗方法(保守治疗与侵袭性)无关,重度CRF病人主要心血管不良和出血事件的发病率最高,值得注意的是,肾功能受损病人发生出血事件大于缺血性事件。这表明,即使在当前大量使用经皮血管重建术和使用更有效的抗血小板药的时代,在患有CRF的ACS病人中,缺血风险也超过了出血风险。在阿司匹林治疗的基础上,替格瑞洛与氯吡格雷治疗在肾功能衰竭各阶段的出血结果之间没有明显的治疗相互作用;因此,本研究结果说明新的、更有效的抗血小板药物也适用于中重度CRF的ACS病人。
CRF与贫血相关时,通常持续时间较长,严重程度更高,这会增加心脏事件的发生率[13]。对于CRF病人,贫血使出血风险增加,因其与血小板功能损伤有关[14]。本研究结果表明,无论血红蛋白水平如何,主要心血管不良和出血事件与CRF相关的风险都会增加,但伴随贫血的风险进一步增加了43%。这提示治疗合并贫血的策略是改善ACS病人CRF预后的必要措施。CRF和糖尿病在冠心病病人中经常共存,因其为共同的心血管危险因素,并且都具有促血栓状态和高炎症状态的特点,导致高风险动脉粥样硬化血栓形成表型,而且糖尿病是肾功能恶化的主要原因[15]。本研究为肾功能衰竭类型与预后之间的关系提供新的见解。在糖尿病相关和非糖尿病肾病病人中,主要心血管不良和出血事件的发生率相似;此外,单独考虑糖尿病和CRF与主要心血管不良和出血事件风险的相似增加相关,而当这两种情况相关时,主要心血管不良和出血事件的风险没有升高。
综上所述,本研究集中于ACS治疗的病人,包括广泛使用PCI和更有效的抗血小板药物,表明基线CRF是1年预后较差的独立预测因子;在肾功能严重下降或CRF出现时,预测作用更大与贫血有关。本研究进一步阐明了ACS病人肾功能与预后的关系,表明在这种情况下,需要仔细的风险分层,包括对肾功能和相关共病的正确评估。

