麦胚四肽的抗氧化能力研究
胡立明,张庆成,刘 岚
1.南昌双汇食品有限公司,江西 南昌 330115 2.南昌职业大学 卫生健康学院,江西 南昌 330500 3.空军勤务学院 航空军需与燃料系,江苏 徐州 221006
人体内过多的自由基会导致心血管、胃肠、内分泌、呼吸等系统出现多种疾病[1-2],消除自由基成为研究的热点。研究表明,补充外源性抗氧化剂对清除体内过多的自由基、维持细胞内氧化还原平衡有重要的意义[3-4]。相比于合成抗氧化剂,源于食物蛋白的抗氧化肽毒副作用低[5],在抗氧化功能食品的研究与开发领域具有广阔应用前景。
麦胚是小麦籽粒的生命源泉,不仅含有丰富而优质的蛋白质、脂肪、维生素、矿物质等营养素,还含有谷胱甘肽、黄酮类物质、麦胚凝集素、二十八烷醇、酶等生理活性物质,被营养学家们誉为“人类天然的营养宝库”[6]。不同于外源蛋白酶水解,本实验室采用内源蛋白酶法从麦胚中制备抗氧化肽,以比还原力为考察指标,对混合肽进行了分离纯化,筛选活性高的部分进行结构鉴定,确定其氨基酸一级结构为缬氨酸-组氨酸-组氨酸-组氨酸(Val-His-His-His,VHHH),采用固相有机合成法合成了纯度达98.2%的VHHH。尽管目前抗氧化肽的活性与结构之间的关系尚未完全明晰,但研究表明:肽的分子量大小、氨基酸组成和氨基酸序列都会影响其生物活性。首先,肽的生物活性与分子量大小有关,能在体内起功能活性作用的肽往往是分子质量在1 000 Da以下的小肽[7],而VHHH的分子质量小于1 000 Da。其次,氨基酸组成也会影响其抗氧化活性。VHHH中的缬氨酸和组氨酸常常出现在抗氧化肽中。Ko等[8]发现胰蛋白酶水解比目鱼蛋白得到的肽溶液具有很强的抗氧化活性,经过分离纯化和结构鉴定,得到了氨基酸序列为Val-Cys-Ser-Val和Cys-Ala-Ala-Pr的两条肽。Damgaard等[9]水解动物副产物得到不同大小(大多数低于3 kDa)和氨基酸组成的肽,所有的水解物在所使用的测定中都显示出抗氧化能力,其中肺水解物的抗氧化能力可能主要是由于Glu和His残基发挥了较强的铁螯合能力,胰腺水解物的抗氧化能力可能与其高含量的Phe和Val有关。Wang等[10]认为His的咪唑环能有效增强肽的自由基清除活性。Val的作用是增加抗氧化肽在脂质或脂溶性体系中的溶解性,从而有助于提高抗氧化活性[11-12]。综上,VHHH符合上述两点特征。为研究VHHH抗氧化能力,作者对其3种体外抗氧化能力和在细胞中的抗氧化活性进行了研究,为其开展体内试验以及开发应用提供理论依据。
1 材料与方法
1.1 材料与试剂
固相有机合成抗氧化肽VHHH:纯度为98.2%。人外周血:健康成年志愿者提供。
亚油酸、DPPH、还原型谷胱甘肽(GSH)、2,2′-偶氮二异丁基脒二盐酸盐(AAPH)、葡聚糖(Dextran):均为分析纯,美国Sigma公司;核黄素(VB2)、L-蛋氨酸(Met)、氮蓝四唑(NBT)、六氢吡啶、邻苯二酚、CuSO4:均为分析纯,国药集团化学试剂有限公司;H2O2:分析纯,广州科霸化工有限公司;清除羟自由基能力测试盒、超氧化物歧化酶(SOD)测试盒:南京建成生物有限公司;Tb 4101 Annexin V-FITC/PI细胞凋亡检测试剂盒:上海通善生物科技有限公司;RPMI 1640培养基、胎牛血清、胰酶:美国Gibco公司;CCK 8试剂盒:日本同仁化学研究所。
1.2 仪器与设备
FACS101流式细胞仪:美国BD公司;9602G酶标仪:北京普朗医疗器械公司;UV-2802紫外可见分光光度计:尤尼柯(上海)仪器有限公司;DP70显微镜:日本OLYMPUS公司。
1.3 方法
1.3.1 中性粒细胞分离
参照文献[13]并适当调整。取外周静脉血5 mL,加入 6%葡聚糖混匀,室温放置 30 min;上层为白细胞混合层,下层为红细胞层。取一新管加入淋巴细胞分离液,缓慢加入富含白细胞的上层混合液(与淋巴细胞分离液的体积比为1∶ 1),1 500 r/min 离心 20 min,取中间层;加入冰冷双重水,迅速裂解其中的少量红细胞,按质量比3∶ 1加入KCl溶液并混匀,1 300 r/min 离心 6 min,离心后去上清液,底层即为中性粒细胞,加入 1 mL pH 7.0 PBS液制成细胞悬液。
1.3.2 VHHH抗氧化细胞试验
取6孔板,分3组进行试验[13]:各组加入2 mL含10%胎牛血清的RPMI 1640培养基,置于37 ℃、5%CO2及饱和湿度的培养箱中培养中性粒细胞(细胞密度为1×105个/mL)12 h,换1 mL新鲜含血清的培养基。第1组加入2 μL H2O2;第2组在加入2 μL H2O2的同时分别加入合成肽VHHH 250、500、1 000、2 000 μg;第3组设为对照,不添加任何试剂。所有细胞加试剂培养2 h后测凋亡率。按同样处理方法在96孔板分组培养细胞,2 h后测细胞增殖率和细胞SOD活性。
1.3.3 羟基自由基清除能力的测定
羟基自由基清除力测定参照张雪娇等[14]的方法,计算清除率。

式中:A对为对照管吸光度;A样为样品管吸光度;A标为标准管吸光度;A0为空白管吸光度。
1.3.4 超氧阴离子清除能力的测定
超氧阴离子清除能力采用NBT光化还原法,操作步骤参照Girgih等[15]的方法,并适当调整。测定时依次加入2.5 mL 50 mmol/L pH 7.8 PBS缓冲液、2 mL 195 mmol/L Met、0.1 mL 3 μmol/L EDTA、0.1 mL不同浓度的还原剂、0.2 mL 1.125 mmol/L NBT和0.1 mL 60 μmol/L核黄素溶液,混合均匀,于25 ℃ 4 000 Lux光照10 min,立即避光,在560 nm下迅速测定吸光度。以无光照的混合液吸光度为对照(记为A0),不加还原剂的反应管作为最大光化还原管(记为Aj),样品溶液的吸光度记为A1。超氧阴离子清除能力以抑制率表示。
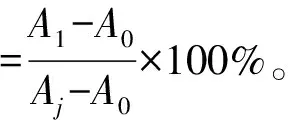
1.3.5 DPPH自由基清除能力的测定
参照Lu等[16]的方法并稍加调整。分别取2 mL 0.20、0.40、0.60、0.80、1.00 mg/mL的VHHH溶液与2 mL 0.2 mmol/L DPPH溶液混合加入具塞试管中,迅速振摇并在室温下避光静置60 min,以无水乙醇作为参比,在517 nm处比色,测定吸光度(A1),同时测定2 mL无水乙醇与2 mL DPPH溶液混合液的吸光度(A2),2 mL样品溶液与2 mL无水乙醇的吸光度(A0),计算自由基抑制率。

1.3.6 铜离子螯合力的测定
参考文献[17]的方法并适当调整。取1 mL 2 mmol/L CuSO4、1 mL六氢吡啶(pH 7.0)和20 μL 0.1%邻苯二酚充分混合,然后加入1 mL不同浓度的样品溶液后,混匀,反应5 min,在632 nm波长下测定吸光度。以水代替样品溶液作为空白样,计算Cu2+螯合力。
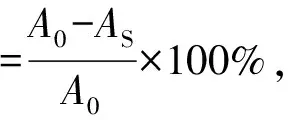
式中:A0为空白样品吸光度;AS为样品吸光度。
1.3.7 凋亡率的测定
参考文献[18]的方法并稍加修改。将孔内培养液弃除,加入0.3%胰酶消化6 min,收集消化液,1 500 r/min离心5 min,去除上清液。分别向每管中加入100 μL凋亡测试缓冲液、5 μL PI和5 μL Annexin-V,室温酶解10 min,上流式细胞仪检测凋亡率,流速100个/s。
1.3.8 细胞增殖率的测定
参考文献[18],取1.3.2在96孔板内培养的细胞,向各孔分别加入10 μL KIT-8,2 h后在酶标仪上检测450 nm处的吸光度。
1.3.9 SOD活性的测定
参照试剂盒说明书,去除各孔内的培养液,并用0.1 mmol/L pH 7.2 PBS缓冲液清洗3遍,加入细胞裂解液,在冰上裂解30 min,收集裂解后的细胞液,12 000 r/min离心15 min,吸取上清液60 μL,每孔分别加入20 μL SOD活性检测试剂以及底物工作液,37 ℃孵育30 min,用酶标仪检测450 nm处的吸光度。
1.4 数据处理
所有的试验均做3次重复,结果以平均值±标准差表示,用SPSS 12.0进行显著性分析。
2 结果与分析
2.1 羟基自由基清除能力
羟基自由基是最活泼的一类自由基,能够与蛋白质、核酸、脂质等发生反应,使以上物质过氧化和DNA突变,从而导致细胞氧化损伤[19]。由图1可知,随着质量浓度的增加,清除能力也相应增加,但增幅趋缓。从同一质量浓度下的清除效果看,VHHH清除效果高于GSH。在质量浓度为0.20 mg/mL时,VHHH清除率为57.84%±0.14%,而GSH仅为17.96%±0.91%。

图1 VHHH和GSH的羟基自由基清除能力Fig.1 Hydroxyl radical scavenging of VHHH and GSH
2.2 超氧阴离子清除能力

图2 VHHH和GSH的超氧阴离子清除能力Fig.2 Superoxide radical scavenging of VHHH and GSH
超氧阴离子自由基能够生成羟基自由基等活泼的自由基[20]。由图2可知,随着质量浓度增加,VHHH和GSH的清除率均增强,VHHH在质量浓度高于0.20 mg/mL后清除率增幅趋缓。从相同质量浓度的清除效果来看,在质量浓度低于0.80 mg/mL时,VHHH清除率高于GSH,表明VHHH在低浓度时有较强的超氧阴离子清除能力。
2.3 DPPH自由基清除能力
DPPH是一种稳定的以氮为中心的合成自由基,常常用于物质抗氧化能力的体外测定。由图3可知,随着质量浓度增加,二者的清除率都提高。当质量浓度大于0.60 mg/mL时,二者清除率变化不大。当质量浓度为0.80 mg/mL和1.00 mg/mL时,GSH清除率分别为64.14%±1.95%、64.35%±0.51%。在同一质量浓度时,GSH清除率明显高于VHHH清除率。
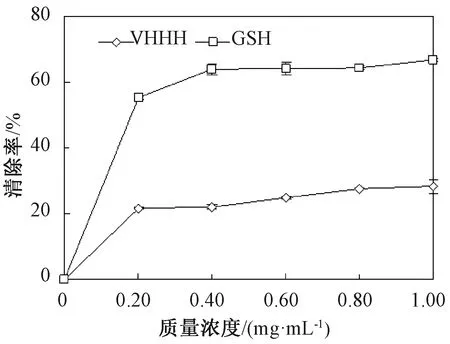
图3 VHHH和GSH的DPPH自由基清除能力Fig.3 DPPH radical scavenging of VHHH and GSH
2.4 铜离子螯合力
铜离子、铁离子等金属离子是非常强的自由基发生剂,在油脂的自氧化过程中,微量的金属离子可使油脂氧化的诱导速率提高1036倍,金属离子的存在使得捕捉自由基的抗氧化剂很快被消耗[21]。因此对金属离子的螯合有利于抗氧化作用。由图4可知,VHHH和GSH的螯合力都随着质量浓度增加而增加,在质量浓度小于0.60 mg/mL时,螯合力相差较大,当质量浓度大于0.60 mg/mL时,差距逐渐缩小。

图4 VHHH和GSH的铜离子螯合能力Fig.4 Copper chelateing ability of VHHH and GSH
2.5 VHHH和GSH的IC50的比较
由表1可知,在清除生物体内自由基方面,VHHH的清除能力强于GSH(清除羟基自由基IC50分别为0.39 mg/mL和0.64 mg/mL,清除超氧阴离子IC50分别为0.73 mg/mL和0.81 mg/mL),而在清除人工合成的DPPH自由基方面,VHHH清除能力低于GSH(分别为1.78 mg/mL和0.57 mg/mL)。从铜离子螯合能力来看,VHHH低于GSH(分别为0.64 mg/mL和0.37 mg/mL)。

表1 VHHH和GSH的抗氧化能力比较Table 1 Comparison of antioxidant activity of VHHH and GSH
2.6 VHHH对细胞抗氧化的影响


注:Q1区域为坏死细胞;Q2区域为晚期凋亡细胞;Q3区域为早期凋亡细胞;Q4区域为活细胞;细胞凋亡率为Q2和Q3象限百分率之和。图5 VHHH对氧化胁迫下中性粒细胞凋亡率的影响Fig.5 Effect of VHHH on the survival rate of polymorphonuclear neutrophil under oxidative stress

图6 VHHH对氧化胁迫下中性粒细胞增殖率的影响Fig.6 Effect of VHHH on the proliferation rate of polymorphonuclear neutrophil under oxidative stress

图7 VHHH对氧化胁迫下SOD活性的影响Fig.7 Effect of VHHH on SOD activity of polymorphonuclear neutrophil under oxidative stress

图8 KIT-8吸光度与SOD活性之间的关系Fig.8 Relationship between absorbance of KIT-8 and SOD activity
3 讨论与小结
H2O2是一种常见的氧自由基产生物,在机体中容易分解产生羟自由基或氧自由基导致细胞过氧化损伤。当机体受到氧化应激时,抗氧化剂可以延缓细胞损伤程度。有学者从海参、安康鱼肌肉中提取的多肽被发现能有效清除自由基和超氧阴离子,对 H2O2诱导损伤的 RAW 264.7 细胞具有显著的保护作用[23-24]。本研究表明VHHH可通过提高SOD活性抗H2O2致细胞氧化作用。Himaya等[25]发现一种来自鱼皮的抗氧化六肽GGFDMG和十肽LLMLDNDLPP具有清除细胞内活性氧活性的同时,能够上调抗氧化酶SOD的表达水平,帮助细胞抵抗H2O2诱导的氧化应激,结果与本研究类似。郭勇等[26]发现长白山核桃源五肽Leu-Pro-Leu-Leu-Arg(LPLLR)能通过提高SOD酶的活性等方式对H2O2诱导氧化损伤的PC12细胞起一定保护作用。在机体中SOD存在3种形式:SOD1存在于细胞质中,SOD2存在于线粒体中,SOD3存在于细胞外[27]。但VHHH如何诱导SOD蛋白表达还需要深入研究。
VHHH具有较强的体外和细胞内抗氧化活性。由于体外抗氧化测定方法及细胞试验无法考虑在体内的吸收、代谢和药效等因素,导致体外和体内抗氧化活性之间存在差异,因此还需通过体内试验研究VHHH抗氧化能力,为其开发和应用奠定理论基础。

