降胆固醇功能性食品的研究进展
郭子楠,潘京金,贺明君,黎铭轩,陈 丽,吴俊迪,王威艳,胡泓臣,沈菲凡,朱寒月,*
(1.华南食品安全研究发展中心,佛山科学技术学院食品科学与工程学院,广东 佛山 528231;2.香港中文大学生命科学学院,香港 999077)
高胆固醇血症是指血液中总胆固醇(total cholesterol,TC)、非高密度脂蛋白胆固醇(non-high density lipoprotein cholesterol,non-HDLC)及低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDLC)水平过高的情形。大量的流行病学调查和临床研究表明,血液中TC[1]、LDLC[2]及non-HDLC[3]水平过高会导致动脉粥样硬化,进而诱发缺血性心血管疾病。临床上以TC和LDLC水平为判断标准,当TC水平高于220 mg/dL时可诊断为高胆固醇血症,当LDLC水平高于130 mg/dL时建议进行药物干预。目前,高胆固醇血症患者主要通过药物进行治疗,临床上常用的降胆固醇药物有他汀类、消胆胺和依泽替米贝。上述药物治疗虽然能有效降低血液胆固醇水平并控制高脂血症进一步发展,但长期服用会导致严重的副作用,例如肌痛、肌溶解、肌炎、骨质疏松、便秘、抑郁症等[4]。
降胆固醇功能性食品不仅具有调节血脂的功效,并且长期食用安全稳定,因此备受关注。大量研究表明,通过日常补充降胆固醇功能性食品(如膳食纤维、植物固醇、鱼油等)可有效防治高胆固醇血症、动脉粥样硬化及降低心血管疾病的发生[5]。这些功能性食品及有效成分主要通过调节胆固醇的合成、吸收、外排、代谢等过程来达到降低血液胆固醇的目的,本文将从降胆固醇功能性食品的降胆固醇机制入手展开介绍。
1 胆固醇
1.1 胆固醇的合成
内源性胆固醇是胆固醇的主要来源,每天约有800~900 mg的胆固醇在体内合成[6]。肝脏细胞是胆固醇合成的主要场所,多种酶参与此合成过程[7](图1)。首先,两分子乙酰辅酶A合成乙酰乙酰辅酶A,并在羟甲基戊二酰辅酶A(3-hydroxy-3-methyl glutaryl coenzyme A,HMG-CoA)合成酶的催化下结合一分子的乙酰辅酶A生成HMG-CoA;然后在HMG-CoA还原酶的作用下,HMG-CoA被还原成甲羟戊酸;此后,甲羟戊酸经过一系列酶的作用生成中间产物角鲨烯,最终生成胆固醇。HMG-CoA生成甲羟戊酸的反应过程是众多研究者关注的重点,因为HMG-CoA还原酶是整个胆固醇合成反应的限速酶,对调控胆固醇的合成发挥着重要作用。他汀类药物就是以HMG-CoA还原酶为作用靶点调节胆固醇含量,从而治疗高胆固醇血症[8]。

图1 胆固醇的合成过程Fig.1 Pathway of cholesterol synthesis
机体胆固醇的合成还受到固醇调节元件结合蛋白(sterol regulatory binding protein,SREBP)的调控。非活化状态的SREBP位于内质网上,是调节机体胆固醇平衡的关键因素之一。在胆固醇含量低于机体所需状态下,SREBP转移至高尔基体上,活化成为SREBP2,随后进入细胞核与固醇反应元件结合,促进相关胆固醇合成基因的表达[9],包括HMG-CoA还原酶,促进肝脏合成胆固醇;低密度脂蛋白受体(low density lipoprotein receptor,LDLR)通过细胞内吞方式促进肝细胞对胆固醇的摄取。此外,SREBP2也可以促进HMG-CoA合成酶、脂肪酸合成酶等基因的表达(图2)。因此,SREBP是治疗高胆固醇血症的另外一个潜在靶点,一些活性物质就是通过作用于SREBP,使其失活来降低机体胆固醇的合成。
1.2 胆固醇的吸收
食源性胆固醇是体内胆固醇的另一个重要来源,每天约300 mg的食源性胆固醇经小肠吸收进入体内。尼曼匹克C1样蛋白(Niemann-pick C1-like 1,NPC1L1)是肠道胆固醇吸收的关键蛋白。肠道中的食源性胆固醇在NPC1L1的调控下进入上皮细胞,其中一部分食源性胆固醇在酰基辅酶α-胆固醇酰基转移酶2(acyl coenzymeα-cholesterol acyltransferase 2,ACAT2)的调控下转化为胆固醇酯,并被微粒体甘油三酯转移蛋白(microsomal triglyceride transfer protein,MTP)转移至乳糜微粒;另外一部分食源性胆固醇在ATP结合转运蛋白5/8(ATP-binding cassette sub-family G member 5/8,ABCG5/8)协助下再次进入小肠。乳糜微粒最终经由淋巴系统进入血液循环[10](图2)。故通过抑制肠道中胆固醇的吸收,可在一定程度上达到降低血液胆固醇的目的。
1.3 中性固醇和胆汁酸的外排
胆固醇的外排包括胆固醇逆向转运和肠内胆固醇排泄[11]。胆固醇逆向转运主要负责清除肝外组织的胆固醇。肝外胆固醇以高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDLC)的形式转运回至肝脏,最后以胆汁酸的形式排出体外[12]。而肠内胆固醇排泄则是中性固醇的主要排泄方式。食物以及肝脏中的胆固醇进入肠道被肠道上皮细胞的NPC1L1受体所摄取[13],同时细胞上ATP结合盒式蛋白超家族成员ABCG5和ABCG8将肠上皮细胞中的胆固醇泵入到肠道中[14]。肠道中的真菌、双歧杆菌、乳酸菌以及消化链球菌在胆固醇的排泄过程中扮演着重要角色[15]。在上述细菌参与下,胆固醇转化成为粪甾醇,最终随粪便排出(图2)。
肝脏中的胆固醇是机体合成胆汁酸的重要原料[16]。肝细胞以胆固醇为原料,在胆固醇羟化酶(cholesterol-7α-hydroxylase,CYP7A1)作用下合成初级胆汁酸,即胆酸和鹅脱氧胆酸。进食后,初级胆汁酸随胆汁进入十二指肠,乳化脂质促进其消化以及脂溶性维生素的吸收。在回肠、结肠上段初级胆汁酸经肠道菌酶7α-脱羟基酶催化作用[17],通过去结合反应脱去羟基转化成次级胆汁酸,包括石胆酸和脱氧胆酸。初级、次级胆汁酸与甘氨酸、牛黄氨酸结合生成相应结合胆汁酸。肠道中微生物如拟杆菌、梭菌、乳酸菌、埃希氏菌等[18],除促进生成次级胆汁酸,还能通过去结合作用将结合胆汁酸转变为游离胆汁酸(图2)。

图2 胆固醇吸收[20]、合成和外排[21]Fig.2 Cholesterol absorption[20], synthesis and excretion[21]
大部分胆汁酸(>95%)经肠肝循环重吸收回到肝脏,剩余部分(0.4~0.5 g/d)则随粪便排出体外。这一过程是胆固醇逆向转运的最后一步,利于降低机体胆固醇含量[19]。
2 胆固醇调节机制
2.1 NPC1L1拮抗剂
NPC1L1蛋白是胆固醇进入小肠细胞所需的特定转运蛋白。NPC1L1基因位于人体染色体7p13上[22],负责编码NPC1L1蛋白。该蛋白的表达主要发生在胃肠道上皮细胞和肝细胞,尤其是肠上皮细胞刷状缘一侧[23-25]。NPC1L1蛋白N-末端结构域与脂阀结构蛋白flotillin结合,形成NPC1L1-flotillin复合体,参与食源性胆固醇的吸收过程[26]。所以,在NPC1L1蛋白高表达区段(如十二指肠、结肠等解剖区)常常伴随着胆固醇的高吸收作用[27]。通过抑制NPC1L1蛋白作用可以有效地降低胆固醇的吸收,进而达到降低血液胆固醇的目的。降脂药之一依泽替米贝就是以NPC1L1蛋白为作用靶点,与NPC1L1蛋白结合抑制NPC1L1的内吞作用,从而抑制胆固醇的吸收[28]。另外一种药物奥利司他是一种减肥药,本质上亦扮演脂肪酶抑制剂的角色,实验表明奥利司他可在一定程度上能够抑制NPC1L1蛋白的功能,从而减少胆固醇的吸收,但其与NPC1L1结合的能力远低于依泽替米贝[29]。
2.2 HMG-CoA还原酶抑制剂
HMG-CoA还原酶是胆固醇合成过程中的限速酶,通过N-末端结构域锚定在内质网膜上[30],而其C-末端结构域是主要发挥催化作用的位置[31]。在胆固醇合成过程中,HMG-CoA还原酶负责将HMG-CoA转换为甲羟戊酸,合成固醇和非固醇类化合物物质[32]。当HMG-CoA向甲羟戊酸的转换过程被抑制剂阻断时,HMG-CoA还原酶表达量代偿性增加,这一过程则需要甲羟戊酸代谢物固醇和非固醇类化合物参与[33]。而固醇类物质可与卵裂激活蛋白结合,抑制SREBP的活动,通过一系列相互作用,最终降低机体合成的胆固醇水平[34]。非固醇代谢产物可以通过干扰HMG-CoA还原酶的转录过程[35],同时通过加速泛化促进HMG-CoA还原酶的降解,从而达到降低胆固醇合成的目的。他汀类药物是临床上治疗高血脂症的常用药物,它的主要作用靶点为HMG-CoA还原酶。他汀类药物对HMG-CoA还原酶结构中的催化部位具有强大的亲和能力,因此可与HMG-CoA还原酶紧密结合,影响HMG-CoA还原酶发挥作用,从而抑制内源性胆固醇的生成,以达到降低血中胆固醇浓度的目的[36]。
2.3 胆汁重吸收抑制剂
胆汁是胆固醇代谢的重要产物,也是影响胆固醇平衡的关键因素之一。胆汁在肝脏中由胆固醇合成并贮存在胆囊中[37]。进食后通过胆囊的收缩作用排到肠道中,参与脂类物质吸收和代谢。这些胆汁大部分在回肠被重吸收,并通过门静脉返回肝脏,整个过程称为肠肝循环,也称肠肝环流[38]。肠肝循环对脂质代谢具有重要意义(图3)。此外,胆汁经肠肝循环回到肝脏,可抑制胆汁的再合成[39]。
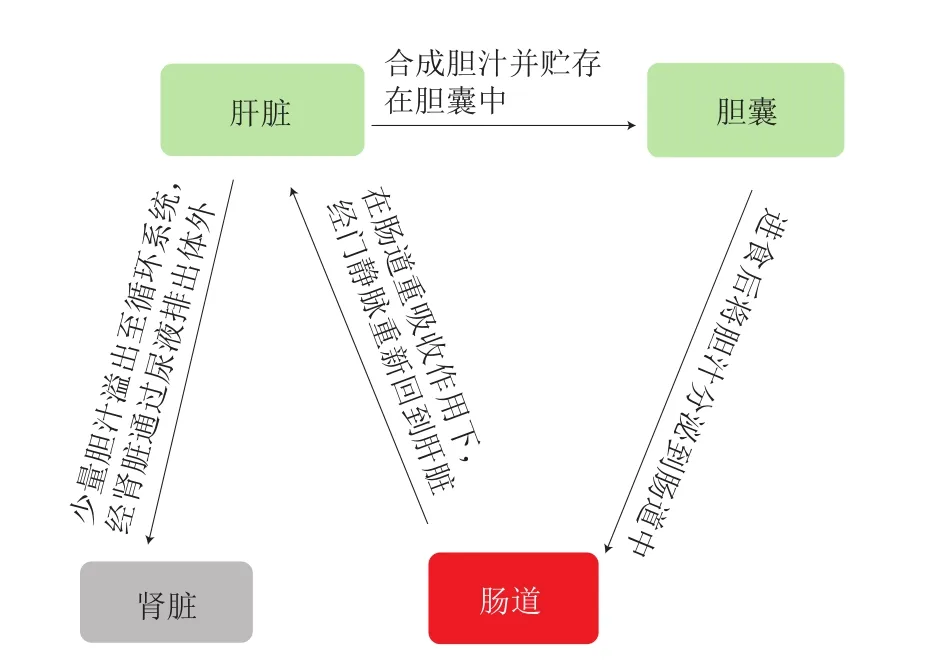
图3 胆汁的肠肝循环Fig.3 Hepatoenteral circulation of bile acids
CYP7A1是胆汁合成过程中的关键酶,对胆固醇代谢以及胆汁合成具有重大意义。研究表明,当胆汁重吸收回到肝脏后,可以通过阻断CYP7A1来负反馈调节自身胆汁酸的合成[17]。胆固醇向胆汁酸的转变减少,最终会导致胆固醇在体内的累积。因此,抑制胆汁的重吸收,降低胆汁在肝脏中的含量,促进胆固醇向胆汁的转化,是治疗高胆固醇血症的有效方法。
3 降胆固醇的功能性食品
3.1 膳食纤维
膳食纤维是植物可食用但不能被消化的部分。膳食纤维是一个庞大的家族,可简单地分为水溶性和非水溶性两种类型。膳食纤维的历史可以追溯到几个世纪前,因其在改善肠道功能,降低血液胆固醇和改善血糖反应等方面上发挥的重要作用[40]而广受欢迎,是一类非常重要的健康食品。谷物、豆类、坚果、水果和蔬菜是典型的富含膳食纤维的食物(表1)。富含膳食纤维的饮食被视为健康的饮食,食用膳食纤维对促进肠道排便、增加营养物质的吸收、降低心血管类疾病的发病率等具有积极作用[41]。

表1 不同食物的膳食纤维含量Table 1 Contents of dietary fiber in different foods
与非水溶性膳食纤维相比,水溶性膳食纤维在降低胆固醇的吸收、合成,促进胆固醇的代谢等效果上具有明显优势。β-葡聚糖就是一种典型的水溶性膳食纤维,它与肠道内容物形成凝胶从而促进肠道的排泄功能,降低胆固醇和甘油三酯吸收,降低血清TC含量[42]。
膳食纤维在肠道中的发酵产物可通过多种途径降低胆固醇水平,包括抑制HMG-CoA还原酶活性,促进胆汁酸的排泄等。短链脂肪酸如丙酸和丁酸,是膳食纤维在肠道菌群作用下的发酵产物,可由肠道黏膜吸收进入血液,这些短链脂肪酸可直接影响胆固醇代谢。例如,丙酸盐可以通过与胆固醇合成原料相互作用来抑制胆固醇的合成[43],还可以通过抑制HMG-CoA还原酶的功能来降低血液胆固醇水平[44]。一些纤维素像车前草或柑橘果胶,在肠道菌群作用下易于发酵,更容易与胆汁酸结合,使胆汁酸易于排泄,从而降低胆汁酸肠肝循环水平,而胆汁酸循环利用的降低可促进肝脏胆固醇向胆汁酸转化[45]。
3.2 植物固醇
植物固醇与胆固醇的化学结构相似,也被叫作植物中的胆固醇(图4)。植物固醇主要包含植物甾醇和植物甾烷醇,区别在于植物甾醇在其碳环结构中包含一个双键结构,而在植物甾烷醇中是饱和状态[46]。植物中含量比较高的植物固醇有β-谷固醇、麦角固醇、菜籽甾烷醇和菜籽固醇等。植物甾醇在预防高脂血症上具有很好的效果,有报道称坚持每日摄入2 g植物固醇可以降低8%~10% LDLC水平[47]。

图4 胆固醇与植物甾醇Fig.4 Cholesterol and phytosterols
由于脂类物质的高度疏水性,胆固醇或其他脂质如脂肪酸、磷脂和甘油等需要与胆汁结合形成微粒,再由小肠刷状缘一侧黏膜吸收[48]。由于植物固醇的疏水性较胆固醇更强,它与胆固醇竞争结合胆汁形成微粒,以此减少饮食中胆固醇的吸收。研究表明,植物甾烷醇对于抑制胆固醇的吸收较植物甾醇效果更明显[49]。此外,一些研究报道称,β-谷固醇可以通过与胆固醇的结晶作用来阻断胆固醇的吸收,从而降低血液中胆固醇的含量[50]。研究还发现,植物固醇可以通过抑制NPC1L1蛋白的表达来阻断胆固醇进入细胞,同时通过促进ATP-结合盒转运蛋白转录来促进肠上皮细胞外排胆固醇,进而减少胆固醇的吸收。此外,植物固醇还可以通过抑制胆固醇酯化作用、促进胆固醇的肠道排泄来降低血液胆固醇的水平[51]。
大量证据表明,植物固醇的摄入和动脉粥样硬化之间具有紧密联系。持续6 个月每天服用3 g植物固醇,对改善血管内皮功能、增加动脉血管柔软度等具有重要作用。此外,对于降低non-HDLC浓度也有一定效果[52]。Maki等[53]进行的另一项研究表明,每天摄入1.8 g植物固醇的受试者,LDLC水平比之前下降了9.2%。研究表明,高胆固醇患者补充植物固醇后,LDLC水平较补充前降低了约15%[54]。然而,也有部分受试者在服用植物固醇后表现出胆固醇水平升高的现象[55]。但尽管如此,植物固醇对于降低机体胆固醇的水平、预防心血管疾病发生的作用仍不能被忽视。
3.3 n-3不饱和脂肪酸
众所周知,爱斯基摩人很少受到心血管疾病的威胁,其主要原因是爱斯基摩人鱼类摄入量远多于其他人群。鱼肉中富含n-3不饱和脂肪酸,有研究证实n-3不饱和脂肪酸对降低心血管疾病的发病率和死亡率具有重要作用[56]。有报道称4 g/d的n-3不饱和脂肪酸的补充可使甘油三酯降低25%~30%[57]。目前二十碳五烯酸(eicosapentraenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)的补充已经作为高脂血症的治疗方法之一[1]。亚麻酸是n-3不饱和脂肪酸的植物来源,但研究指出亚麻酸在体内只有很少一部分转化为EPA或DHA,因此对预防心血管疾病的影响较小[58]。
n-3不饱和脂肪酸参与体内多种调控胆固醇水平的过程,包括下调甘油三酯含量、改善血管内皮功能、抗血栓形成以及稳定斑块防止斑块脱落等,来预防心血管疾病的发生并降低心血管疾病的死亡率[58]。
n-3不饱和脂肪酸通过多种途径调节甘油三酯的代谢。首先,通过抑制SREBP的生物活性导致脂合成酶水平降低[59]。其次,由于β氧化反应的增强,甘油三酯和LDL的合成材料减少,导致脂类物质合成量降低。最后在n-3不饱和脂肪酸存在的情况下,脂蛋白脂肪酶可以清除乳糜微粒和LDL中的甘油三酯[12,60](图5)。

图5 n-3不饱和脂肪酸对脂代谢的影响Fig.5 Effect of n-3 polyunsaturated fatty acids on lipid metabolism
有证据表明,通过补充鱼油可以降低含氧自由基含量[61],因此一氧化二氮对内皮细胞的保护作用增加,血管扩张的功能大大提高[62]。血栓素A2(thromboxane A2,TXA2)是一种前列腺素,负责调控血管的收缩和血小板聚集。据报道,n-3不饱和脂肪酸通过阻断TXA 2合成来延长血小板凝固时间并抑制血栓形成[63]。虽然EPA和DHA都属于n-3不饱和脂肪酸,但它们在调节血浆含量方面起着不同的作用。除了增加HDL含量外,DHA还略有增加LDL浓度,而EPA对LDL没有影响[64]。
鱼油是典型的n-3不饱和脂肪酸来源,被视为降低血脂浓度的功能性食物。研究表明,补充鱼油的受试者甘油三酯浓度平均减少0.34 mmol/L,但对TC没有影响[65]。磷虾是另一种富含EPA和DHA的海鲜类食物,可以抑制大鼠的脂质氧化和脂质生成[66]。有报道称,受试者连续6 周每日摄取2 g磷虾,空腹甘油三酯水平可降低至19.9 mg/dL[67]。
3.4 红曲米
红曲米是红曲霉菌的发酵产物,以其降血脂特性而广为人知[68]。据报道,红曲米对降低TC、LDLC和甘油三酯都具有积极的作用。Gerards等[69]进行的随机对照临床实验表明,LDLC和甘油三酯的平均降幅分别为1.02 mmol/L和0.26 mmol/L。莫纳可林是红曲米调节胆固醇水平的主要有效成分[70],其相对含量约为0.4%,莫纳可林K是莫纳可林亚分类中的一种,与洛伐他汀结构相类似。研究发现,莫纳可林通过抑制HMG-CoA还原酶的生物活性来减少内源性胆固醇的合成,与他汀类药物在降低胆固醇水平方面的机制类似[71]。
Lin等[72]在2001年进行的临床研究结果显示,食用红曲米(含有他汀类物质13.9 mg/1 200 mg)4 周,LDLC、TC和甘油三酯含量分别减少30.6%、20.7%和13.4%,这种趋势一直持续到第8周。此外,红曲米还同时降低脂蛋白B水平26.0%。与另一项用80 mg洛伐他汀治疗的受试者相比,LDLC浓度降低26%,两组实验间的差异表明,红曲米中的其他成分,例如植物酯醇,在降低胆固醇水平方面也起着至关重要的作用[73]。更进一步,血流量的变化也指出红曲米的摄入对改善血管内皮功能也具有重要意义[74]。
值得注意的是,与他汀类药物相比,食用红曲米并不会引起任何副作用。Becker等[75]进行的研究证实,服用红曲米除了引起TC和LDLC的平均水平下降外,在受试者中并没有引起任何不良反应。这一结论在其他临床实验中也得到证实,食物中增加红曲米的摄入并未引起患者不适症状[76]。综上,不同研究都给他汀类药物不耐症患者带来新的治疗方案,它更有效并且副作用更少。
3.5 其他降胆固醇的功能性食品
除上述功能性食品及成分外,茶叶[77]、大蒜[78]、益生元[79]等多种物质对于调节脂质代谢、抑制胆固醇的合成等也具有积极作用。茶叶中富含茶多酚[80],而茶多酚是一种重要的抗氧化物质[81],因此对于保护脂质不被氧化、延缓动脉粥样硬化进展有积极作用。大蒜可以抑制胆固醇在肝脏中的合成过程[82]、抑制肠道吸收外源性胆固醇[83],以此来降低体内胆固醇含量。益生元在人体肠道中具有胆汁酸盐水解酶的作用,将胆汁酸盐转化为非结合态胆汁,减少胆汁酸的肝肠循环[84]。因此促进胆固醇转化为胆汁,降低胆固醇含量。
目前,国内对降胆固醇功能性食品的研究也取得较大进展。柑橘是生活常见的水果之一,除膳食纤维外还富含多甲氧基黄酮。实验表明,用含多甲氧基黄酮食物喂养高胆固醇血症小鼠6 周后,小鼠血液中甘油三酯和LDLC含量明显下降[85]。此外,膳食纤维[86]、植物固醇[87-88]等也逐渐成为当下的研究热点,相关研究表明这些食物在预防心血管疾病、调节血脂方面的积极作用。
4 结 语
随着研究的不断深入,越来越多的降胆固醇功能性食品被开发,越来越多的活性成分被鉴定,同时它们的降胆固醇机制也不断被揭晓,为心血管疾病的防治提供了重要的理论依据。在未来的研究中,研究者们除了应深度挖掘具有降胆固醇效果的功能性食品及成分,还可以从营养组学、代谢组学及肠道菌群学入手,深度剖析它们在人体中的降胆固醇过程及相关机理。同时,还应加强对这些功能性食品的研发及活性成分的鉴定,让更多的人认可并接受功能食品,从而减少高胆固醇血症的发生,提高国民的整体健康水平,达到全民健康的大目标。

