天然多糖微凝胶的制备与应用研究进展
陈芳芳,胡 猛,张 超,吴悦寒,徐龙泉,高志明,*,方亚鹏,3
(1.湖北工业大学生物工程与食品学院,菲利普斯亲水胶体研究中心,湖北 武汉 430068;2.贵州中烟工业有限责任公司技术中心,贵州 贵阳 550009;3.上海交通大学农业与生物学院,上海 200240)
微凝胶是一种质地柔软、粒径较小(0.1~100 μm)的交联聚合物颗粒,兼具高分子与胶体性质,越来越多地被应用于各种行业。其不仅具有流变学控制、荷载物质和定向输送等特性,还可以通过改变其功能而应用于食品、个人护理品以及化妆品中[1]。图1所示为Web of Science网站统计的1996—2019年关于微凝胶研究发表的文献数量和被引次数随着年份的变化,从2010年开始,发表文献数量和被引次数呈爆发式增长。2019年,该领域发表文献数量达到356 篇,被引次数超过11 000 次。由此可见,微凝胶的研究和应用正受到越来越多的关注。微凝胶的组成成分对其功能物化性质和功能特性有重要影响。用于制造食品级微凝胶最常见的材料是蛋白质和多糖。不同类型的生物聚合物分子在其物理化学性质上,例如在构象、极性、溶解度、黏度、凝胶机理和表面活性等方面有很大的差异[2]。天然多糖基微凝胶由于具有安全无毒、生物相容性好、易于降解等特点被广泛应用于医药、食品等领域。本文主要对食品级天然多糖微凝胶的最新研究进展进行综述,旨在探讨其在食品领域中的潜在应用价值及未来研究热点。

图1 微凝胶相关研究所发表的文献数量和文献被引次数随年份的变化趋势Fig.1 Yearly trends in the number and citation frequency of published research papers on microgels
1 典型天然多糖及其凝胶行为
天然多糖是一种被广泛开发的生物聚合物,由葡萄糖、半乳糖、甘露糖等常见单体组成。与合成聚合物相比,它具有无毒、可降解等很多优良的性能,可以被广泛应用于细胞和药物递送。天然多糖可通过氢键、共价键、范德华力等相互作用,与溶剂水分子缔合形成三维网络结构,这些结构被称为水凝胶[3]。胶凝时,分子链段间可形成螺条型、蛋盒型、双螺旋型等多种结构。多糖的分子结构和凝胶机理决定了其微凝胶的制备方法。以下简要介绍几种典型天然多糖及其凝胶行为。
1.1 琼脂
琼脂主要是由琼脂糖和琼脂胶两部分组成(图2),其中琼脂糖是形成凝胶的组分。琼脂中含有的琼脂糖越多,其凝胶强度越高。琼脂不溶于冷水,能溶于90 ℃以上的热水,加热溶解后冷却至30 ℃时,则能形成结实而有弹性的凝胶。这种凝胶在加热不超过85 ℃时仍然保持凝胶化状态。当加热到85 ℃以上时才能熔化而重新成为溶胶状态。琼脂凝胶是通过冷凝机制形成的,其凝胶过程主要是由两个聚合物链形成的双螺旋所驱动,随后螺旋进一步聚集形成凝胶[4]。与其他能形成凝胶的多糖相比,在相同浓度下琼脂的凝胶能力相对较强。
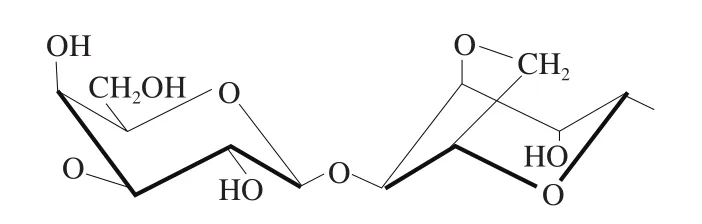
图2 琼脂的分子结构[4]Fig.2 Molecular structure of agar[4]
1.2 海藻酸盐
海藻酸盐是一种来源广泛、无毒害、可降解,且生物相容性好的天然多糖。其由β-D-甘露糖醛酸(β-D-mannuronic,M)和α-L-古洛糖醛酸(α-L-guluronic,G)交替连接构成。海藻酸盐与离子的络合性质是其形成离子凝胶的基础。海藻酸盐易与一些金属阳离子发生交联而形成水凝胶,其中对Ca2+尤为敏感[5]。在凝胶过程中由于G片段和M片段结构上的差异,各片段所发挥的作用也不同。两个G片段经过聚合作用与1 个Ca2+结合形成了空间亲水结构,这样的结构能使海藻酸链段间结合得更加紧密,从而形成水凝胶[6]。一般来讲,随着G片段含量的增加,海藻酸钠与多价阳离子结合的特异性也会增加。而M片段、G-M单元交替的片段则没有特异性。海藻酸钠与多价阳离子络合的特异性表明两者之间不仅存在静电相互作用,还存在因G单元的结构特性引起的螯合作用,这种结构被称为“蛋盒”模型(图3)。海藻酸钠与阳离子之间的作用与很多因素有关,如阳离子的种类、离子浓度、海藻酸钠的性质等,不同阳离子与海藻酸钠结合的嵌段不同[7]。

图3 蛋盒模型的结构示意图[8]Fig.3 Schematic diagram of the egg-box model[8]
1.3 壳聚糖
壳聚糖又名几丁质、甲壳素,是自然界中唯一含有氨基的阳离子碱性多糖。壳聚糖含有大量的氨基和羟基,易形成分子内和分子间氢键[9]。壳聚糖分子可以通过化学交联或物理交联的方式形成凝胶。例如,壳聚糖可以通过与儿茶酚、京尼平等混合而形成化学交联凝胶[10],也可通过向壳聚糖溶液中添加NaHCO3、三聚磷酸盐等形成物理交联凝胶[11-12]。此外,壳聚糖还可以通过与其他高分子混合形成网络结构,混合高分子网络结构不仅可以增强壳聚糖分子在酸性溶液中的稳定性,还可使壳聚糖凝胶对环境的刺激产生响应。研究发现,通过将聚乙烯醇(poly(vinyl alcohol),PVA)与壳聚糖共混,可以制备温度敏感性的水凝胶,其凝胶机理如图4所示。低温时,聚乙烯醇上的羟基与壳聚糖分子上的羟基和氨基形成氢键,同时壳聚糖分子的流动性也会降低,进一步阻碍了壳聚糖链的缔合,体系以溶液状态存在;高温则可降低壳聚糖分子间的氢键相互作用,加速壳聚糖分子的迁移率,导致聚合物周围的水分子被排出,壳聚糖分子间疏水相互作用增强而发生聚集,最终形成凝胶[13]。

图4 壳聚糖/PVA凝胶形成机理[13]Fig.4 Mechanism of chitosan gel formation[13]
1.4 结冷胶
结冷胶是由伊乐藻属鞘氨醇单胞菌产生的一种胞外阴离子多糖,具有良好的热稳定性,即使在很低的浓度下也能形成透明的凝胶[14]。其中,天然形式的结冷胶称为高酰基结冷胶(图5A)。在高温和碱性介质中,高酰基结冷胶水解可生成低酰基结冷胶(图5B)。结冷胶在高温下可完全溶解,冷却时分子之间会自动聚集形成双螺旋结构,双螺旋进一步聚集可形成三维网状结构。结冷胶的凝胶强度与浓度、离子类型、冷却速度等有一定的关系。一般来讲,离子和结冷胶的浓度越大,其凝胶强度越强。但离子类型不同或离子浓度超过一定范围后,凝胶强度又会下降。因此选择合适的离子类型和离子浓度对结冷胶凝胶的形成是很重要的。阳离子的介入不仅能促进分子内的交联作用,还能加速双螺旋形成三维网络状结构[15]。结冷胶在形成凝胶时,首先发生构象的转变,即结冷胶分子随着温度的降低由无规线团转变为双螺旋构型;接着双螺旋聚集形成缠结点,并最终形成凝胶[16]。在温度、聚合物浓度、离子类型等因素的作用下,结冷胶能与不同的物质结合形成各式各样的凝胶结构。

图5 结冷胶分子结构[17]Fig.5 Molecular structure of gellan[17]
1.5 果胶
果胶是普遍存在于各类植物细胞壁中的阴离子天然多糖。一般将酯化度高于50%的果胶称为高酯化度(high methoxy,HM)果胶,酯化度低于50%的果胶称为低酯化度(low methoxy,LM)果胶。果胶能形成具有弹性的凝胶,不同酯化度果胶形成凝胶的机制是有差别的,HM果胶要求高糖浓度(比如蔗糖相对含量大于50%)和酸性环境(pH 2.0~3.5),两个条件同时满足的情况下,通过氢键和疏水作用可以形成凝胶(图6A),该过程是不可逆的[18]。然而,由于LM果胶分子上带的COO-相对较多,分子间的排斥力较大,难以形成结合区,但可以通过静电络合作用与Ca2+等金属离子形成凝胶结构[19]。LM果胶与Ca2+形成凝胶时,其两条反向平行糖链共同连接Ca2+,可构成与海藻酸钙凝胶类似的“蛋盒”结构(图6B)。在果胶溶液中增加Ca2+的浓度,可以使凝胶强度增大,且形成的凝胶弹性较好;但Ca2+浓度过高,凝胶强度则会变弱,形成的凝胶会变脆;因此,不同质地果胶凝胶的形成对Ca2+的浓度需求范围是不同的[20]。影响果胶凝胶的因素有很多,如果胶分子质量、酯化度、离子浓度、pH值等。
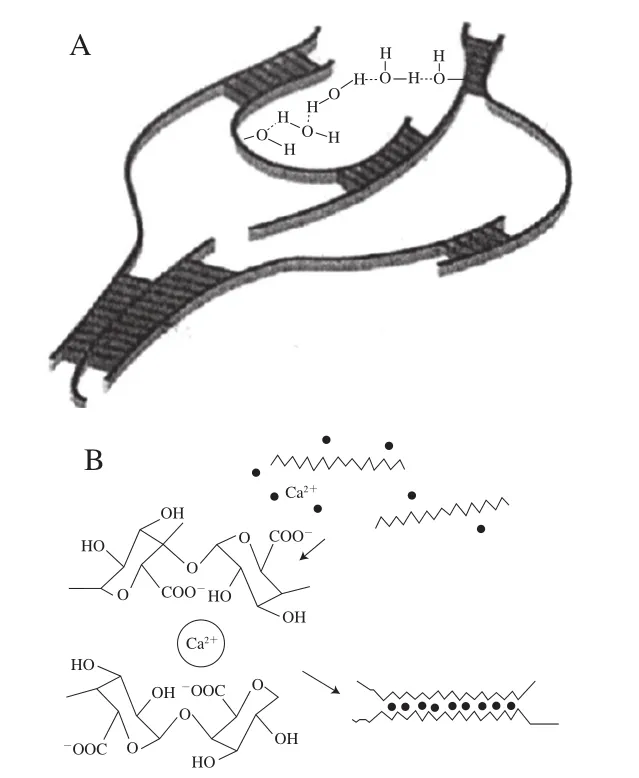
图6 果胶凝胶机理[20]Fig.6 Mechanism of pectin gel formation[20]
1.6 魔芋葡甘聚糖
魔芋葡甘聚糖(konjac glucomannan,KGM)是由葡萄糖和甘露糖组成的天然高分子多糖(图7),由于具有优良的胶凝性、乳化性、成膜性、持水性等特点而被广泛应用于食品、医药、纺织等领域。大量研究表明它独特的凝胶性能主要是在一定条件下可以形成热不可逆(热稳定)凝胶和热可逆(热不稳定)凝胶。研究发现,KGM分子可以形成柔软的螺条,当乙酰基存在时,可以形成双螺旋结构。通过添加碱性物质,如氢氧化钠、氢氧化钙、碳酸钠等,可使KGM脱去乙酰基。当乙酰基脱除后,分子的螺旋结构被破坏,螺条相互交织成网状结构,则可形成热不可逆的魔芋凝胶[21]。此外,KGM还可通过与具有协同作用的胶体复配在水溶液中形成热可逆凝胶,例如KGM与黄原胶、结冷胶及卡拉胶等的复配。KGM和黄原胶的复配机理可解释为:二者在水溶液中加热溶解后,可初步形成三维网状结构,通过协同作用可形成热可逆凝胶[22]。在KGM与黄原胶复配体系中加入一定浓度的盐离子,可进一步提高凝胶强度和热稳定性。另外,KGM与一些在溶液中水解成多羟基水合物的盐类(如硼砂)也能形成凝胶。由硼砂解离的硼酸根离子易与KGM分子链发生配位作用,配位可使大分子互相缠绕,分子间距离减小,相互作用力增加,从而形成凝胶[23]。KGM凝胶性能受到多种因素的影响,如温度、浓度、pH值、KGM分子质量等。
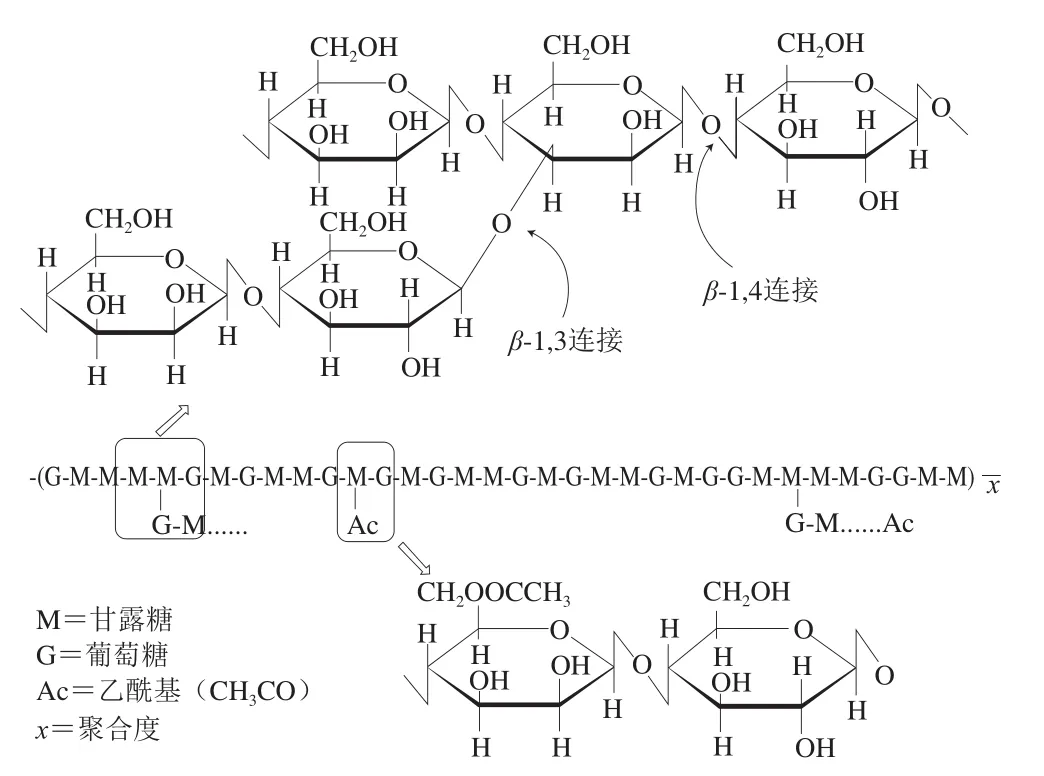
图7 KGM分子结构[21]Fig.7 Molecular structure of konjac glucomannan[21]
1.7 其他多糖
另外,可得然胶、卡拉胶等多糖也可作为天然高分子聚合物广泛应用于微凝胶的制备。可得然胶是一种新型的天然微生物多糖,不溶于水,但在水中会发生溶胀,加热后形成胶体,根据加热程度的不同,可分为高强度凝胶和低强度凝胶。高强度凝胶的强度与加热时间成正比,低强度凝胶则与加热时间无关[24]。卡拉胶是非均一多糖,其主要凝胶结构为κ-卡拉胶、ι-卡拉胶。κ-卡拉胶是一种热可逆凝胶,当升降温时会发生“溶胶↔凝胶”化转变,形成的凝胶性能较好,对钾离子敏感,凝胶性能易受K+的影响,ι-卡拉胶则对Ca2+较为敏感。当温度高于凝胶温度时,κ-卡拉胶中大分子链以不规则的线性团簇状态存在于溶液中。当温度降低时,无规线团就会聚集形成双螺旋结构,双螺旋进一步聚集则形成具有一定形态结构的凝胶[25]。κ-卡拉胶还可与KGM复配,形成以κ-卡拉胶网络结构为主体,KGM穿插其中的三维网络体系,从而改善凝胶的特性,两者的复配一直是食品胶体研究领域的热点。
2 微凝胶的制备方法
微凝胶颗粒的形成取决于多糖的性质和使用的制备方法[26]。通常,微凝胶的制备方法与多糖的物理化学现象(如分子缔合、离子交联或相分离)和机械过程(如挤压注射、剪切或雾化)有一定的关系[27]。微凝胶的制备方法还应根据应用的要求进行选择。例如,特定的应用可能需要具有特定组成、大小、形状、黏弹性、界面张力、释放特性等的微凝胶。常见的制备方法主要有剪切与研磨法、乳化法、微流控法、喷雾干燥法等。
2.1 剪切和研磨法
微凝胶可以通过剪切或研磨等机械力将宏观凝胶分解成微小的碎片来形成[28]。首先,通过改变温度(加热或冷却)或添加胶凝剂(酸、碱、酶等)促进多糖凝胶化形成宏观凝胶,接着宏观凝胶再进行剪切研磨为微凝胶(图8)。微凝胶制备过程中剪切速率和剪切时间对其粒径有一定的影响,一般来说随着剪切速率的增大和剪切时间的延长,微凝胶的尺寸会变小。然而,Matalanis等[29]发现随着剪切速率的增加,微凝胶的尺寸往往先因颗粒破碎而减小,后因颗粒聚集而增大。对剪切形成的凝胶颗粒的研究表明,微凝胶的尺寸和形状一般取决于生物聚合物的性质、剪切应力、剪切速率和剪切类型等。Wolf等[30]发现球形微凝胶往往在较低的剪切速率下形成,椭球体或纤维则在较高的剪切速率下形成。使用这种方法生产的微凝胶性质还取决于溶液黏度、界面张力及凝胶化步骤中使用的剪切力强度等。研究表明,通过剪切作用形成的微凝胶通常具有多分散性和不规则的形貌。Colmenero等[31]通过研磨凝胶化魔芋、卡拉胶和玉米淀粉混合物,成功制备出多糖微凝胶应用于食品工业中。该制备方法操作简单,设备普遍,有利于在食品工业中推广使用。
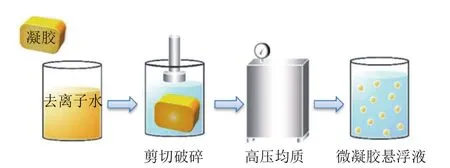
图8 剪切和研磨法制备微凝胶示意图[32]Fig.8 Schematic diagram of microgel preparation by sequential shearing and grinding[32]
2.2 乳化法
乳化法是目前实验室中较为常用的制备微凝胶的方法之一。通过将含有多糖的水相与含有疏水性表面活性剂的油相进行乳化,从而形成油包水乳液。微凝胶可以简单地通过将水/油乳液的水相凝胶化而形成,凝胶化过程可发生在乳化过程中或乳化后(图9)。Adams[33]、Loret[34]等在乳化后通过冷却制备了琼脂微凝胶,Torres等[35]采用该方法成功制备了淀粉微凝胶。粒子凝胶是通过适当改变体系条件,让水滴内的多糖进行交联。例如,可以将油包水乳液冷却到临界温度以下从而实现多糖的交联(如结冷胶),或加热到临界温度以上以交联热固化多糖(如可得然胶)。使用这种方法形成的凝胶颗粒的大小取决于油的黏度、油与胶体溶液的比例、乳化剂的类型等。随着凝胶的形成,其黏度会急剧增加,从而影响微凝胶的尺寸和形状。凝胶后,微凝胶颗粒可以通过离心、过滤或溶剂萃取方法从油相中分离出来。Kyzioł等[36]通过乳化法制备了壳聚糖包覆环丙沙星的海藻酸钙微球,是一种有效的口服给药体系。这种方法的局限性在于微凝胶中的油和表面活性剂不易去除。因此,选择合适的表面活性剂是一个重要的考虑因素。
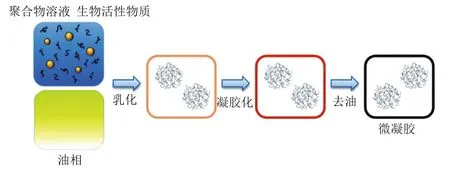
图9 乳化法制备微凝胶示意图[2]Fig.9 Schematic diagram of microgel preparation by emulsification[2]
2.3 微流控法
微流控是通过数十到数百微米尺度的通道来处理微尺度流体的技术(图10A)。与传统的流动控制技术相比,微流控装置具有许多优点,其可以确保精确的几何形状,可用于生产单分散的聚合物微粒,分析时间短且液滴尺寸可控[37]。微流控技术制备微凝胶颗粒主要是利用微流控芯片的乳化来实现的。通过微流控技术制备微凝胶颗粒主要就是对聚合物或者单体水溶液的乳化,以及在微流控芯片内(外)进行液滴的凝胶化过程。其中,液滴的性质和芯片的结构决定了微凝胶颗粒的尺寸和形貌[38]。可采用物理交联或化学交联两种方法使微凝胶在芯片通道内形成网络结构。例如,液滴在芯片的通道内流动过程中可通过离子交联、热诱导聚合、氧化还原引发聚合等方法实现交联聚合而最终形成微凝胶颗粒。已有研究表明,多糖类微凝胶颗粒可通过微流控装置成功制备[39]。此外,在微流控技术中可根据实验的要求选择不同的微通道构型。Kuo等[40]采用T型微通道制备了均一的壳聚糖微球(图10B)。Saeki等[41]则通过Y型微通道制备了单分散的海藻酸钙微凝胶颗粒,并且实现了对聚苯乙烯微珠的包覆(图10C)。T型和Y型微通道在微流控实验中较为常用。Bazban等[42]在交叉连接微通道组成的微流控平台上,通过调节流量比和混合时间来控制纳米凝胶的微观结构,从而制备了粒径可控的海藻酸钠微凝胶。微流控装置特别适合于实验室规模使用,因为它们对所形成微凝胶的特性可以实现精确的控制。然而,由于成本偏高且难以工业化量产,这一技术目前不太适合广泛商业应用。
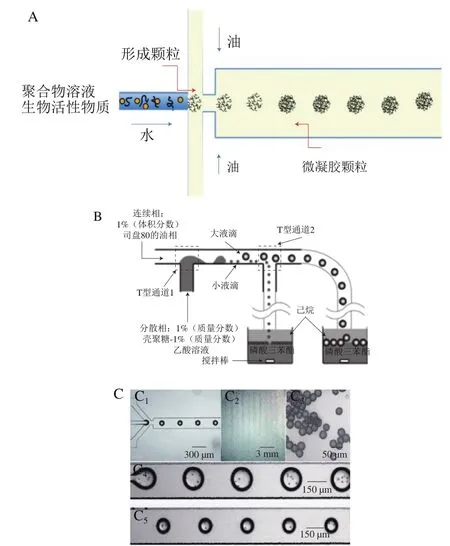
图10 微流控装置(A)、T型微流控装置(B)、Y型微流控装置(C)示意图[2,40-41]Fig.10 Schematic diagram of microfluidic device (A), T-type microfluidic device (B) and Y-type microfluidic device (C)[2,40-41]
2.4 喷雾干燥法
喷雾干燥法制备微凝胶颗粒包括喷雾与干燥两个紧密结合的工艺步骤(图11)。所谓喷雾,是将溶液、乳浊液等通过雾化器分散成极细的雾状液滴,而干燥则是雾状液滴在与热空气均匀混合后,迅速进行热质交换,使溶剂快速蒸发的过程;然后,用旋风将干燥的颗粒从潮湿空气中分离出来,并以粉末的形式收集起来得到干燥产品。该方法能直接使溶液、乳浊液等干燥成粉状或颗粒状制品,从而可省去蒸发、粉碎等工序,在食品工业中被广泛应用。微凝胶颗粒的大小可以通过溶液浓度、温度、压力、进风比和雾化方法等来控制[4]。Ching[43]、Strobel[44]等利用该工艺制备了海藻酸钙微凝胶颗粒,通过这种技术实现了对生物活性脂类的微胶囊化,可以促进生物活性脂类在人体胃肠道中的传递。一般来说,喷雾干燥产生的粉末中的固体颗粒尺寸在10~100 μm之间[45]。它适用于实验室规模和工业规模的凝胶颗粒的制备,在风味、益生菌的微胶囊化和药物传递等方面的应用已取得良好应用[46]。
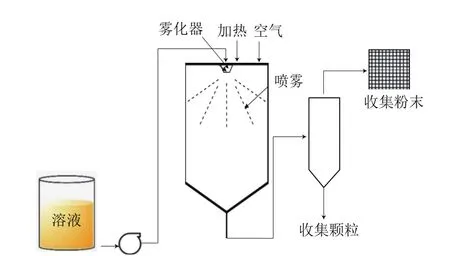
图11 喷雾干燥装置示意图Fig.11 Schematic diagram of spraying drying device
综上,对不同天然多糖微凝胶制备方法的优缺点进行了总结,如表1所示。
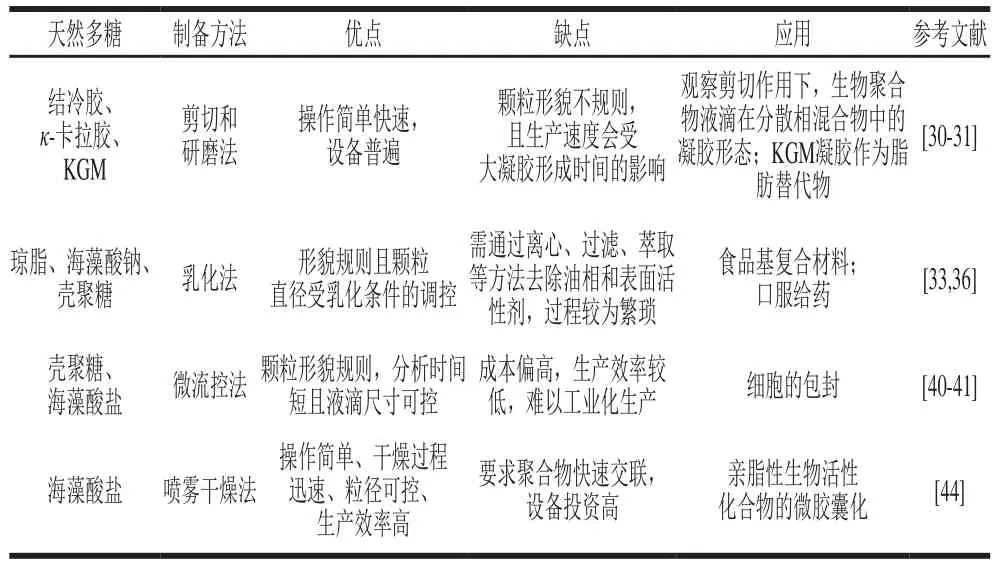
表1 不同天然多糖微凝胶制备方法的优缺点Table 1 Advantages and disadvantages of different preparation methods for natural polysaccharide microgels
3 天然多糖微凝胶的应用
天然多糖微凝胶具有良好的生物相容性、分散稳定性、可降解性、无毒性等特点,不仅可以作为Pickering乳液的稳定剂,还可用作食品、化妆品的调质剂,风味物质、营养成分等的包埋剂等[47]。在食品、化妆品、生物医药等方面都有着广泛的应用。
3.1 天然多糖微凝胶在食品领域中的应用
3.1.1 营养载体
大量研究表明天然多糖微凝胶颗粒因其具有胶囊化、保护和释放营养物质等方面的潜力而受到广泛关注。疏水性生物活性物质在促进人体健康方面具有诸多益处,但是其分散性差、化学稳定性低,限制了其在食品中的应用。研究发现微凝胶颗粒可以作为一个良好的载体来封装各类化合物,从小分子、固体颗粒到液滴、囊泡等[48]。这样,疏水性物质就能以微凝胶为载体,形成一种软固体颗粒,进而应用到食品中。Zhang Zipei等[49]研究了以颗粒形式包封于海藻酸钙微凝胶中的β-胡萝卜素,发现微凝胶可有效防止β-胡萝卜素的化学降解。此外,水不溶性多酚也可包封于海藻酸盐微凝胶中[50]。结果表明,颗粒的产率、有效荷载和包封效率主要取决于被包封颗粒的大小,可能和多酚与海藻酸盐的相互作用类型有关。研究还发现,荷载疏水性颗粒有利于提高微凝胶的产率,引入这些疏水性化合物后微凝胶颗粒的产率有所提高。微凝胶不仅适合于疏水性物质的包埋,还可用于亲水性物质的固定和包埋,并可显著改善生物活性物质在不同环境中的稳定性。例如,应用海藻酸钙微凝胶固定化乳糖酶效果良好[51]。
总之,以微凝胶为功能活性物质的载体,可显著改善疏水性生物活性物质和亲水性生物活性物质在水中的分散性和化学稳定性,拓宽功能因子在食品中的应用范围。
3.1.2 包埋益生菌
益生菌被广泛应用于各种食品和药品中,以促进人类健康。然而,在储存和胃肠道运输中保持益生菌的生存能力仍然是一个挑战,部分类型的益生菌在胃和小肠中接触胃酸、酶或胆盐时极易失活。因此,需要有效的递送系统来包埋和保护。包埋不仅可以为益生菌创造有益的微环境,还可阻止胃肠道液体中的成分与它们相互作用。大量研究显示天然多糖微凝胶在益生菌的封装、保护和释放方面有很大的潜力。目前,果胶微凝胶已被证明可以提高益生菌(鼠李糖乳杆菌LGG)的生存能力[52],该包封系统在体内和体外都保留了较高的鼠李糖乳杆菌LGG活性。Yeung等[53]研究发现可通过在海藻酸盐微凝胶包封基质中加入抗氧化剂和低温保护剂来优化递送载体,以此来提高双歧杆菌的生存能力,从而改善双歧杆菌的稳定性和有效性。
3.1.3 包埋风味物质
风味物质在食品中有着不可或缺的作用,基于对香气释放速率的研究,微凝胶颗粒被设计用来减缓低脂食品中亲脂性香气分子的释放。微凝胶颗粒的包埋可有效抑制风味物质在储藏期间的释放。例如,海藻酸盐微凝胶被用于封装香精油(如百里香精油),以提高其在食品中的分散性和稳定性。不同组成的微凝胶颗粒已经被证明能够在模拟的口腔条件下控制味觉和香气分子的释放[54-55]。Petzold等[56]利用海藻酸钙/壳聚糖微凝胶包封烟用液体香精,液体烟雾在低温时被保留在粒子内部,而当它们被加热到一定温度时就会释放出来。微凝胶控制风味释放的有效性与风味分子的特性,如分子质量和极性等有一定的关系。
3.1.4 作为食品乳化剂
生物来源的固体颗粒由于选择性广、安全性高、生物相容性好等优势,近年来已成为Pickering乳液颗粒乳化剂的研究热点。微凝胶颗粒可以作为乳化剂稳定食品乳液。与传统表面活性剂稳定的乳液相比,天然多糖微凝胶稳定的乳液具有稳定性高、毒性小、可重复使用等优点,能为人们提供绿色健康的食品配料。Toya等[57]分别采用自下而上和自上而下的方法,对琼脂、可得然胶和结冷胶3 种多糖进行了微凝胶化,并证明了琼脂和可得然胶形成的微凝胶具有乳化食用油的能力,可作为食品乳化剂。不仅如此,海藻酸钙微凝胶也被证明具有乳化食用油的能力。杨鑫等[58]通过乳液凝胶法制备了海藻酸钙微凝胶,该微凝胶表面包覆有二氧化钛纳米颗粒,使得海藻酸钙微球能够稳定油包水型的Pickering乳液。通过控制微球的含量,可以对Pickering乳液的粒径大小进行调控。Yang Jisheng等[59]通过反乳液法制备了改性海藻酸钙微凝胶,证明海藻酸钙微球能够用于稳定水包油型的Pickering乳液。
3.1.5 作为脂肪替代物
随着人们生活水平的提高,消费者的肥胖水平也在不断上升,低脂类肉制品受到越来越多消费者的青睐。脂肪替代物已经成为食品行业的研究热点。微凝胶可以作为脂肪替代物,减少食品中的脂肪用量以及人体摄入量。范素琴等[60]将海藻酸钠复合微凝胶作为脂肪替代物,得到了外观和质构都较理想的脂肪替代品。以天然多糖微凝胶制作的脂肪替代物不但可降低热量,还可降低胆固醇含量,符合人们追求营养、安全、健康的要求。另外,多糖微凝胶被研磨成不同大小的颗粒后,还可以满足外观、技术和感官特性等方面的要求。微凝胶作为脂肪的替代品被添加到肉制品中时,需要考虑其物理化学特性,例如在肉制品中所替代脂肪的特性(包括形状大小、颜色、结构特性和流变特性等)。Colmenero等[31]通过研磨凝胶化的魔芋胶、卡拉胶和玉米淀粉混合物制得微凝胶,其可以作为肉制品中猪肉背脂的替代品。此外,多糖微凝胶还被用于法兰克福香肠,新鲜香肠等[61]。目前,魔芋凝胶用作脂肪替代品在低脂肉制品中的应用已取得较大进展。
3.2 天然多糖微凝胶在医药领域中的应用
微凝胶颗粒具有封装、保护和释放各种药物的能力,可用于荷载小分子药物、多肽、蛋白质、DNA、细胞和细菌等[2]。目前,基于海藻酸盐的微凝胶颗粒已被用于封装多种药物制剂,其相对温和的凝胶化过程可以使蛋白质、细胞、DNA等结合到海藻酸盐基质中,从而保持完整的生物活性[62]。微凝胶在医药行业的应用主要集中于药物的缓控释以及靶向给药方面。
3.2.1 口服给药
口服给药是药物疗法中较常采用的给药方式,因比注射给药更方便、痛苦更少而被广为接受。目前,由天然多糖制备的微凝胶颗粒已被用于封装多种药物,即将生物活性成分包裹在纳米或微米颗粒中,可进一步保留药物活性。pH值响应性微凝胶颗粒也已被开发用于口服干扰小RNA的递送,以靶向治疗消化道炎症[63]。Sun Quancai等[64]将胰岛素与氢氧化镁共同封装于海藻酸钙微凝胶中,这种微凝胶可以使用温和的制备方法组装,从而保护胰岛素免受胃酸和胃蛋白酶引起的失活。该研究表明,在模拟胃环境下,抗酸微凝胶中包裹的胰岛素的生物活性可以被有效保护。因此,天然多糖微凝胶可能成为口服胰岛素的有效手段。
3.2.2 注射给药
近年来,温敏型可注射微凝胶引起了人们的关注。在没有接近人体体温时,这种微凝胶以溶液状态包埋药物。注射后,由于温度的变化,溶液迅速转变为半固体状微凝胶。药物在自身扩散或降解作用下从微凝胶中平稳地释放出来,从而达到缓释效果。对于一些口服药物不适的人,温敏型注射微凝胶包埋的药物是一种良好的选择,可直接注射从而避免胃肠道降解。Chenite等[65]提出了一种基于壳聚糖/多元醇组合的新型热敏微凝胶制备方法,用于封装活细胞和蛋白。此复合物具有温敏性,即在室温条件下为均一溶液,可以包埋药物。当注射体内后,在体温条件下转变成生物可降解的半固体状凝胶。Kofuji等[66]研究发现,将钒-壳聚糖络合物加入到壳聚糖凝胶中,可以实现对钒释放的控制。将此凝胶注射到糖尿病小鼠体内后,可起到降血糖作用,并且由于钒的缓慢释放可将其毒副作用减至最低。壳聚糖微凝胶对钒类化合物的缓控释作用可实现长效、低毒的效果,具有良好的临床应用前景。
3.3 天然多糖微凝胶在化妆品领域的应用
化妆品乳剂是由两种互不相溶的液体构成的分散乳状液,其配方一般由油相和表面活性剂组成。研究发现,微凝胶网络中含有大量的水分,同时具有良好的生物相容性和可降解性,可以作为乳化剂以满足在一种化妆品中同时添加多种活性物的需要。另外,微凝胶作为乳化剂可以通过控制活性物质的释放,从而延长活性物质作用时间,是高档化妆品研发的一个新趋势。选用无刺激性的天然多糖微凝胶来替代传统的表面活性剂不仅可使产品的刺激性大大降低,还可以提高化妆品的黏稠性,使皮肤角质软化,具有保持皮肤水嫩湿润的作用[67]。此外,由于微凝胶颗粒乳化体系的稳定性与油脂性质无关,因此针对不同的化妆品,还可以选择更为合适的油脂,以制备出效果更佳、更受欢迎的产品。刘敬成等[68]通过对壳聚糖进行改性,制备了水溶性光敏壳聚糖衍生物,以该衍生物胶体粒子作为乳化剂稳定油水体系,所得乳液可抗紫外线且具有长期的稳定性。
3.4 天然多糖微凝胶在其他领域的应用
多糖微凝胶除了上述应用领域外,还可应用于农业、环保等领域。在农业领域,多糖微凝胶常用来保护土壤中的水分和营养物质,可有效改善土壤的物理性质,从而增加农作物的产量[69-70]。此外,微凝胶也可以作为重金属离子的吸附剂,用于污水净化[71],有助于改善环境。Wang Xia等[72]研制了一种由磁性Fe3O4和结冷胶组成的高效吸附剂,该吸附剂将磁性分离与离子交换技术相结合,可有效地去除重金属,对于环境优化有很大的帮助。
4 结 语
天然多糖微凝胶因其独特的生物相容性、可降解性、无毒性等越来越受到研究人员的青睐,近年来已得到广泛的关注和研究。开发利用新型天然多糖资源,研制多重响应性微凝胶及不同组合微凝胶,将会是未来的一个发展方向。此外,应当加强天然多糖微凝胶的开发力度,特别是在提高微凝胶功能特性、凝胶形成机理等方面,以拓展天然多糖微凝胶功能材料的应用。随着微凝胶制备方法的日趋完善和新材料、新技术的不断引入,未来天然多糖微凝胶的应用范围将更加广泛。
- 食品科学的其它文章
- 花中多糖化学组成与生物活性研究进展
- 番茄碱的制备及其对乙酰胆碱酯酶的抑制作用
- 色氨酸抑制体外模型中晚期糖基化终末产物形成机理
- 松油烯-4-醇对荧光假单胞菌抑菌能力及作用机理
- Widely Targeted Metabolomic and Transcriptomic Analyses Reveal the Regulation of Trypsin on Antioxidant Enzymes and Saturated Fatty Acids in Hylocereus undatus Fruit during Storage
- 乙烯利处理‘赤霞珠’葡萄果实对其葡萄酒中酚类物质组分的影响

